基本介紹
- 書名:結直腸癌診療規範(2010年版)
- 出版社:衛生部
- 出版時間:2010年10月14日
- 代號:衛辦醫政發165號
前言,套用,病理評估,外科治療,內科治療,放射治療規範,治療規範,治療規範,康復治療,隨訪,附錄,相關文獻,
前言
近年來,隨著人民生活水平的不斷提高,飲食習慣和飲食結構的改變以及人口老齡化,我國結直腸癌(colorectal cancer,CRC)的發病率和死亡率均保持上升趨勢。其中,結腸癌的發病率上升尤為顯著。大多數患者發現時已屬於中晚期。
套用
(一)臨床表現
早期結直腸癌可無明顯症狀,病情發展到一定程度才出現下列症狀:
1.排便習慣改變。
3.腹痛或腹部不適。
4.腹部腫塊。
5.腸梗阻。
(二)體格檢查
1.一般狀況評價、全身淺表淋巴結情況。
3.直腸指檢:凡疑似結直腸癌者必須常規作肛門直腸指診。了解腫瘤大小、質地、占腸壁周徑的範圍、基底部活動度、距肛緣的距離、腫瘤向腸外浸潤狀況、與周圍臟器的關係等。指檢時必須仔細觸摸,避免漏診;觸摸輕柔,切忌擠壓,觀察是否指套血染。
(三)實驗室檢查
1.血常規:了解有無貧血。
4.糞便隱血試驗:針對消化道少量出血的診斷有重要價值。
(四)內窺鏡檢查
直腸鏡和乙狀結腸鏡適用於病變位置較低的結直腸病變。
1.一般狀況不佳,難以耐受;
3.肛周或嚴重腸道感染、放射性腸炎;
4.婦女妊娠期和月經期。
內窺鏡檢查之前,必須做好準備,檢查前進流質飲食,服用瀉劑,或行清潔洗腸,使腸腔內糞便排淨。
由於結腸腸管在檢查時可能出現皺縮,因此內窺鏡所見腫物距離肛門距離可能存在誤差,建議結合CT或鋇劑灌腸明確病灶部位。
(五)影像檢查
3.CT檢查:CT檢查的作用在於明確病變侵犯腸壁的深度,向壁外蔓延的範圍和遠處轉移的部位。目前,結直腸病變的CT檢查推薦用於以下幾個方面:
(1)提供結直腸惡性腫瘤的分期;
(2)發現復發腫瘤;
(3)評價腫瘤對各種治療的反應;
(4)闡明鋇劑灌腸或內窺鏡發現的腸壁內和外在性壓迫性病變的內部結構,明確其性質;
(5)對鋇劑檢查發現的腹內腫塊作出評價,明確腫塊的來源及其與周圍臟器的關係。
4.MRI檢查:MRI檢查的適應證同CT檢查。推薦以下情況首選MRI檢查:
(1)直腸癌的術前分期;
(2)結直腸癌肝轉移病灶的評價;
(3)懷疑腹膜以及肝被膜下病灶。
5. 經直腸腔內超聲:推薦直腸腔內超聲或內鏡超聲檢查為中低位直腸癌診斷及分期的常規檢查。
6.PET-CT:不推薦常規使用,但對於常規檢查無法明確的轉移復發病灶可作為有效的輔助檢查。
7.排泄性尿路造影:不推薦術前常規檢查,僅適用於腫瘤較大可能侵及尿路的患者。
(六)血清腫瘤標誌物
(七)病理組織學檢查
病理活檢明確占位性質是結直腸癌治療的依據。活檢診斷為浸潤性癌的病例進行規範性結直腸癌治療。如因活檢取材的限制,活檢病理不能確定浸潤深度,診斷為高級別上皮內瘤變的病例,建議臨床醫師綜合其他臨床情況,確定治療方案。確定為復發或轉移性結直腸癌時,檢測腫瘤組織K-ras基因狀態。
(八)開腹探查
如下情況,建議行開腹探查:
1.經過各種診斷手段尚不能明確診斷且高度懷疑結直腸腫瘤。
2.出現腸梗阻,進行保守治療無效。
3.可疑出現腸穿孔。
4.保守治療無效的消化道大出血。
(九)結直腸癌的診斷步驟
結直腸癌診斷步驟參見附圖-1。
(十)結直腸癌的鑑別診斷
1.結腸癌應當主要與以下疾病進行鑑別:
(3)腸結核。在我國較常見,好發部位在迴腸末端、盲腸及升結腸。常見症狀有腹痛、腹塊、腹瀉、便秘交替出現,部分患者可有低熱、貧血、消瘦、乏力,腹部腫塊,與結腸癌症狀相似。但腸結核患者全身症狀更加明顯,如午後低熱或不規則發熱、盜汗、消瘦乏力,需注意鑑別。
(5)血吸蟲性肉芽腫。多見於流行區,目前已少見。少數病例可癌變。結合血吸蟲感染病史,糞便中蟲卵檢查,以及鋇劑灌腸和纖維結腸鏡檢查及活檢,可以與結腸癌進行鑑別。
2.直腸癌應當與以下疾病進行鑑別:
(4)直腸息肉。主要症狀是便血,纖維結腸鏡檢查及活檢為有效鑑別手段。
病理評估
(一)標本固定標準
2.固定液量:必須 ≥ 所固定標本體積的10倍。
3.固定溫度:正常室溫。
4.固定時間:內鏡下切除腺瘤或活檢標本:≥6小時,≤48小時。
手術標本:≥12小時,≤48小時。
(二)取材要求
1.活檢標本。
(1)核對臨床送檢標本數量,送檢活檢標本必須全部取材。
(2)每個蠟塊內包括不超過5粒活檢標本。
(3)將標本包於紗布或柔軟的透水紙中以免丟失。
2. 內鏡下切除的腺瘤標本。
(1)送檢標本由手術醫師展平固定,標記方位。
(2)記錄腫瘤的大小,各方位距切緣的距離。
(3)垂直於腸壁,每間隔0.3cm平行切開標本,分成適宜大小的組織塊,推薦按同一包埋方向全部取材。記錄組織塊對應的方位。
3. 手術標本。
(1)腸壁及腫瘤。
①沿腸壁長軸、垂直於腸壁切取腫瘤標本,腫瘤組織充分取材,視腫瘤大小、浸潤深度、不同質地、顏色等區域分別取材(常規4塊),腫瘤浸潤最深處至少1塊全層厚度腫瘤及腸壁組織,以判斷腫瘤侵犯的最深層次。切取能夠顯示腫瘤與鄰近黏膜關係的組織(常規2塊)。
②切取遠側、近側手術切緣。環周切緣按手術醫師標記的部分切取。
③記錄腫瘤距遠側及近側切緣的距離。
(2)淋巴結。
建議外科醫師根據局部解剖體徵和術中所見,分組送檢淋巴結,有利於淋巴結引流區域的定位;在未接到手術醫師分組送檢醫囑或標記的情況下,病理醫師按照以下原則檢出標本中的淋巴結:
全部淋巴結均需取材(建議檢出至少12枚淋巴結。接受過術前治療患者的淋巴結可以低於12枚)。所有肉眼陰性的淋巴結應當完整送檢,肉眼陽性的淋巴結可部分切取送檢。
(3)推薦取材組織塊體積:不大於2×1.5×0.3cm。
(三)取材後標本處理原則和保留時限
1.剩餘標本的保存。取材剩餘組織保存在標準固定液中,並始終保持充分的固定液量和甲醛濃度,避免標本乾枯或因固定液量不足或濃度降低而致組織腐變;以備根據鏡下觀察診斷需求而隨時補充取材;以備在病理診斷報告簽發後接到臨床反饋信息時複查大體標本或補充取材。
2.剩餘標本處理的時限。建議在病理診斷報告簽發1個月後,未接到臨床反饋信息,未發生因外院會診意見分歧而要求複審等情形後,可由醫院自行處理。
(四)病理類型
1.早期結直腸癌。
癌細胞限於結直腸黏膜下層者稱早期結直腸癌(pT1)。WHO消化道腫瘤分類將黏膜層內有浸潤的病變亦稱之為“高級別上皮內瘤變”。
2.進展期結直腸癌的大體類型。
(1)隆起型。凡腫瘤的主體向腸腔內突出者,均屬本型。
(2)潰瘍型。腫瘤形成深達或貫穿肌層之潰瘍者均屬此型。
(3)浸潤型。腫瘤向腸壁各層瀰漫浸潤,使局部腸壁增厚,但表面常無明顯潰瘍或隆起。
3. 組織學類型。
(2)未分化癌;
(3)腺鱗癌;
(4)鱗狀細胞癌;
(5)小細胞癌;
(6)類癌。
4. 分級與組織學類型的關係。
結直腸癌細胞分級與組織學類型的關係見表1。
表1 分級與組織學類型的關係
(五)病理報告內容
1. 活檢標本的病理報告內容和要求:
(1)患者基本信息及送檢信息。
(3)如有癌變,區分組織學類型。
臨床醫師應當了解受活檢取材深度限制,活檢病理不能完全確定浸潤深度,故癌變組織可能為局限於黏膜內的癌(高級別上皮內瘤變或黏膜內癌)。
2. 內鏡下切除的腺瘤標本的病理報告內容和要求:
(1)患者基本信息及送檢信息。
(2)腫瘤的大小。
(3)上皮內瘤變(異型增生)的分級。
如有癌變,報告癌變組織的組織學分型、分級、浸潤深度、切緣情況、脈管侵犯情況。
pT1、Ⅲ與Ⅳ級分化、脈管侵犯、切緣陽性,臨床應當再行外科手術擴大切除範圍。其他情況腸鏡下切除已足夠,但術後需定期隨訪。
①癌變的腺瘤中有癌細胞浸潤穿透黏膜肌層到達黏膜下層(pT1)。
②預後良好的組織學特徵包括:Ⅰ或Ⅱ級分化,無血管、淋巴管浸潤,“切緣陰性”。
③預後不良的組織學特徵包括:Ⅲ或Ⅳ級分化,血管、淋巴管浸潤,“切緣陽性”。
④陽性切緣定義為:腫瘤距切緣小於1mm或電刀切緣可見癌細胞。
3. 手術標本的病理報告內容和要求:
(1)患者基本信息及送檢信息。
(2)大體情況:腫瘤大小、大體類型、肉眼所見浸潤深度、切除腸管兩端距腫瘤遠近端的長度。
(3)腫瘤分化程度(腫瘤分型、分級)。
(4)腫瘤浸潤深度(T分期)(T分期或ypT是根據有活力的腫瘤細胞來決定的,經過新輔助治療的標本內無細胞的黏液湖不認為是腫瘤殘留)。
(5)檢出淋巴結數目以及陽性淋巴結數目(N分期)。
(6)近端切緣、遠端切緣的狀況。
(7)建議報告環周切緣的狀況(如果腫瘤距切緣很近,應當在顯微鏡下測量並報告腫瘤與切緣的距離,腫瘤距切緣1mm以內報切緣陽性)。
(8)脈管侵犯情況(以V代表血管,V1為鏡下血管浸潤,V2為肉眼血管浸潤,L代表淋巴管)。
(9)神經侵犯。
(10)K-ras基因狀態,確定為復發或轉移性結直腸癌時。如無手術切除標本可從活檢標本中測定。
附:結直腸癌TNM分期
原發腫瘤(T)
Tx 原發腫瘤無法評價
T0 無原發腫瘤證據
Tis 原位癌:局限於上皮內或侵犯黏膜固有層
T1 腫瘤侵犯黏膜下層
T2 腫瘤侵犯固有肌層
T3 腫瘤穿透固有肌層到達漿膜下層,或侵犯無腹膜覆蓋的結直腸旁組織
T4a 腫瘤穿透腹膜髒層
T4b 腫瘤直接侵犯或粘連於其他器官或結構
區域淋巴結(N)
Nx 區域淋巴結無法評價
N0 無區域淋巴結轉移
N1 有1-3枚區域淋巴結轉移
N1a 有1枚區域淋巴結轉移
N1b 有2-3枚區域淋巴結轉移
N2 有4枚以上區域淋巴結轉移
N2a 4-6枚區域淋巴結轉移
N2b 7枚及更多區域淋巴結轉移
遠處轉移(M)
M0 無遠處轉移
M1 有遠處轉移
M1a 遠處轉移局限於單個器官或部位(如肝,肺,卵巢,非區域淋巴結)
M1b 遠處轉移分布於一個以上的器官/部位或腹膜轉移
解剖分期/預後組別
 解剖分期/預後組別
解剖分期/預後組別註:1.cTNM是臨床分期,pTNM是病理分期;前綴y用於接受新輔助(術前)治療後的腫瘤分期(如ypTNM),病理學完全緩解的患者分期為ypT0N0cM0,可能類似於0期或1期。前綴r用於經治療獲得一段無瘤間期後復發的患者(rTNM)。
Dukes B期包括預後較好(T3N0M0)和預後較差(T4N0M0)兩類患者,Dukes C期也同樣(任何TN1M0和任何TN2M0)。MAC是改良Astler-Coller分期。
2.Tis包括腫瘤細胞局限於腺體基底膜(上皮內)或黏膜固有層(黏膜內),未穿過黏膜肌層到達黏膜下層。
3.T4的直接侵犯包括穿透漿膜侵犯其他腸段,並得到鏡下診斷的證實(如盲腸癌侵犯乙狀結腸),或者位於腹膜後或腹膜下腸管的腫瘤,穿破腸壁固有基層後直接侵犯其他的臟器或結構,例如降結腸後壁的腫瘤侵犯左腎或側腹壁,或者中下段直腸癌侵犯前列腺、精囊腺、宮頸或陰道。
4.腫瘤肉眼上與其他器官或結構粘連則分期為cT4b。但是,若顯微鏡下該粘連處未見腫瘤存在則分期為pT3。V和L亞分期用於表明是否存在血管和淋巴管浸潤,而PN則用以表示神經浸潤(可以是部位特異性的)。
外科治療
(一)結腸癌的外科治療規範
1.結腸癌的手術治療原則。
(2)建議切除足夠的腸管,清掃區域淋巴結,整塊切除。
(3)推薦銳性分離技術。
(4)推薦由遠及近的手術清掃。建議先處理腫瘤滋養血管。
(5)推薦手術遵循無瘤原則。
(6)推薦切除腫瘤後更換手套並沖洗腹腔。
(7)如果患者無出血、梗阻、穿孔症狀,且已失去根治性手術機會,則無首先姑息性切除原發灶必要。
2. 早期結腸癌的手術治療。
(1)T1N0M0結腸癌:建議局部切除。術前直腸腔超音波檢查屬T1或局部切除術後病理提示T1,如果切除完整而且具有預後良好的組織學特徵(如分化程度良好、無脈管浸潤),則無論是廣基還是帶蒂,不推薦再行手術切除。如果是帶蒂但具有預後不良的組織學特徵,或者非完整切除,標本破碎切緣無法評價,推薦行結腸切除術加區域淋巴結清掃。
(3)所有患者術後均須定期行全結腸鏡檢查以排除是否存在多發腺瘤或多發腸癌。
註:局部切除標本必須由手術醫師展平、固定,標記方位後送病理檢查。
3. T2-4,N0-2,M0結腸癌。
(1)首選的手術方式是相應結腸切除加區域淋巴結清掃。區域淋巴結清掃必須包括腸旁,中間和系膜根部淋巴結三站。建議標示系膜根部淋巴結並送病理學檢查;如果懷疑清掃範圍以外的淋巴結有轉移必須完整切除,無法切除者視為姑息切除。
(2)對具有遺傳性非息肉病性結直腸癌(hereditary nonpolyposis colorectal cancer, HNPCC)家族史,或有明顯的結腸癌家族史,或同時多原髮結腸癌的患者建議行更廣泛的結腸切除術。
(3)腫瘤侵犯周圍組織器官建議聯合臟器整塊切除。
(5)行腹腔鏡輔助的結腸切除術推薦滿足如下條件:①由有經驗的外科醫師實施手術;
②原發灶不在橫結腸(除非進行臨床試驗);
③無嚴重影響手術的腹腔粘連;
④無局部進展期或晚期病變的表現;
⑤無急性腸梗阻或穿孔的表現;
⑥保證能進行全腹腔的探查。
4.肝轉移外科治療的原則。
參見結直腸癌肝轉移治療規範。
5.肺轉移外科治療的原則。
(1)原發灶必須能根治性切除(R0)。
(2)有肺外可切除病灶並不妨礙肺轉移瘤的切除。
(3)完整切除必須考慮到腫瘤範圍和解剖部位,肺切除後必須能維持足夠功能。
(4)某些患者可考慮分次切除。
(二)直腸癌的外科治療
直腸癌的手術的腹腔探查處理原則同結腸癌。
1.直腸癌局部切除(T1N0M0)。
早期直腸癌(T1N0M0)的治療處理原則同早期結腸癌。
早期直腸癌(T1N0M0)如經肛門切除必須滿足如下要求:(1)侵犯腸周徑<30%;
(2)腫瘤大小<3cm;
(3)切緣陰性(距離腫瘤>3mm);
(4)活動,不固定;
(5)距肛緣8cm以內;
(6)僅適用於T1腫瘤;
(7)內鏡下切除的息肉,伴癌浸潤,或病理學不確定;
(8)無血管淋巴管浸潤(LVI)或神經浸潤;
(9)高-中分化;
(10)治療前影像學檢查無淋巴結腫大的證據。
註:局部切除標本必須由手術醫師展平、固定,標記方位後送病理檢查。
2.直腸癌(T2-4,N0-2,M0)。
必須爭取根治性手術治療。中上段直腸癌推薦行低位前切除術;低位直腸癌推薦行腹會陰聯合切除術或慎重選擇保肛手術。中下段直腸癌必須遵循直腸癌全系膜切除術原則,儘可能銳性游離直腸系膜,連同腫瘤遠側系膜整塊切除。腸壁遠切緣距離腫瘤≥2cm,直腸系膜遠切緣距離腫瘤≥5cm或切除全直腸系膜。在根治腫瘤的前提下,儘可能保持肛門括約肌功能、排尿和性功能。治療原則如下:
(1)切除原發腫瘤,保證足夠切緣,遠切緣至少距腫瘤遠端2cm。下段直腸癌(距離肛門小於5cm)遠切緣距腫瘤1~2cm者,建議術中冰凍病理檢查證實切緣陰性。
(2)切除引流區域淋巴脂肪組織。
(3)儘可能保留盆腔自主神經。
(4)新輔助(術前)放化療後推薦間隔4~8周進行手術。
(5)腫瘤侵犯周圍組織器官者爭取聯合臟器切除。
(6)合併腸梗阻的直腸新生物,臨床高度懷疑惡性,而無病理診斷,不涉及保肛問題,並可耐受手術的患者,建議剖腹探查。
(7)對於已經引起腸梗阻的可切除直腸癌,推薦行Ⅰ期切除吻合,或Hartmann手術,或造瘺術後Ⅱ期切除,或支架植入解除梗阻後II期切除。Ⅰ期切除吻合前推薦行術中腸道灌洗。如估計吻合口瘺的風險較高,建議行Hartmann手術或Ⅰ期切除吻合及預防性腸造口。
(8)如果腫瘤局部晚期不能切除或臨床上不能耐受手術,推薦給予姑息性治療,包括選用放射治療來處理不可控制的出血、支架植入來處理腸梗阻以及支持治療。
3.直腸癌的肝、肺轉移。
直腸癌的肝、肺轉移灶的治療原則同結腸癌。
內科治療
(一)結直腸癌的新輔助治療
1.直腸癌的新輔助放化療。
(1)直腸癌術前治療推薦以氟尿嘧啶類藥物為基礎的新輔助放化療。
(2)T1-2N0M0或有放化療禁忌的患者推薦直接手術,不推薦新輔助治療。
(3)T3和/或N+的可切除直腸癌患者,推薦術前新輔助放化療。
(4)T4或局部晚期不可切除的直腸癌患者,必須行新輔助放化療。治療後必須重新評價,並考慮是否可行手術。
治療後必須重新評價,並考慮是否可行手術。
(二)結直腸癌輔助治療
I期(T1-2N0M0)或者有放化療禁忌的患者不推薦輔助治療。
②Ⅱ期結直腸癌,有高危因素者,建議輔助化療。化療方案推薦選用5-FU/LV、卡培他濱、5-FU/LV/奧沙利鉑或 CapeOx方案。化療時限應當不超過6個月。有條件者建議檢測組織標本MMR或MSI,如為dMMR或MSI-H,不推薦氟尿嘧啶類藥物的單藥輔助化療。
2.直腸癌輔助放化療。
(三)晚期/轉移性結直腸癌化療
1.在治療前檢測腫瘤K-ras基因狀態,EGFR不推薦作為常規檢查項目。
5.晚期患者若一般狀況或器官功能狀況很差,推薦最佳支持治療,不建議化療。
6.如果轉移復發局限於肝,建議考慮針對肝病灶的局部治療。
(四)局部/區域化療
放射治療規範
(一)直腸癌放射治療適應證
直腸癌放療或放化療的主要目的為輔助治療和姑息治療。輔助治療的適應證主要針對Ⅱ~Ⅲ期直腸癌;姑息性治療的適應證為腫瘤局部區域復發和/或遠處轉移。對於某些不能耐受手術或者有強烈保肛意願的患者,可以試行根治性放療或放化療。
1.I期直腸癌不推薦放療。但局部切除術後,有以下因素之一,推薦行根治性手術;如拒絕或無法手術者,建議術後放療。
(1)術後病理分期為T2;
(2)腫瘤最大徑大於4cm;
(3)腫瘤占腸周大於1/3者;
(4)低分化腺癌;
(5)神經侵犯或脈管瘤栓;
(6)切緣陽性或腫瘤距切緣<3mm。
2.臨床診斷為Ⅱ/Ⅲ期直腸癌,推薦行術前放療或術前同步放化療。
3.根治術後病理診斷為Ⅱ/Ⅲ期直腸癌,如果未行術前放化療者,必須行術後同步放化療。
5.局部區域復發的直腸癌,首選手術;如無手術可能,推薦放化療。
6.Ⅳ期直腸癌:對於初治Ⅳ期直腸癌,建議化療±原發病灶放療,治療後重新評估可切除性;轉移灶必要時行姑息減症放療。
7.復發轉移直腸癌:可切除的局部復發患者,建議先行手術切除,然後再考慮是否行術後放療。不可切除局部復發患者,推薦行術前同步放化療,並爭取手術切除。
(二)放射治療技術
1.靶區定義。
必須進行原發腫瘤高危復發區域和區域淋巴引流區照射。
(2)區域淋巴引流區包括真骨盆內髂總血管淋巴引流區、直腸系膜區、髂內血管淋巴引流區和閉孔淋巴結區。
(3)有腫瘤和/或殘留者,全盆腔照射後局部縮野加量照射。
(4)盆腔復發病灶的放療。
①既往無放療病史,建議行原發腫瘤高危復發區域、區域淋巴結引流區(真骨盆區)照射和腫瘤局部加量放療。
②既往有放療史,根據情況決定是否放療。
2.照射技術。
根據醫院具有的放療設備選擇不同的放射治療技術,如常規放療、三維適形放療、調強放療、圖像引導放療等。
(2)必須三野及以上的多野照射。
(3)如果調強放療,必須進行計畫驗證。
(4)局部加量可採用術中放療或外照射技術。
3.照射劑量。
無論使用常規照射技術還是三維適形放療或調強放療等新技術,都必須有明確的照射劑量定義方式。三維適形照射和調強放療必須套用體積劑量定義方式,常規照射套用等中心點的劑量定義模式。
(1)原發腫瘤高危復發區域和區域淋巴引流區推薦DT45-50.4Gy,每次1.8-2.0Gy,共25或28次。術前放療如採用5x5 Gy/5次/1周或其他劑量分割方式,有效生物劑量必須≥30 Gy。
(2)有腫瘤和/或殘留者,全盆腔照射後局部縮野加量照射DT10-20Gy。
(三)同步放化療的化療方案和順序
治療規範
(一)結直腸癌肝轉移的定義
1.國際通用分類:
①同時性肝轉移。結直腸癌確診時發現的或結直腸癌原發灶根治性切除術後6個月內發生的肝轉移。
②異時性肝轉移。結直腸癌根治術6個月後發生的肝轉移。
2.結直腸癌確診時合併肝轉移與結直腸癌原發灶根治術後的肝轉移在診斷和治療上有較大差異,因此本規範按“結直腸癌確診時合併肝轉移”和“結直腸癌根治術後發生肝轉移”兩方面闡述。
(二)結直腸癌肝轉移的診斷
1.結直腸癌確診時肝轉移的診斷。
(2)肝轉移灶的經皮針刺活檢僅限於病情需要時套用。
(3)結直腸癌手術中必須常規探查肝臟以進一步排除肝轉移的可能,對可疑的肝臟結節可考慮術中活檢。
2.結直腸癌原發灶根治術後肝轉移的診斷。
(三)結直腸癌肝轉移的治療
手術完全切除肝轉移灶仍是目前能治癒結直腸癌肝轉移的最佳方法,故符合條件的患者均應當在適當的時候接受手術治療。對部分最初肝轉移灶無法切除的患者應當經多學科討論慎重決定新輔助化療和手術時機,創造一切機會使之轉化為可切除病灶。
1.肝轉移灶手術的適應證和禁忌證。
(1)適應證:
①結直腸癌原發灶能夠或已經根治性切除。
②根據肝臟解剖學基礎和病灶範圍肝轉移灶可完全(R0)切除,且要求保留足夠的肝臟功能,肝臟殘留容積≥50%(同步原發灶和肝轉移灶切除)或≥30%(分階段原發灶和肝轉移灶切除)。
③患者全身狀況允許,沒有不可切除的肝外轉移病變。
(2)禁忌證:
①結直腸癌原發灶不能取得根治性切除;
②出現不能切除的肝外轉移;
③預計術後殘餘肝臟容積不夠;
④患者全身狀況不能耐受手術。
2.可切除的結直腸癌肝轉移的治療。
(1)手術治療。
①結直腸癌確診時合併肝轉移。
在下列情況下,建議結直腸癌原發灶和肝轉移灶同步切除:肝轉移灶小、且多位於周邊或局限於半肝,肝切除量低於50%,肝門部淋巴結、腹腔或其他遠處轉移均可手術切除時可考慮套用。
在下列情況下,建議結直腸癌原發灶和肝轉移灶分階段切除:
a先手術切除結直腸癌原發病灶,分階段切除肝轉移灶,時機選擇在結直腸癌根治術後4~6周。
b若在肝轉移灶手術前進行治療,肝轉移灶的切除可延至原發灶切除後3個月內進行。
c急診手術不推薦原髮結直腸癌和肝臟轉移病灶同步切除。
d可根治的復發性結直腸癌伴有可切除肝轉移灶傾向於進行分階段切除肝轉移灶。
②結直腸癌根治術後發生肝轉移。
既往結直腸原發灶為根治性切除且不伴有原發灶復發,肝轉移灶能完全切除且肝切除量低於70%(無肝硬化者),應當予以手術切除肝轉移灶,可先行新輔助治療。
③肝轉移灶切除術後復發。
在全身狀況和肝臟條件允許的情況下,對於可切除的肝轉移灶術後的復發病灶,可進行二次、三次甚至多次的肝轉移灶切除。
④肝轉移灶手術方式的選擇。
a肝轉移灶切除後至少保留3根肝靜脈中的1根且殘肝容積≥50%(同步原發灶和肝轉移灶切除)或≥30%(分階段原發灶和肝轉移灶切除)。
b轉移灶的手術切緣一般應當有1cm正常肝組織,若轉移灶位置特殊(如緊鄰大血管)時則不必苛求,但仍應當符合R0原則。
c如是局限於左半或右半肝的較大肝轉移灶且無肝硬化者,可行規則的半肝切除。
d建議肝轉移手術時採用術中超聲檢查,有助於發現術前影像學檢查未能診斷的肝轉移病灶。
(2)術前治療。
①結直腸癌確診時合併肝轉移。在原發灶無出血、梗阻或穿孔時推薦術前治療,方案可選FOLFOX、FOLFIRI或CapeOX,可聯合分子靶向藥物治療;一般建議2~3個月內完成。西妥昔單抗推薦用於K-ras基因野生型患者。使用貝伐珠單抗時,建議手術時機選擇在最後一次使用貝伐珠單抗6周以後。不建議多種靶向藥物聯合套用。
(3)切除術後的輔助治療。
肝轉移灶完全切除的患者推薦接受術後輔助化療,建議手術前後化療時間共為6個月。術後化療方案建議可選5-FU/LV、卡培他濱、5-FU/LV/奧沙利鉑或 CapeOx方案。術前治療有效的患者建議沿用術前方案。
3.不可切除的結直腸癌肝轉移的治療。
(1)除合併出血、穿孔或梗阻等急症需要手術切除原發灶以外的不可切除的結直腸癌肝轉移患者,應當經多學科討論,慎重選擇方案及藥物(原則同7.3.2中的術前治療)進行系統治療,創造一切機會轉化為可手術治療。治療過程中每6-8周評估療效,一旦達到可手術切除條件,儘早爭取手術治療。轉化為可切除的結直腸癌肝轉移患者等同於7.3.2相關原則。
(2)射頻消融。
①一般情況不適宜或不願意接受手術治療的可切除結直腸癌肝轉移患者推薦使用射頻消融,射頻消融的肝轉移灶的最大直徑小於3cm且一次消融最多3枚。
②預期術後殘餘肝臟體積過小時,建議先切除部分較大的肝轉移灶,對剩餘直徑小於3cm的轉移病灶進行射頻消融。
(3)放射治療。
無法手術切除的肝轉移灶,若全身化療、肝動脈灌注化療或射頻消融無效,建議放射治療。
(4)肝動脈灌注化療。
僅限於肝轉移灶多發且不能耐受全身化療的患者。
(5)其他治療方法。
包括無水酒精瘤內注射、冷凍治療和中醫中藥治療等,僅作為綜合治療的一部分套用。
治療規範
(一)分型
目前,局部復發的分型建議使用以下分類方法: 根據盆腔受累的解剖部位分為中心型(包括吻合口、直腸系膜、直腸周圍軟組織、腹會陰聯合切除術後會陰部)、前向型(侵及泌尿生殖系包括膀胱、陰道、子宮、精囊腺、前列腺)、後向型(侵及骶骨、骶前筋膜)、側方型(侵犯盆壁軟組織或骨性骨盆)。
(二)治療原則
根據患者和病變的具體情況評估,可切除或潛在可切除患者爭取手術治療,並與術前放化療、術中放療、輔助放化療等結合使用;不可切除的患者建議放、化療結合的綜合治療。
(三)手術治療
1.可切除性的評估。
必須在術前評估復發病灶得到根治切除的可能性。推薦根據復發範圍考慮決定是否使用術前放化療。建議根據術中探查結果核實病灶的可切除性,必要時可行術中冰凍病理檢查。
不可切除的局部復發病灶包括:
①廣泛的盆腔側壁侵犯;
②骨性盆腔受侵;
③髂外血管受累;
⑤侵犯第2骶骨水平及以上。
2. 手術原則。
(1)推薦由結直腸外科專科醫師根據患者和病變的具體情況選擇適當的手術方案,並與術前放化療、術中放療、輔助放化療等結合使用。
(2)推薦必要時與泌尿外科、骨科、血管外科、婦產科醫師等共同制訂手術方案。
(3)手術探查必須由遠及近,注意排除遠處轉移。
(4)必須遵循整塊切除原則,儘可能達到R0切除。
3.可切除的病灶手術方式。
手術方式包括低位前切除術(LAR)、腹會陰聯合切除(APR)、盆腔清掃術等。
(1)中心型:建議行APR以保證達到R0切除;既往行保肛手術的在病變較為局限的情況下可考慮LAR。APR術後會陰部術野復發如病變局限可考慮行經會陰或經骶切除術。
(2)前向型:在患者身體情況允許的情況下,可考慮切除受侵犯器官,行後半盆清掃或全盆清掃術。
(3)側向型:切除受累及的輸尿管、髂內血管以及梨狀肌。
(四)放射治療原則
可切除的局部復發患者,建議先行手術切除,然後再考慮是否行術後放療。不可切除局部復發患者,推薦行術前同步放化療,並爭取手術切除。參見放射治療相關章節。
(五)化療原則
康復治療
(一)人員、任務、架構
有條件的醫院推薦配備造口治療師(專科護士)。造口治療師的職責包括所有造口(腸造口、胃造口、尿路造口、氣管造口等)術前術後的護理、複雜傷口的處理、大小便失禁的護理、開設造口專科門診、聯絡患者及其他專業人員和造口用品商、組織造口聯誼會並開展造口訪問者活動。
(二)術前心理治療
推薦向患者充分解釋有關的診斷、手術和護理知識,讓患者接受患病的事實,並對即將發生的事情有全面的了解。
(三)術前造口定位
推薦術前由醫師、造口治療師、家屬及患者共同選擇造口部位。
1.要求:患者自己能看到,方便護理;有足夠的貼上面積;造口器材貼於造口皮膚時無不適感覺。
2.常見腸造口位置如圖1
 圖1:常見腸造口位置
圖1:常見腸造口位置(四)腸造口術後護理
1.術後第一天開放造口,要注意觀察造口的血運情況。
2.選擇造口用品的標準應當具有輕便、透明、防臭、防漏和保護周圍皮膚的性能,患者佩戴合適。
隨訪
結直腸癌治療後一律推薦規律隨訪。
(一)病史和體檢,每 3-6個月 1次,共 2年,然後每 6個月 1次,總共 5年,5年後每年1次。
(二)監測CEA、CA19-9,每3-6個月 1次,共 2年,然後每 6個月1 次,總共 5年,5年後每年1次。
(三)腹/盆超聲、胸片每3-6個月 1次,共 2年,然後每 6個月1 次,總共 5年,5年後每年1次。
(四)腹/盆CT或MRI每年1次。
(五)術後1年內行腸鏡檢查,如有異常,1年內複查;如未見息肉,3年內複查;然後5年1次,隨診檢查出現的大腸腺瘤均推薦切除。
(六)PET-CT不是常規推薦的檢查項目。
附錄
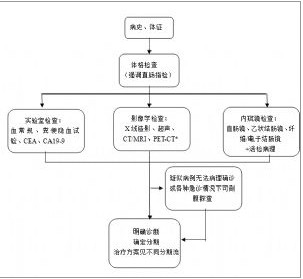 附圖-1 結直腸癌的診斷流程
附圖-1 結直腸癌的診斷流程附圖-1 結直腸癌的診斷流程
(*註:PET-CT不常規推薦)
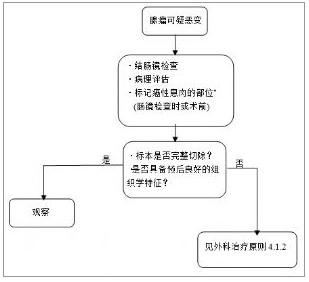
附圖-2 腺瘤惡變的處理流程
(*註:供再次手術時定位用)
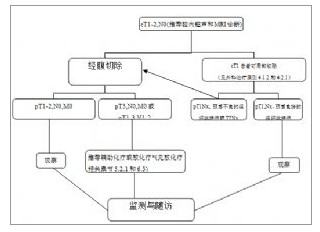 附圖-3 I期結直腸癌的處理流程
附圖-3 I期結直腸癌的處理流程附圖-3 I期結直腸癌的處理流程
(*註:直腸癌患者推薦輔助放化療)
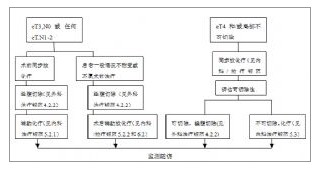 附圖-4 II/III期直腸癌處理流程
附圖-4 II/III期直腸癌處理流程附圖-4 II/III期直腸癌處理流程
 附圖-5 II/III期結腸癌處理流程
附圖-5 II/III期結腸癌處理流程附圖-5 II/III期結腸癌處理流程
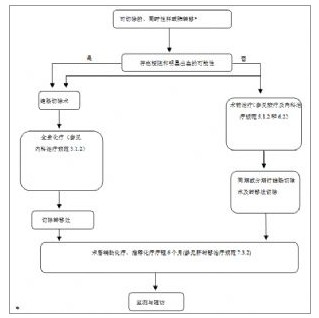 附圖-6 可切除的同時性肝/肺轉移處理流程
附圖-6 可切除的同時性肝/肺轉移處理流程附圖-6 可切除的同時性肝/肺轉移處理流程
(*註:檢測腫瘤K-ras基因狀態)
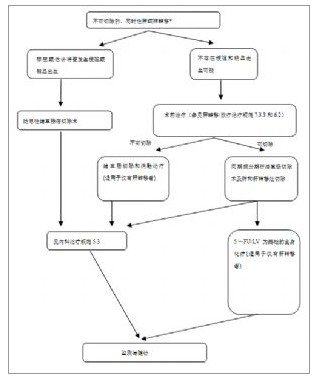 附圖-7 不可切除的同時性肝/肺轉移處理流程
附圖-7 不可切除的同時性肝/肺轉移處理流程附圖-7 不可切除的同時性肝/肺轉移處理流程
(*註:檢測腫瘤K-ras基因狀態)
 附圖-8 異時性轉移的結直腸癌處理流程
附圖-8 異時性轉移的結直腸癌處理流程附圖-8 異時性轉移的結直腸癌處理流程
(*註:檢測腫瘤K-ras基因狀態)
 附圖-9 可切除異時性轉移的處理流程
附圖-9 可切除異時性轉移的處理流程附圖-9 可切除異時性轉移的結直腸癌處理流程
(*註:檢測腫瘤K-ras基因狀態)
 附圖-10 轉移灶不可切除的結直腸癌處理流程
附圖-10 轉移灶不可切除的結直腸癌處理流程附圖-10 轉移灶不可切除的結直腸癌處理流程
(*註:檢測腫瘤K-ras基因狀態)
附圖-11 監測與隨訪流程圖 附圖-11 監測與隨訪流程圖
附圖-11 監測與隨訪流程圖
 附圖-11 監測與隨訪流程圖
附圖-11 監測與隨訪流程圖 附圖-12 復發轉移處理流程
附圖-12 復發轉移處理流程附圖-12 復發轉移處理流程
(*註:檢測腫瘤K-ras基因狀態)
相關文獻
遺傳性非息肉性結直腸癌診療進展
中美共建結直腸癌診療國際合作研究所
上海結直腸癌治療率先接軌國際先進水平
18F?FDG PET/CT顯像在結直腸癌臨床診療中的套用
規範化開展介入性診療工作的發展思路
p53基因在結直腸癌組織中表達的研究
結直腸癌肝轉移的外科治療
結直腸癌肝轉移的治療近況
胃泌素和結直腸癌研究進展
肝膽病中醫診療
第三十節門診診療檔案 肝占位性病變的診療概述
中西醫結合單病種診療規範研究啟動
結直腸癌肝轉移診治體會
規範化培訓預示新方向 需規範化管理知識
結直腸癌肝轉移30例分析
愛必妥能延長KRAS野生型結直腸癌患者生命
影像學檢查對結直腸癌診斷的評價
青年人結直腸癌臨床病理分析
重視中醫術語的規範化
結直腸癌外科治療進展
結直腸癌腫瘤形成中Survivin的表達及意義
結直腸癌並發急性穿孔19例診治體會
結直腸癌性梗阻64例外科治療體會
結直腸癌預後因素的研究進展
《放射診療管理規定》
結直腸癌合併腸梗阻的外科治療分析
《放射診療管理規定》
艾迪注射液治療晚期結直腸癌的臨床研究
人禽流感診療方案(2005版修訂版)
衛生部關於印發《醫療機構口腔診療器械消毒技術操作規範》的通知
顱腦損傷並多發傷113例診療分析
妊娠梅毒52例臨床診療分析
青少年性傳播疾病183例診療體會
冠心病診療中的常見誤區
實用經絡穴位診療法
我校結直腸癌診治中心在新華成立
急診低鉀血症的診療體會
希羅達治療結直腸癌的臨床研究
心臟介入診療的全程護理
