聚丙烯醯胺凝膠電泳(生物學分離技術)
SDS-PAGE一般指本詞條
本詞條是多義詞,共2個義項
更多義項 ▼
收起列表 ▲
聚丙烯醯胺凝膠電泳( polyacrylamide gel electrophoresis,簡稱PAGE),是以聚丙烯醯胺凝膠作為支持介質的一種常用電泳技術,用於分離蛋白質和寡核苷酸。
聚丙烯醯胺凝膠由單體丙烯醯胺和甲叉雙丙烯醯胺聚合而成,聚合過程由自由基催化完成。催化聚合的常用方法有兩種:化學聚合法和光聚合法。化學聚合以過硫酸銨(APS)為催化劑,以四甲基乙二胺(TEMED)為加速劑。在聚合過程中,TEMED催化過硫酸銨產生自由基,後者引發丙烯醯胺單體聚合,同時甲叉雙丙烯醯胺與丙烯醯胺鏈間產生甲叉鍵交聯,從而形成三維網狀結構。
PAGE根據其有無濃縮效應,分為連續系統和不連續系統兩大類,連續系統電泳體系中緩衝液pH值及凝膠濃度相同,帶電顆粒在電場作用下,主要靠電荷和分子篩效應。不連續系統中由於緩衝液離子成分,pH,凝膠濃度及電位梯度的不連續性,帶電顆粒在電場中泳動不僅有電荷效應,分子篩效應,還具有濃縮效應,因而其分離條帶清晰度及解析度均較前者佳。不連續體系由電極緩衝液、濃縮膠及分離膠所組成。濃縮膠是由AP催化聚合而成的大孔膠,凝膠緩衝液為pH6.7的Tris-HCl。分離膠是由AP催化聚合而成的小孔膠,凝膠緩衝液為pH8.9 Tris-HCl。電極緩衝液是pH8.3 Tris-甘氨酸緩衝液。2種孔徑的凝膠、2種緩衝體系、3種pH值使不連續體系形成了凝膠孔徑、pH值、緩衝液離子成分的不連續性,這是樣品濃縮的主要因素。
基本介紹
- 中文名:聚丙烯醯胺凝膠電泳
- 外文名:polyacrylamide gelelectrophoresis
- 別名:PAGE
- 作用:用於分離蛋白質和寡核苷酸
- 特點:具有分子篩效應
- 出現:1967年
簡介,過程,原理,實驗材料,設備,操作方法,實驗結果,
簡介
在
蛋白質的非變性聚丙烯醯胺凝膠電泳中,蛋白質能夠保持完整狀態,並依據蛋白質的分子量大小、蛋白質的形狀及其所附帶的
電荷量而逐漸呈梯度分開;在
DNA的非變性聚丙烯醯胺凝膠電泳中,DNA呈
雙鏈狀態泳動,其
遷移率會受
鹼基組成和序列的影響。
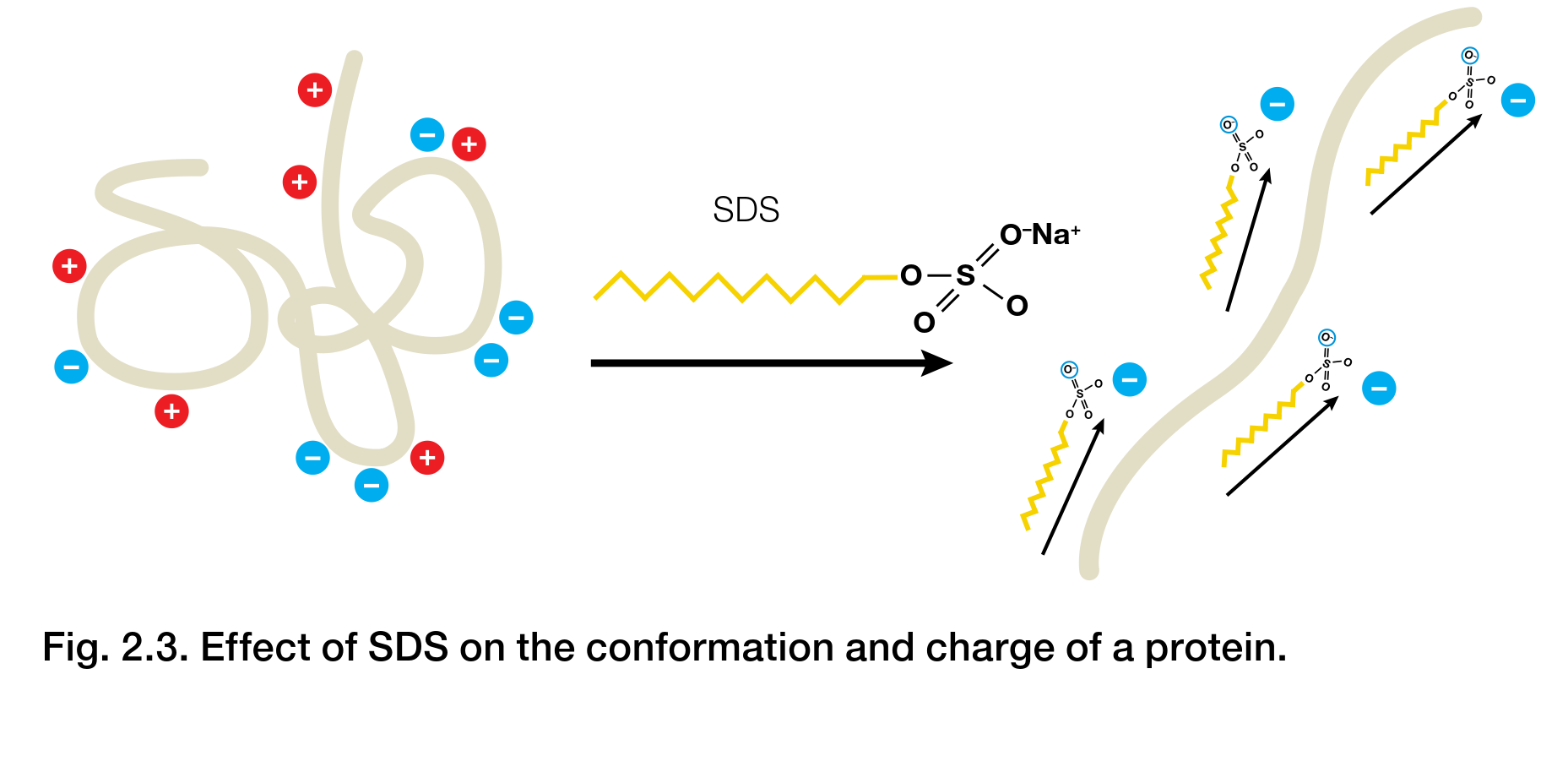 SDS對蛋白質構象和電荷的影響。圖源Bio-Rad
SDS對蛋白質構象和電荷的影響。圖源Bio-RadSDS-PAGE一般採用的是
不連續緩衝系統,與連續緩衝系統相比,能夠有較高的解析度。
濃縮膠的作用是有
堆積作用,凝膠濃度較小,孔徑較大,把較稀的樣品加在濃縮膠上,經過大孔徑凝膠的遷移作用而被濃縮至一個狹窄的區帶。當樣品液和濃縮膠選TRIS/HCl
緩衝液,
電極液選TRIS/
甘氨酸。電泳開始後,HCl解離成
氯離子,甘氨酸解離出少量的甘氨酸根離子。蛋白質帶負電荷,因此一起向正極移動,其中氯離子最快,甘氨酸根離子最慢,蛋白居中。電泳開始時氯離子泳動率最大,超過蛋白,因此在後面形成低
電導區,而
電場強度與低電導區成反比,因而產生較高的電場強度,使蛋白和甘氨酸根離子迅速移動,形成一穩定的界面,使蛋白聚集在移動界面附近,濃縮成一
中間層。
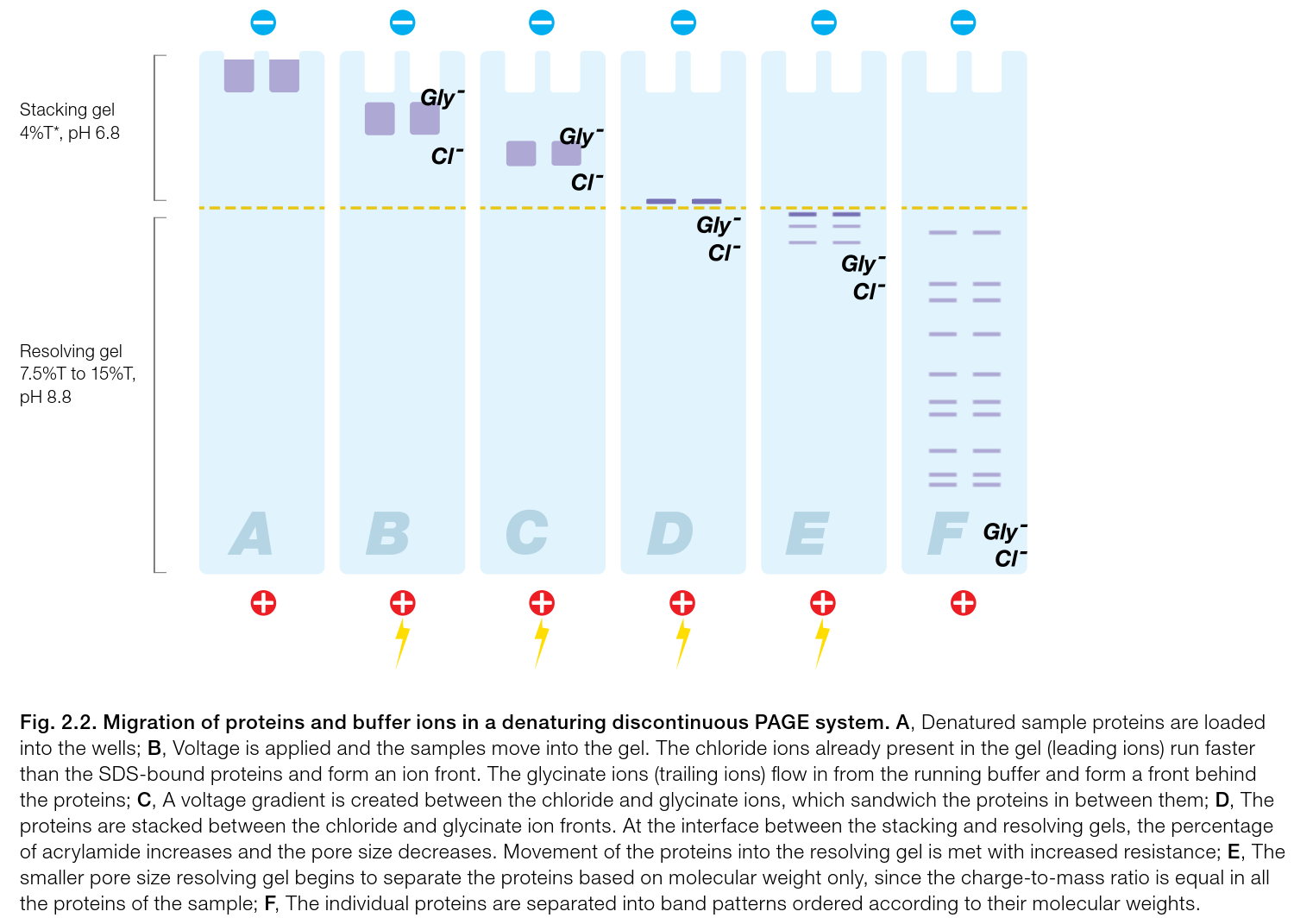 變性不連續PAGE的蛋白質和緩衝離子遷移。圖源Bio-Rad
變性不連續PAGE的蛋白質和緩衝離子遷移。圖源Bio-Rad過程
蛋白質在
聚丙烯醯胺凝膠中電泳時,它的
遷移率取決於它所帶
淨電荷以及分子的大小和形狀等因素。如果加入一種試劑使電荷因素消除,那
電泳遷移率就取決於分子的大小,就可以用
電泳技術測定蛋白質的分子量。1967年,Shapiro等發現
陰離子去污劑十二烷基硫酸鈉(SDS)具有這種作用。當向蛋白質溶液中加入足夠量SDS和
巰基乙醇,可使蛋白質分子中的
二硫鍵還原。由於十二烷基
硫酸根帶
負電,使各種蛋白質-SDS複合物都帶上相同密度的
負電荷,它的量大大超過了蛋白質分子原的
電荷量, 因而掩蓋了不同種蛋白質間原有的電荷差別,SDS與蛋白質結合後,還可引起
構象改變,蛋白質-SDS複合物形成近似“
雪茄煙”形的長橢圓棒,不同蛋白質的SDS複合物的
短軸長度都一樣,約為18A(1A=10m),這樣的蛋白質-SDS複合物,在凝膠中的遷移率,不再受
蛋白質原的電荷和形狀的影響,而取決於分子量的大小由於蛋白質-SDS複合物在
單位長度上帶有相等的電荷,所以它們以相等的
遷移速度從
濃縮膠進入
分離膠,進入分離膠後,由於
聚丙烯醯胺的
分子篩作用,
小分子的蛋白質可以容易的通過凝膠孔徑,阻力小,遷移速度快;
大分子蛋白質則受到較大的阻力而被滯後,這樣蛋白質在電泳過程中就會根據其各自分子量的大小而被分離。因而
SDS聚丙烯醯胺凝膠電泳可以用於測定蛋白質的分子量。當分子量在15KD到200KD之間時,蛋白質的遷移率和分子量的
對數呈
線性關係,符合下式:log
MW=
K-
bX,式中:
MW為分子量,
X為遷移率,
k、
b均為常數,若將已知分子量的標準蛋白質的遷移率對分子量對數作圖,可獲得一條
標準曲線,未知蛋白質在相同條件下進行電泳,根據它的電泳遷移率即可在標準曲線上求得分子量。
 聚丙烯醯胺凝膠電泳
聚丙烯醯胺凝膠電泳 SDS-聚丙烯醯胺凝膠電泳經常套用於提純過程中純度的檢測,純化的蛋白質通常在SDS電泳上應只有一條帶,但如果蛋白質是由不同的
亞基組成的,它在電泳中可能會形成分別對應於各個亞基的幾條帶。SDS-聚丙烯醯胺凝膠電泳具有較高的靈敏度,一般只需要不到
微克量級的蛋白質,而且通過電泳還可以同時得到關於分子量的情況,這些信息對於了解未知蛋白及設計提純過程都是非常重要的。
在SDS-PAGE
不連續電泳中,制膠緩衝液使用的是
Tris-HCl緩衝系統,濃縮膠是pH=6.7,分離膠pH=8.9;而
電泳緩衝液使用的Tris-
甘氨酸緩衝系統。在濃縮膠中,其pH環境呈弱酸性,因此甘氨酸解離很少,其在電場的作用下,泳動效率低;而Cl離子卻很高,兩者之間形成
導電性較低的區帶,蛋白分子就介於二者之間泳動。由於導電性與
電場強度成反比,這一區帶便形成了較高的
電壓梯度,壓著蛋白質分子聚集到一起,濃縮為一狹窄的區帶。當樣品進入分離膠後,由於膠中pH的增加,呈鹼性,甘氨酸大量解離,泳動速率增加,直接緊隨
氯離子之後,同時由於分離膠孔徑的縮小,在電場的作用下,蛋白分子根據其固有的帶電性和
分子大小進行分離。
根據樣品分離目的不同,主要有三種處理方法:還原SDS處理、非還原SDS處理、帶有烷基化作用的還原SDS處理。
1、還原SDS處理:在上樣buffer中加入SDS和
DTT(或
β-巰基乙醇)後,蛋白質構象被解離,電荷被中和,形成SDS與蛋白相結合的分子,在電泳中,只根據分子量來分離。一般電泳均按這種方式處理,樣品稀釋適當濃度,加入上樣Buffer,離心,沸水煮5min,再離心加樣。
2、帶有烷基化作用的還原SDS處理:
碘乙酸胺的烷基化作用可以很好的並經久牢固的保護
SH基團,得到較窄的
譜帶;另碘乙酸胺可捕集過量的DTT,而防止
銀染時的紋理現象。100μL樣品緩衝液中10μL 20%的碘乙酸胺,並在室溫保溫30min。
3、非還原SDS處理:生理體液、血清、
尿素等樣品,一般只用1%SDS沸水中煮3min,未加
還原劑,因而蛋白摺疊未被破壞,不可作為測定分子量來使用。
各主要成分的作用
聚
丙烯醯胺:丙烯醯胺與為蛋白質電泳提供載體,其凝固的好壞直接關係到電泳成功與否與
促凝劑及環境密切相關;
制膠緩衝液:濃縮膠選擇pH6.8,分離膠選擇pH8.8,選擇Tris-HCl系統。
十二烷基硫酸鈉(SDS):陰離子去污劑,去蛋白質電荷、解離蛋白質之間的氫鍵、取消蛋白分子內的
疏水作用、去多肽摺疊。
提高SDS-PAGE電泳解析度的途徑
聚丙烯醯胺的充分聚合,可提高凝膠的解析度。
待凝膠在室溫凝固後,可在室溫下放置一段時間使用。忌即配即用或4度冰櫃放置,前者易導致凝固不充分,後者可導致SDS結晶。一般凝膠可在室溫下保存4天,SDS可
水解聚丙烯醯胺。
兩邊翹起中間凹下形成原因
主要是由於凝膠的中間部分凝固不均勻所致,多出現於較厚的凝膠中。
處理辦法:待其充分凝固再作後續實驗。
兩邊向下中間鼓起形成原因
主要出現在蛋白質垂直
電泳槽中,一般是兩板之間的底部間隙氣泡未排除乾淨。
處理辦法:可在兩板間加入適量緩衝液,以排除氣泡。
主要是樣品融解效果不佳或分離膠濃度過大引起的。此外可能是
灌膠時分離膠過多導致濃縮膠很少,不能起到
濃縮作用,沒有把樣品壓成
一條線。
處理辦法:加樣前離心;選擇適當的樣品緩衝液,加適量樣品
促溶劑;電泳緩衝液時間過長,重新配製;降低凝膠濃度;灌膠時分離膠不要過多。
出現紋理現象的原因
主要是樣品不溶性顆粒引起的。
處理辦法:加樣前離心;加適量樣品促溶劑。
處理“鬼帶”的方法
“鬼帶”就是在跑
大分子構象複雜的蛋白質分子時,常會出現在
泳道頂端(有時在濃縮膠中)的一些大分子未知條帶或加樣孔底部有沉澱,主要由於還原劑在加熱的過程中被氧化而失去活性,致使原來被解離的蛋白質分子重新摺疊結合和亞基重新締合,聚合成大分子,其分子量要比目標條帶大,有時不能進入分離膠。但它卻於目標條帶有相同的免疫學活性,在WB反應中可見其能與目標條帶對應的抗體作用。
處理辦法:在加熱煮沸後,再添加適量的DTT或Beta巰基乙醇,以補充不足的還原劑;或可加適量
EDTA來阻止還原劑的氧化。
我們在實驗中常會遇到溴酚藍已跑出板底,但蛋白質卻還未跑下來的現象。主要與緩衝液和分離膠的濃度有關。
處理辦法:更換正確pH值的Buffer;降低分離膠的濃度。
電泳的條帶很粗的原因
電泳中條帶很粗是常見的事,主要是未濃縮好的原因。
處理辦法:適當增加濃縮膠的長度;保證濃縮膠貯液的pH正確(6.7);適當降低電壓;
問題 | 原因 | 解決方案 |
|---|
| 由於凝膠的中間部分凝固不均勻所致,多出現於較厚的凝膠中 | |
| 主要出現在蛋白質垂直電泳槽中,一般是兩板之間的底部間隙氣泡未排除乾淨 | |
| | 加樣前離心;選擇適當的樣品緩衝液,加適量樣品促溶劑;電泳緩衝液時間過長,重新配製;降低凝膠濃度 |
| | |
⑤溴酚藍不能起到指示作用,即遇到溴酚藍已跑出板底,但蛋白質卻還未跑下來的現象 | | |
| | 適當增加濃縮膠的長度;保證濃縮膠貯液的pH正確(6.7);適當降低電壓 |
| | |
| 這種現象一般初學者易出現。比如電壓50v以上,可電流卻在5mA以下。主要是由於電泳槽沒有正確裝配,電流未形成通路。包括:a.內外槽裝反;b.外槽液過少;c.電泳槽底部的絕緣體未去掉(比如倒膠用的橡膠皮) | |
原理
1、聚
丙烯醯胺凝膠是由丙烯醯胺單體(以後簡稱單體)在水溶液中聚合而成的
親水性高聚物,是一種透明而不溶於水並有韌性的凝膠。
3、聚合時丙烯醯胺分子通過加成反應形成
長鏈,雙體的作用是在長鏈之間形成交聯,成為具有三維
網狀結構的凝膠。所以在
凝膠電泳中除了具有電泳的分離外還具有
分子篩作用,從而增高了它的
分辨能力。
4、聚合時,根據分離的需要,可以用改變單體
溶液濃度或增減雙體比例的辦法製成孔度大小不同的凝膠。在分離
血清蛋白時,採用的
丙烯醯胺總濃度為6.5%,內含單體96%,雙體4.5%。
5、聚合物分子中含有很多
醯胺基,所以凝膠具有良好的親水性,能在水中溶脹但不溶解。
實驗材料
設備
2、
電泳裝置包括二個緩衝液槽和電泳管。液槽可以用玻璃或塑膠製成,在底部鑽孔。插入電泳管,用有孔
橡皮塞固定。電泳管選用孔徑均勻一致的
玻璃管切制。長10厘米,內徑5毫米。脫色用玻璃管長10厘米,內徑8毫米。底部稍拉尖,用
半透膜及
橡皮圈套住底部。
3、凝膠管架灌裝凝膠管時使管保持垂直位置,用
有機玻璃製成。
操作方法
1、凝膠管的製備將電泳玻管用小橡皮塞塞住底部,然後灌入新配的凝膠溶液。每管加至液體高度為7.5cm。為了保證凝膠表面平整可用
注射器通過細針頭小心地加一層(高約1厘米)
蒸餾水於表面上,勿使與凝膠液混合,室溫放置。如果條件合適溶液於30-60分鐘內聚合而成凝膠。凝膠溶液的配製方法:溶液甲:丙烯醯胺(
氯仿重結晶)25g,雙體(
甲醇重結晶)1g,加水配成100mL溶液。必要時用
三羥甲基氨基甲烷調pH至7.0。溶液乙:二甲氨基丙腈1mL,三羥甲基氨基甲烷0.85g(也可用0.625g氨三
乙醇或氨乙醇)加水至100mL。溶液丙:K
3Fe(CN)
6分析純0.075g,加水至100mL新配。用作
阻聚劑以延緩凝聚時間。使操作方便,如凝聚時間已足夠長可以用蒸餾水代替。溶液丁:過硫酸銨(二級)2.8g加水至100mL新配。必要時用
氨水調pH至7.0,溶液甲及乙配後可在冰櫃中保存數月。溶液丙及丁用時新配。臨用前將溶液甲、乙、丙、丁等量混合。
2、準備把已灌裝凝膠的玻管通過有孔椽皮塞安裝在上面液槽的
底孔中,在上下兩槽內分別注入緩衝液。裝上後電泳管下端應浸沒在下槽的緩衝液中,管下端勿留氣泡。血清電泳可以用
巴比妥緩衝液pH-8.6,
離子強度0.05(配法:
巴比妥鈉10.3g,二乙基
巴比土酸1.84g,加水至1L,溫熱使溶解加
硫柳汞0.1g
防霉)。
3、在血清樣品中加入少量
蔗糖以增加密度,用
血紅蛋白吸管直接小心地加在凝膠表面上,加樣量一般為7μL血清。如果在樣品中混入少量
溴酚蘭指示劑就可以在電泳過程中觀察前沿移動的情況。
4、電泳在二液槽中安放鉑金絲電極;正極在下,負極在上。
接通電源進行電泳,電場強度10V/cm左右,視室溫高低而定。室溫較高時宜用較低的電壓以免
發熱過度影響分離。蛋白質向正極移動。侍
染料前沿移動至管底近處,停止電流。電泳時間為1-2小時。電泳完畢取下凝膠管,用細長針頭沿管壁注蒸餾水,使凝膠與管壁剝開。然後用橡皮球壓出凝膠條。
5、染色及
脫色電泳後的凝膠條在1%
氨基黑10B在7%
醋酸溶液中固定並染色1小時以上。染色後的凝膠條用7%醋酸洗滌數次。置於脫色玻管中,在同一電泳裝置中電解脫色。此時改用7%醋酸充裝在液槽中。通電後過剩凝膠之上再加一層
大孔凝膠,樣品聚合在最後的另一層凝膠中。在我們的試驗中省略的染料泳向正極。脫色時電場強度25V/cm,電流10-15mA/管。3-4小時脫色完畢。增高電壓可以加速脫色。有色的醋酸溶液通過盛有
活性炭的漏斗過濾,即可除去染料,重新使用。
6、保存與記錄脫色後的凝膠可以裝在盛有7%醋酸的有塞試管中保存數年。也可以
自然乾燥後保存,在需要觀察時再浸在7%醋酸中溶脹成原來形狀。記錄可以用照相攝影。也可以用
光密度計進行捕記。光密度計的
分辨力決定於其
狹縫寬窄及
光電管放大倍數。
實驗結果
1、電泳條件的選擇
為了選擇
血清蛋白電泳較合適的條件,我們分別對單體濃度、雙體濃度、配製凝膠時所用不同
正離子、各種電壓、二甲氨基丙腈的濃度、過硫酸銨的濃度等條件進行了試驗。根據以上試驗結果,我們在分離血清蛋白時選用的條件是:單體濃度6.25-6.5%,雙體占總丙烯醯胺量的4-5%,正離子採用三羥甲基氨基甲烷,二甲氨基丙腈及過硫酸銨濃度分別為0.25%及0.7%。電泳電壓以7-10V/cm較為合適。但電泳時間較長,約2-3小時,室溫低時可以電壓稍高。如果室溫較高則可以在冰櫃中進行電泳。
2、人血清及其酒精分劃部分的凝膠電泳
採用上述條件我們進行了正常人血清的凝膠電泳。一般可以分成15-20條區帶。根據兩向
電泳方法比較了
紙電泳和凝膠電泳各區帶的相對關係。紙電泳上的a:區帶在凝膠電泳中可被分離成10條以上區帶。但紙電泳中d,區帶的一部分則與凝膠電泳中自蛋白區帶相重合。在正常人血清中後
白蛋白(
PA)、
轉鐵蛋白(Tr)和
觸珠蛋白(HP)均有不同的型。較純晦白蛋白和
丙種球蛋白部分,在凝膠電泳中可見明顯的其他蛋白區帶。
放射病動物血清蛋白的改變可以在紙電泳中觀察到。一般認為狗在照射後吻
球蛋白有增高。用凝膠電泳觀察可以得到更深入的資料。正常狗血清的凝膠
電泳圖譜大致人相似。狗受
致死量照射後第九天有明顯變化。我們用3-10型光 譜儀用光密度計將電泳圖譜進行了掃描。由於儀器的限制
光縫最小只能達到0.5mm,從而影響了其分辨力。但與正常血清對比可以見到其改變的情況,這遠比紙電泳中所見更為明顯。
觀察用
葡聚糖凝膠分離人尿中DNase時可以除去大部分其他蛋白質和雜質。但分離所得的製品用凝膠電泳觀察還可以見到五條以上的蛋白質區帶。將凝膠條在未染色前置於含
大分子DNA的瓊脂平板上,在37℃溫箱中保溫2-3小時,再用5%
三氯醋酸加至如此處理過的瓊脂板上,可以看到乳白色
本底上出現被
酶水解後的透明斑點。將凝膠條用氨黑染色後顯示其蛋白區帶的位置。二者比較就可以確定具有
酶活性的成分的相應電泳位置。我們的試驗中觀察到人尿DNase在凝膠電泳中至少被分離成二條以上有酶活性的區帶。說明有
同功酶的可能。套用這一方法可以較深人地觀察體液中酶的情況。同時也說明可以用凝膠電泳來
指示生物製劑製備過程中純化的情況。




