基本介紹
- 中文名:Beckmann重排反應
- 外文名:Beckmann rearrangement
- 所屬學科:有機化學
- 別名:貝克曼重排反應
- 底物:酮肟
- 條件:質子酸/Lewis酸/醯鹵
- 產物:N-取代醯胺
- 反應類別:有機人名反應
- 發現者:E. O. Beckmann
- 發現時間:1886年
發展歷史

反應內容
定義

反應特徵


反應機理
意義價值

衍生反應

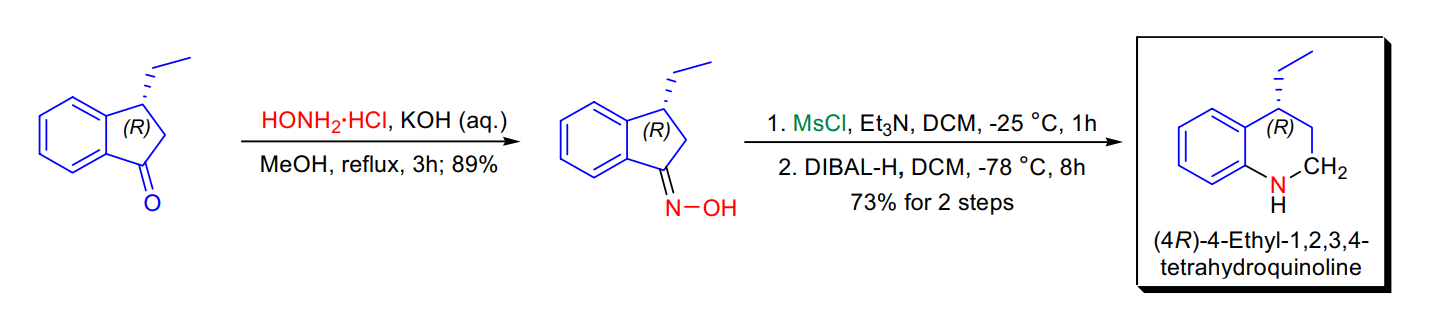
反應舉例













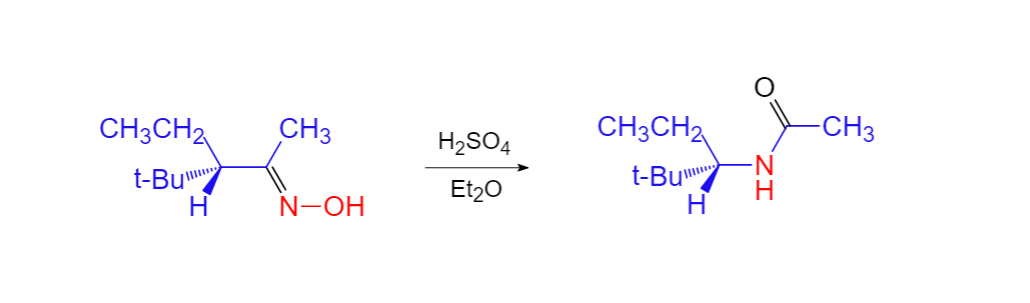
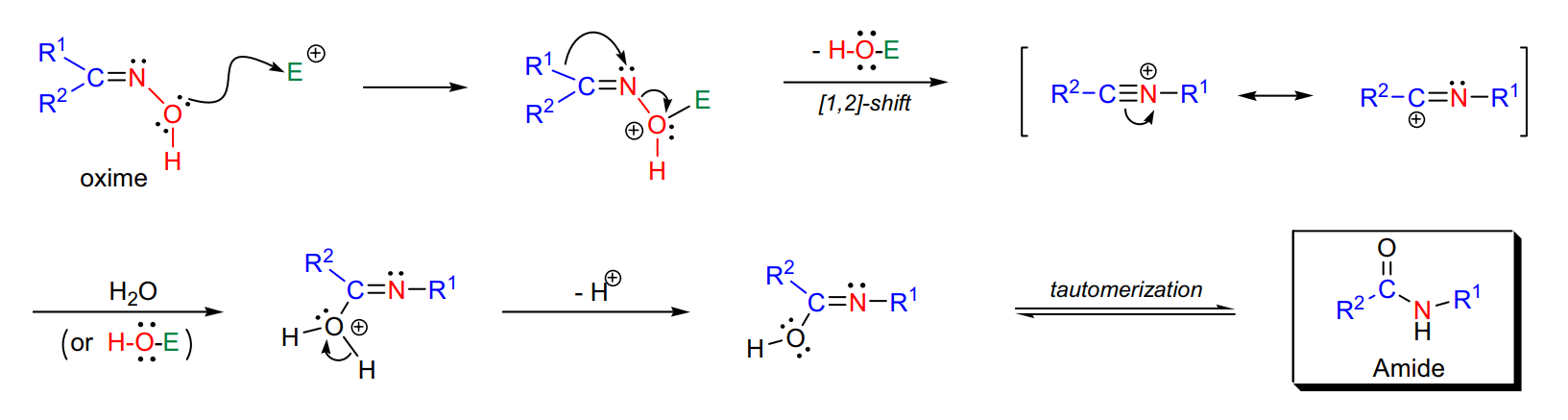
貝克曼重排 貝克曼重排反應(Beckmann重排反應)是一個由酸催化的重排反應,反應物肟在酸的催化作用下重排為醯胺。若起始物為環肟,產物則為內醯胺。此反應是由德國化學家恩斯特·奧托·貝克曼發現並由此得名。對於此類重排,需注意三點...
副反應為Beckmann重排以及異常Beckmann重排。但它與 Beckmann 重排不同的是,該反應無立體性的差別,順式肟和反式肟都能進行反應,反應後得到相同產物。不對稱的 Neber 重排可在手性相轉移催化劑催化下進行。類似的不對稱催化反應也被用於...
一、Beckmann重排反應67 二、Hofmann重排反應79 三、Curtius重排反應88 四、Schmidt 重排反應94 五、Lossen重排反應104 六、Neber重排反應110 第四節由碳至氧的重排115 一、Hydroperoxide 重排反應(氫過氧化物的重排)115 二、Baeyer-...
第七章Beckmann重排反應(貝克曼重排反應)88 第八章Benzidine重排反應(聯苯胺重排反應,Zinin聯苯胺重排反應)112 第九章Benzilic acid重排反應(二苯羥乙酸重排反應)123 第十章Brook重排反應(布魯克重排反應)132 第十一章Büchner��Curtius...
8.2Beckmann重排反應(295)8.3Benzil-Benzilic Acid重排 (二苯乙醇酸重排)(299)8.4Buchner-Curtius-Schlotterbeck 反應(301)8.5Carroll重排(303)8.6Ciamician-Dennsted重排(304)8.7Claisen重排(306)8.8Cope重排(310)...
1722WagnerMeerwoin重排193 1723二苯基乙二酮二苯基乙醇酸重排194 173碳原子其他原子的重排195 1731Hoffmann重排(C→N)195 1732Curtius(庫爾提斯)重排195 1733Beckmann重排(C→N)196 17...
第9章 低熱固相反應在有機化學中的套用 第1節 Kaupp教授與100%收率的固相有機化學反應 第2節 重排反應 9.2.1 片吶醇重排反應 9.2.2 甲基遷移重排反應 9.2.3 二苯乙二酮一二苯乙醇酸重排反應 9.2.4 Beckmann重排反應 第3...
Beckmann 重排 /591 Brook 重排和逆 Brook 重排 /595 Carroll-Claisen 重排 /597 陳德恆重排 /601 Claisen 重排 /603 Eschenmoser-Claisen 重排、Johnson-Claisen 重排和 Ireland-Claisen 重排 /607 Cope 重排 /...
第十二章重排反應/175 第一節Wagner-Meerwein重排176 第二節Pinacol重排177 第三節二苯基乙二酮-二苯基乙醇酸重排180 第四節法維斯基(Favorskii)重排182 第五節伍爾夫(Wolff)重排184 第六節貝克曼(Beckmann)重排186 第七節霍夫曼(...
恩斯特·奧托·貝克曼(Ernst Otto Beckmann,1853年7月4日-1923年7月13日),是一名德國化學家,主要成就包括發明貝克曼溫度計和發現貝克曼重排反應。人物生平 1853年7月4日,恩斯特·奧托·貝克曼出生於德國索林根,父親是一名工廠主...
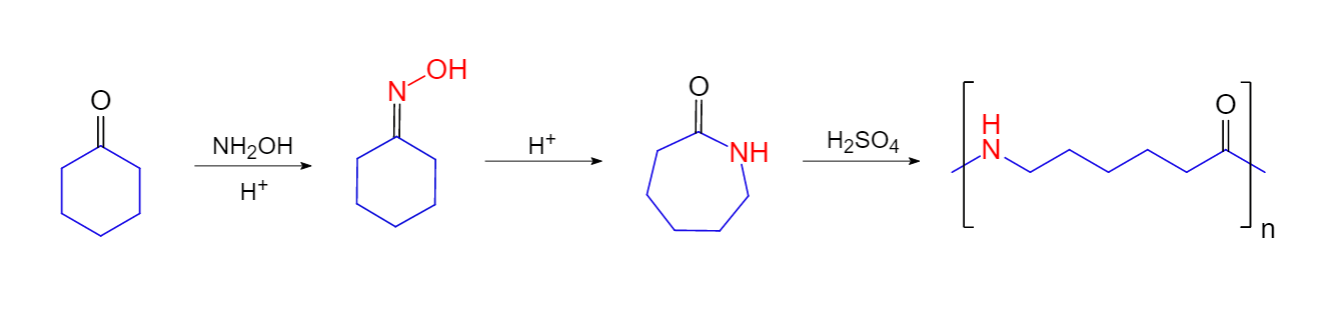
肟能發生重排反應而生成醯胺,工業上生產錦綸(PA6)的原料己內醯胺就是由環己酮生成的肟經Beckmann重排反應得到的。命名 有通用結構R-CH=N-OH或RR′C=N-OH的化合物通常被稱為“肟(oximes)”,並進一步分類各自為“醛肟(aldoximes...
Beckmann rearrangement 貝克曼重排反應 ; 貝克曼重排 ; 貝克曼轉位 ; Beckmann重排 Claisen rearrangement 克萊森重排反應 ; 克萊森重排 ; claisen重排反應 ; claisen重排 chromosomal rearrangement[遺] 染色體重排 ; 染色體重行排列 ; ...
6、劉國清,匡繼剛,吳劍,羅和安,TS-1擠條成型的研究,化學反應工程與工藝,2010,26(1):42-46 7、劉國清,袁霞,吳劍,羅和安,環己酮肟Beckmann重排反應微觀混合的數值模擬,化工學報,2011,62(3):658-663 8、尹學軍,...
8.2 形成卡賓中間體的重排反應 8.2.1 卡賓的結構與活性 8.2.2 卡賓的製備 8.2.3 卡賓的重排反應 8.3 與氮烯有關的重排反應 8.3.1 Hofmann重排反應 8.3.2 Curtius和Schmidt重排反應 8.3.3 Beckmann重排反應 ...
Beckmann重排332 Brook重排和逆Brook重排334 Carroll重排335 Chan重排337 Claisen重排338 JohnsonClaisen 重排,Esche nmoserClaisen 重排和Ireland Claisen 重排341 Cope重排344 Curtius重排346 Demjanov重排348 Favorskii重排349 Ferr...
Vilsmeier反應(氯亞胺正離子)92 Mannich反應92 Pictet-Spengler合成法93 第四節N正離子93 Beckmann重排(相當於N正離子重排)93 BambergerE重排(N正離子雙鍵轉移,C正離子重排)94 Hofmann-Martius重排反應95 Fischer-Hepp重排反應95 第八...
