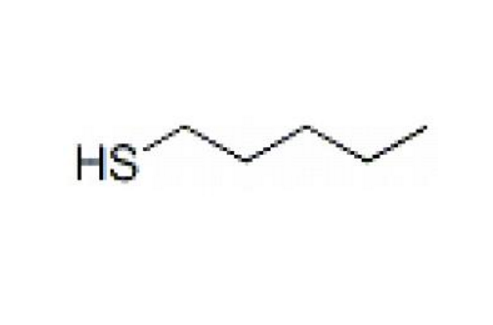
分子結構
硫醇中,硫原子為不等性 sp
3 雜化態,兩個單電子占據的 sp
3 雜化軌道分別與烴基碳和氫形成 σ 鍵,還有兩對
孤對電子占據另外的兩個 sp
3 雜化軌道。由於硫的 3s 和 3p 軌道形成的雜化軌道比氧的 2s 和 2p 軌道形成的雜化軌道大,故 C-S 和 S-H 鍵分別比 C-O 和 O-H 鍵長。
在甲硫醇中 C-S 和 S-H 鍵鍵長分別為 0.182 nm 和 0.134 nm,都比甲醇中的 C-O 和 O-H 鍵長大。∠CSH 則為 96°,小於 ∠COH。
硫的
電負性比氧小,所以硫醇的
偶極矩也比相應的醇小。
物理性質
除
甲硫醇在室溫下為氣體外,其他硫醇均為液體或固體。硫醇分子間有偶極吸引力,但小於醇分子間的偶極吸引力,且硫醇分子間無明顯的氫鍵作用,也無明顯的締合作用。因此,硫醇的沸點比分子量相近的烷烴高,比分子量相近的醇低,與分子量相近的硫醚相似。
硫醇與水間不能很好地形成氫鍵,所以硫醇在水中的溶解度比相應的醇小得多。常溫下,乙硫醇在水中的溶解度僅為 1.5g/100mL。
低級的硫醇有強烈且令人厭惡的氣味,
乙硫醇的臭味尤其明顯,所以常用乙硫醇作為天然氣中的警覺劑,用以警示天然氣泄漏。不過隨著分子量的增加,硫醇的臭味漸弱,九碳以上的硫醇則有令人愉快的氣味。
化學性質
巰基是硫醇化學性質的主要體現。其中 S-H 鍵涉及硫較大的 3s/3p 組成的雜化軌道與氫較小的 1s 軌道成鍵,所以 S-H 鍵較弱,硫醇具有酸性。硫上還有孤對電子,所以巰基也可被氧化。
酸性
硫醇的酸性比相應的醇強,可溶於氫氧化鈉的乙醇溶液中生成比較穩定的鹽,通入二氧化碳又變回硫醇。硫醇可與一些重金屬鹽生成不溶於水的硫醇鹽,兩者軟軟相吸。許多重金屬離子在體內的毒性即是因為其可與生物分子的巰基結合。另一方面,也可利用硫醇(如二巰基丙酸)通過形成不溶沉澱的方法將重金屬離子從尿液排出,起到解毒作用。
強還原性
硫醇很容易被氧化。弱氧化劑(如空氣、碘、氧化鐵、二氧化錳等)即可將硫醇氧化為二硫化物。硫醇與二硫化物形成的氧還共軛對是生物體內的常見機制,如半胱氨酸-胱氨酸還氧對。生成的二硫化物中的二硫鍵在維持蛋白質空間結構方面有重要作用。
硫醇用強氧化劑(如高錳酸鉀、
硝酸、
高碘酸)氧化,經過中間物次磺酸、亞磺酸,最終生成磺酸。此法可用於脂肪磺酸的製備。
對硫醇催化加氫,可實現脫硫,產生相應的烴。石油煉製中的加氫脫硫即是基於此反應。石油中有少量硫醇,硫醇的存在不僅會使汽油具有令人討厭的氣味,還會在燃燒時轉變為有毒、腐蝕性的二氧化硫和
三氧化硫。
與醇的相似性
此外,硫醇還可發生一些與醇相似的反應,例如與羧酸生成硫醇酯,與醛、酮生成縮硫醛酮。後一反套用於在有機合成中保護羰基或除去羰基,或實現羰基的極性轉換。
實例與代表物
常見實例
代表物
中文名稱 | | 結構式 | 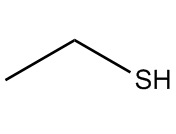 典型代表物-乙硫醇 典型代表物-乙硫醇 |
英文名稱 | ethyl mercaptan;ethanethiol |
別名 | |
分子式 | C2H6S;CH3CH2SH |
性狀 | 無色液體,有強烈的蒜氣味 | 分子量 | 62.13 |
蒸汽壓 | 53.32kPa/17.7℃ | 密度 | |
熔沸點 | 熔點 -147℃ 沸點36.2℃ | 溶解度 | |
危險性 | | 主要用途 | |
|
製取方法
硫醇可由
鹵代烷與硫氫化鈉起
取代反應製得,或將鹵代烷與硫脲反應,然後將產物用鹼液處理製得。醇與
硫化氫進行高溫催化反應,能大量生產廉價的乙硫醇和丁硫醇。硫醇常用的合成方法有硫脲的烴化水解,烯烴與硫化氫加成,硫氫化鈉(鉀)的烴化,硫醇酯的水解,二硫化物還原,金屬有機化合物與硫作用,磺醯氯還原等。
硫脲烴化水解的方法來製備硫醇,硫脲法製備硫醇的工藝簡單,容易操作。該方法主要是分三步進行:①生成異硫脲鹽;②加鹼水解;③酸化生成硫醇。傳統的硫脲烴化水解法多採用甲醇作溶劑,在第一步反應後直接蒸乾甲醇進行水解等,這在單取代硫醇的製備中是可行的,但是對於三個取代基而言,一取代和二取代的硫脲鹽同樣可以溶於甲醇中,這樣直接進入下一步反應的話,就會導致副產物二取代硫醇和一取代硫醇的生成,影響產率與純度,用乙醇替代甲醇作溶劑。
根據聚合物的折射率與原子或基團的摩爾折射度的關係,常採用引入一些基團和元素的方法來提高聚合物的折光指數。這些基團和元素的引入提高了光學樹脂的折射率,同時帶來了一些不足: (1)引入芳香族化合物或稠環化合物可提高折射率,但聚合物的色散較大,vd較低; (2)引入除F以外的鹵族元素可提高折射率,但樹脂的密度增大,耐候性差,易發黃; (3)引入重金屬離子如鉛、鑭或鈮等可提高折射率,樹脂的密度增大、抗衝擊性降低、且易發黃,實用困難; (4)引入脂肪族多環化合物,可提高折射率,且色散較低; (5)引入硫、氮、磷等雜元素可提高折射率。(6) 將高折射率無機納米粒子與聚合物複合等多種方法。以上方法中,在聚合物里引入硫元素是提高折射率的最有效的方法,同時材料的色散小,環境穩定性好。
實際套用
環境影響
人體危害
侵入途徑:吸入、食入、經皮吸收。
健康危害:本品主要作用於
中樞神經系統。吸入低濃度蒸氣時可引起頭痛、噁心;較高濃度出現麻醉作用。高濃度可引起呼吸麻痹致死。中毒者可發生嘔吐、腹瀉,尿中出現蛋白、管型及血尿。
環境危害
急性毒性:LD50682mg/kg(大鼠經口);LC5011227mg/m
34小時(大鼠吸入)。
危險特性:其蒸氣與空氣可形成
爆炸性混合物。遇明火、高熱極易燃燒爆炸。與氧化劑接觸會猛烈反應。接觸酸和
酸霧產生有毒氣體。與水、
水蒸氣反應放出有毒的或易燃的氣體。與
次氯酸鈣、
氫氧化鈣發生劇烈反應。其蒸氣比空氣重,能在較低處擴散到相當遠的地方,遇明火會引著回燃。若遇高熱,容器內壓增大,有開裂和爆炸的危險。
燃燒(分解)產物:一氧化碳、二氧化碳、氧化硫。
監測方法
實驗室監測方法:
氣相色譜法《空氣中有害物質的測定方法》(第二版),杭士平編
對二甲胺基
苯胺比色法《空氣中有害物質的測定方法》(第二版),杭士平編
泄漏處理
人員處置
迅速撤離泄漏污染區人員至安全區,並進行隔離,嚴格限制出入。切斷火源。建議應急處理人員戴自給
正壓式呼吸器,穿消防防護服。儘可能切斷泄漏源。防止進入
下水道、排洪溝等限制性空間。
防護措施
呼吸系統防護:空氣中濃度超標時,應該佩戴自吸過濾式防毒面具(半面)。必要時,建議佩戴空氣呼吸器。
手防護:戴橡膠手套。
其它:工作現場嚴禁吸菸。工作畢,淋浴更衣。注意個人清潔衛生。
急救措施
皮膚接觸:脫去被污染的衣著,用肥皂水和清水徹底沖洗皮膚。
眼睛接觸:提起眼瞼,用流動清水或生理鹽水沖洗。就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
食入:飲足量溫水,催吐,就醫。
滅火方法:儘可能將容器從火場移至空曠處, 噴水保持火場容器冷卻,直至滅火結束。處在火場中的容器若已變色或從安全泄壓裝置中產生聲音,必須馬上撤離。滅火劑:抗溶性泡沫、乾粉、二氧化碳、砂土。用水滅火無效。
污染物處理
 典型代表物-乙硫醇
典型代表物-乙硫醇