發現歷史,存在情況,地球,金星,木衛二,物理性質,濃度的差異,極性與導電性,化學性質,腐蝕性,濃硫酸特性,稀硫酸特性,製備方法,實驗室製法,工業製法,其他製備工藝,套用領域,工業用途,農業用途,日常家居用途,毒理性質,實驗室風險,工業風險,急救措施,儲存方法,
發現歷史 硫酸發現於公元8世紀。阿拉伯煉丹家賈比爾通過乾餾硫酸亞鐵晶體得到硫酸。一些早期對化學有研究的人,如拉齊、賈比爾等,還寫了有關硫酸及與其相關的礦物質的分類名單;其他一些人,如伊本·西那醫師,則較為重視硫酸的種類以及它們在醫學上的價值。
在17世紀,德國化學家Johann Rudolf Glauber將硫與硝酸鉀混合蒸汽加熱制出硫酸,在這過程中,硝酸鉀分解並氧化硫令其成為能與水混合併變為硫酸的
三氧化硫 (SO
3 )。於是,在1736年,倫敦藥劑師Joshua Ward用此方法開拓大規模的硫酸生產。
在1746年,John Roebuck則運用這個原則,開創鉛室法,以更低成本有效地大量生產硫酸。經過多番的改良後,這個方法在工業上已被採用了將近兩個世紀。由John Roebuck創造的這個生產硫酸的方法能製造出濃度為65%的硫酸,後來,法國化學家約瑟夫·路易·蓋-呂薩克以及英國化學家
John Glover 將其改良,使其能製造出濃度高達78%的硫酸,可是這濃度仍不能滿足一些工業上的
用途 。
在18世紀初,硫酸的生產都依賴以下的方法:黃鐵礦(FeS
2 )被燃燒成硫酸亞鐵(FeSO
4 ),然後再被燃燒,變為能在480℃下分解成氧化鐵以及能用以製造任何濃度硫酸的三氧化硫的硫酸鐵[Fe
2 (SO
4 )
3 ]。可惜,此過程的龐大成本阻礙了濃硫酸的廣泛運用。由
約翰·道爾頓 在1808年繪製的早期硫酸分子圖顯示了硫酸有一個位於中心的硫原子並與三個氧原子建立共價鍵,如右圖。
約翰·道爾頓在1808年繪製的早期硫酸分子圖 後來,到了1831年,英國制醋商人Peregrine Phillips想到了接觸法,能以更低成本製造出
三氧化硫 以及硫酸,這種方法在現今已被廣泛運用。
在古代中國,稀硫酸被稱為“綠礬油”。 在公元650~683年(唐高宗時),煉丹家孤剛子在其所著《
黃帝九鼎神丹經訣 》卷九中就記載著“鍊石膽取精華法”,即乾餾石膽(膽礬)而獲得硫酸。
存在情況 地球 酸雨中含有硫酸,酸雨中的二氧化硫(SO
2 )與大氣中的水反應,生成亞硫酸(H
2 SO
3 ),亞硫酸又被大氣中的氧氣氧化,生成硫酸,隨雨水落到地面 ,引起酸性土壤的形成。改良酸性土壤通常用鹼性物質進行中和。自然界中,很多含硫的礦物質,例如
硫化亞鐵 ,在發生氧化反應後形成硫酸,所形成的液體為高度酸性,能氧化殘留的金屬物,釋出有毒的氣體。在生物界,有一種海蛞蝓(Notaspidean pleurobranchs)也能噴射含硫酸的分泌物來禦敵。
金星 硫酸能在金星的上層大氣中找到。這主要出自於太陽對二氧化硫,二氧化碳及水的光化作用。波長短於160nm的紫外光子能光解二氧化碳,使其變為一氧化碳及原子氧。原子氧內鏈非常活躍,它與二氧化硫發生反應變為三氧化硫。三氧化硫進一步與水產生反應釋出硫酸。硫酸在金星大氣中較高較冷的地區為液體,這層厚厚的、離星球表面約45~70公里的硫酸雲層覆蓋整個星球表面。這層大氣不斷地釋出酸雨。
在金星里,硫酸的形成不斷循環。當硫酸從大氣較高較冷的區域跌至較低較熱的地區時被蒸發,其含水量越來越少而其濃度也就越來越高。當溫度達300℃時,硫酸開始分解為三氧化硫以及水,產物均為氣體。三氧化硫非常活躍並分解為二氧化硫及原子氧,原子氧接著氧化一氧化碳令其變為二氧化碳,二氧化硫及水會從大氣中層升高到上層,它們會發生反應重新釋出硫酸,整個過程又再一次循環。
木衛二 由伽利略號探測器傳來的影像顯示,硫酸亦有可能出現於木星的其中一個衛星——木衛二,但有關細節仍存有爭議。
物理性質 純硫酸一般為無色油狀液體,密度1.84 g/cm
3 ,沸點337℃,能與水以任意比例互溶,同時放出大量的熱,使水沸騰。加熱到290℃時開始釋放出三氧化硫,最終變成為98.54%的水溶液,在317℃時沸騰而成為共沸混合物。硫酸的沸點及粘度較高,是因為其分子內部的
氫鍵 較強的緣故。由於硫酸的介電常數較高,因此它是電解質的良好溶劑,而作為非電解質的溶劑則不太理想。硫酸的熔點是10.371℃,加水或加三氧化硫均會使凝固點下降。
硫酸的結構式及鍵長 濃度的差異 儘管可以制出濃純淨的硫酸,並且室溫下是無限穩定的(所謂的分解成恆沸物的反應發生在接近沸點的高溫之下),但是純硫酸凝固點過高(283.4K),所以為了方便運輸通常製成98%硫酸,故一般所說的“高濃度硫酸”指的便是濃度為98%的硫酸。另外,硫酸在不同的濃度下有不同的套用,以下為一些常見的濃度級別:
H2 SO4 比重 相應密度(kg/L) 濃度(mol/L) 俗稱 10%
1.07
~1
稀硫酸
29~32%
1.25~1.28
4.2~5
62~70%
1.52~1.60
9.6~11.5
室酸、肥料酸
98%
1.83
~18
濃硫酸
硫酸亦可被製成其他形態。例如,將高濃度的SO
3 通入硫酸可製成
發煙硫酸 ,有關發煙硫酸的濃度,人們通常以SO
3 的百分比作準或者是H
2 SO
4 的百分比作準,兩者均可。一般所稱的“發煙硫酸”的濃度為45%(含109%H
2 SO
4 )或65%(含114.6% H
2 SO
4 )。當SO
3 與H
2 SO
4 比例為1:1產物為
焦硫酸 (H
2 S
2 O
7 ),焦硫酸為固體,熔點為36℃。
極性與導電性 純硫酸是一種極性非常大的液體,其介電係數大約為100。因為它分子與分子之間能夠互相質子化對方,造成它極高的導電性,這個過程被稱為質子自遷移。發生的過程是:
2H2 SO4 ⇌H3 SO4 + + HSO4 - (主要)
2H2 SO4 ⇌H3 O+ + HS2 O7 -
H3 O+ +H2 SO4 ⇌H3 SO4 + + H2 O
HS2 O7 - +H2 SO4 ⇌HSO4 - + H2 S2 O7
化學性質 腐蝕性 純硫酸加熱至290℃分解放出部分三氧化硫,直至酸的濃度降到98.3%為止,這時硫酸為恆沸溶液,沸點為338°C。無水硫酸體現酸性是給出質子的能力,純硫酸仍然具有很強的酸性,98%硫酸與純硫酸的酸性基本上沒有差別,而溶解
三氧化硫 的發煙硫酸是一種超酸體系,酸性強於純硫酸,但是廣泛存在一種誤區,即稀硫酸的酸性強於濃硫酸,這種想法是錯誤的。的確,稀硫酸第一步
電離 完全,產生大量的
水合氫離子 H
3 O
+ ;但是濃硫酸和水一樣,自身自偶電離會產生一部分硫酸合氫離子H
3 SO
4 + ,正是這一部分硫酸合質子,導致純硫酸具有非常強的酸性,雖然少,但是酸性卻要比水合質子強得多,所以純硫酸的
哈米特酸度函式 高達-12.0。
在硫酸溶劑體系中,H3 SO4 + 經常起酸的作用,能質子化很多物質產生離子型化合物:
NaCl+ H
2 SO
4 ==NaHSO
4 +HCl(不加熱都能很快反應)
KNO
3 + H
2 SO
4 →K
+ +HSO
4 - +HNO
3 HNO
3 + H
2 SO
4 →NO
2 + +H
3 O
+ +2HSO
4 - CH
3 COOH+ H
2 SO
4 →CH
3 C(OH)
2 + +HSO
4 - HSO
3 F+ H
2 SO
4 →H
3 SO
4 + +SO
3 F
- (
氟磺酸 酸性更強)
上述與HNO
3 的反應所產生的NO
2 + ,有助於
芳香烴 的硝化反應。
濃硫酸特性 1.脫水性
脫水指濃硫酸脫去非游離態水分子或按照水的氫氧原子組成比脫去有機物中氫氧元素的過程。就硫酸而言,
脫水性 是濃硫酸的性質,而非稀硫酸的性質,濃硫酸有脫水性且脫水性很強,脫水時按水的組成比脫去。物質被濃硫酸脫水的過程是
化學變化 ,反應時,濃硫酸按水分子中氫氧原數的比(2:1)奪取被脫水物中的氫原子和氧原子或脫去非游離態的結晶水,如
五水硫酸銅 (CuSO
4 ·5H
2 O)。可被濃硫酸脫水的物質一般為含
氫 、
氧 元素的有機物,其中蔗糖、木屑、紙屑和
棉 花等物質中的有機物,被脫水後生成了黑色的
炭 ,這種過程稱作
炭化 。一個典型的炭化現象是蔗糖的黑麵包反應。在200mL燒杯中放入20g蔗糖,加入幾滴水,水加適量,攪拌均勻。然後再加入15mL質量分數為98%的濃硫酸,迅速攪拌。觀察實驗現象。可以看到蔗糖逐漸變黑,體積膨脹,形成疏鬆多孔的海綿狀的炭,反應放熱,還能聞到刺激性氣體。
濃硫酸迅速蝕穿毛巾 C12 H22 O11 ==濃硫酸 ==12C+11H2 O
同時進行碳與濃硫酸反應:
C+2H2 SO4 (濃)==加熱 ==CO2 ↑+2SO2 ↑+2H2 O
2.強氧化性
還原產物
濃硫酸由於還原劑的量,種類的不同可能被還原為SO2 ,S或H2 S:
例如,還原劑過量時,HBr,H2 S和HI分別將濃硫酸還原為不同物質:
2HBr + H2 SO4 (濃) = Br2 +SO2 + 2H2 O
3H2 S + H2 SO4 (濃) = 4S↓ + 4H2 O
8HI + H2 SO4 (濃) = 4I2 +H2 S + 4H2 O
還原劑量不同時,產物也可能有所不同:
Zn + 2H2 SO4 (濃) =ZnSO4 +SO2↑ + 2H2 O
3Zn + 4H2 SO4 (濃) = 3ZnSO4 +S + 4H2 O
4Zn + 5H2 SO4 (濃) = 4ZnSO4 +H2 S↑ + 2H2 O
相關反應
(1)與金屬反應
①常溫下濃硫酸能使鐵、鋁等金屬
鈍化 。②加熱時,濃硫酸可以與除銥,釕之外的所有金屬(包括金,鉑)反應,生成高價金屬硫酸鹽,本身被還原成SO
2 ,S,H
2 S或金屬硫化物。
Cu+2H2 SO4 (濃)=加熱 =CuSO4 +SO2 ↑+2H2 O
(副反應有5Cu+4H2 SO4 (濃)=加熱 =3CuSO4 +Cu2 S+4H2 O等)
2Fe+6H2 SO4 (濃)=加熱 =Fe2 (SO4 )3 +3SO2 ↑+6H2 O
Pt+4H2 SO4 (濃)=加熱 =Pt(SO4 )2 +2SO2 ↑+4H2 O(338℃的沸騰濃硫酸中,腐蝕率0.4mm/年以上;金被腐蝕的速度則慢得多)
在上述反應中,硫酸表現出了強氧化性和酸性。
(2)與非金屬反應
熱的濃硫酸可將碳、硫、磷等非金屬單質氧化到其高價態的氧化物或
含氧酸 ,本身被還原為二氧化硫。在這類反應中,濃硫酸只表現出
氧化性 。
C+2H
2 SO
4 (濃)=
加熱 =CO
2 ↑+2SO
2 ↑+2H
2 O
S+H
2 SO
4 (濃)=
加熱 =3SO
2 ↑+2H
2 O
硫酸分子的球棍模型 2P+5H2 SO4 (濃)=加熱 =2H3 PO4 +5SO2 ↑+2H2 O
(3)與其他還原性物質反應
濃硫酸具有強氧化性,實驗室製取
硫化氫 、
溴化氫 、
碘化氫 等還原性氣體不能選用濃硫酸。
H
2 S+H
2 SO
4 (濃)==S↓+SO
2 +2H
2 O
2HBr+H
2 SO
4 (濃)==Br
2 +SO
2 +2H
2 O
8HI+H
2 SO
4 (濃)==4I
2 +H
2 S+4H
2 O
稀硫酸特性 性質
可與多數金屬(比銅活潑)和絕大多數金屬氧化物反應,生成相應的硫酸鹽和水;
可與所含酸根離子對應酸酸性比硫酸根離子弱的鹽反應,生成相應的
硫酸鹽 和弱酸;
可與氫前金屬在一定條件下反應,生成相應的硫酸鹽和氫氣;
檢驗
檢驗方法:使用經過鹽酸(HCl)酸化的的氯化鋇(BaCl2 )。向待測物溶液滴入幾滴經過鹽酸酸化的氯化鋇溶液,震盪,如果產生白色沉澱;向溶液中加入鎂粉後生成可燃性氣體,則待測溶液中含有硫酸。但此方法僅限中學階段。
常見誤區
稀硫酸在中學階段,一般當成H2 SO4 =2H+ +SO4 2- ,兩次完全電離,其實不是這樣的。根據硫酸酸度係數pK a 1 =-3.00,pK a2 =1.99,其二級電離不夠充分,在稀硫酸中HSO4 - =可逆=H+ +SO4 2-, 並未完全電離,1mol/L的硫酸一級電離完全,二級電離約電離10%,也就是溶液中仍存在大量的HSO4 - 。而即使是NaHSO4 溶液0.1mol/L時,硫酸氫根也只電離了約30%。
製備方法 實驗室製法 可以用FeSO
4 ·7H
2 O加強熱,用加冰水混合物的U型管
冷凝 即可,用NaOH吸收SO
2 ,理論可得29.5%的H
2 SO
4 。關鍵在於尾氣吸收。
可將二氧化硫氣體通入雙氧水製取硫酸,此法占率較低。
另一種少為人知的方法是,先把12.6
摩爾 濃度的鹽酸加入焦亞硫酸根(S
2 O
5 2- ),接著把所產生的氣體打入
硝酸 ,這會釋出棕色/紅色的氣體,當再無氣體產生時就代表反應完成。
工業製法 方法一
生產硫酸的原料有硫黃、
硫鐵礦 、有色金屬冶煉煙氣、石膏、
硫化氫 、二氧化硫和廢硫酸等。硫黃、硫鐵礦和冶煉煙氣是三種主要原料。
製取二氧化硫(沸騰爐)2 ==點燃 ==SO2 2 +11O2 ==高溫 =8SO2 +2Fe2 O3
接觸氧化為三氧化硫(接觸室)
2SO
2 +O
2 ==
五氧化二釩 催化並加熱 ==2SO
3 (可逆反應)
用98.3%硫酸吸收(吸收塔)
SO
3 +H
2 SO
4 ==H
2 S
2 O
7 (
焦硫酸 )
加水2 S2 O7 +H2 O==2H2 SO4
提純
可將工業濃硫酸進行
蒸餾 ,便可得到濃度95%~98%的商品硫酸。
二水法磷酸反應後,利用
磷石膏 ,工業循環利用,使用二水法制硫酸。
方法二
製取二氧化硫(沸騰爐)2 2 +11O2 =高溫 =8SO2 +2Fe2 O3
將二氧化硫溶於水變成亞硫酸。
亞硫酸氧化得硫酸。
其他製備工藝 氨酸法增濃低濃度二氧化硫氣體生產硫酸方法
採用就地再生的硫酸作為催化劑的一體化工藝
草酸生產中含硫酸廢液的回收利用
從芳族化合物混酸硝化得到廢硫酸的純化與濃縮工藝
從氧化鈦生產過程中排出的廢硫酸溶液的再生方法
從稀硫酸中分離有機磷化合物和其它雜質的方法
從製備2-羥基-4-甲巰基丁酸(MHA)工藝的含硫副產物中回收硫酸的方法
催化氧化回收含有機物廢硫酸的方法
電瓶用硫酸生產裝置
二氧化硫源向硫酸的液相轉化方法
沸騰爐焙燒硫磺製備硫酸的方法
沸騰爐摻燒硫磺生產裝置中稀酸的回收利用
高濃二氧化硫氣三轉三吸硫酸生產方法
高溫濃硫酸液下泵耐磨軸套
高效陽極保護管殼式濃硫酸冷卻器
節能精煉硫酸爐裝置
精苯再生酸焚燒製取硫酸的方法
利用廢硫酸再生液的方法和裝置
利用含硫化氫的酸性氣體與硫磺聯合製取高濃度硫酸
利用含硫化氫的酸性氣體製取高濃度硫酸
套用領域 工業用途 冶金及石油工業
用於冶金工業和金屬加工在冶金工業部門,特別是有色金屬的生產過程需要使用硫酸。例如用電解法精煉銅、鋅、鎘、鎳時,電解液就需要使用硫酸,某些貴金屬的精煉,也需要硫酸來溶解去夾雜的其他金屬。在鋼鐵工業中進行冷軋、冷拔及衝壓加工之前,都必須用硫酸清除鋼鐵表面的氧化鐵。在軋制薄板、冷拔無縫鋼管和其他質量要求較高的鋼材,都必須每軋一次用硫酸洗滌一次。另外,有縫鋼管、薄鐵皮、鐵絲等在進行鍍鋅之前,都要經過用硫酸進行酸洗。在某些金屬機械加工過程中,例如鍍鎳、鍍鉻等金屬製件,也需用硫酸來洗淨表面的銹。在黑色冶金企業部門裡,需要酸洗的鋼材一般約占鋼總產量的5%~6%,而每噸鋼材的酸洗,約消費98%的硫酸30~50kg。
用於石油工業汽油、潤滑油等石油產品的生產過程中,都需要濃硫酸精煉,以除去其中的含硫化合物和不飽和碳氫化合物。每噸原油精煉需要硫酸約24kg,每噸柴油精煉需要硫酸約31kg。石油工業所使用的活性白土的製備,也消耗不少硫酸。
在濃縮硝酸中,以濃硫酸為脫水劑;氯鹼工業中,以濃硫酸來乾燥
氯氣 、氯化氫氣等;無機鹽工業中,如
冰晶石 、硼砂、
磷酸三鈉 、磷酸氫二鈉、硫酸鉛(、硫酸鋅、硫酸銅、硫酸亞鐵以及其他硫酸鹽的製備都要用硫酸。許多無機酸如磷酸、硼酸、鉻酸(有時也指CrO
3 )、氫氟酸、氯磺酸;
有機酸 如草酸、
醋酸 等的製備,也常需要硫酸作原料。此外煉焦化學工業(用硫酸來同焦爐氣中的氨起作用副產硫酸銨)、
電鍍 業、製革業、顏料工業、橡膠工業、造紙工業、油漆工業(
有機溶劑 的製備)、工業炸藥和鉛蓄電池製造業等等,都消耗相當數量的硫酸。
可用作硬水的軟化劑、離子交換再生劑、pH值調節劑、氧化劑和洗滌劑等。還可用於化肥、農藥、染料、顏料、塑膠、化纖、炸藥以及各種硫酸鹽的製造。在石油的煉製、有色金屬的冶煉、鋼鐵的酸洗處理、製革過程以及煉焦業、輕紡業、國防軍工都有廣泛的套用。強酸性清洗腐蝕劑。在積體電路製造工藝中主要用於矽片清洗。
解決人民衣食住行
用於化學纖維的生產為人民所熟悉的粘膠絲,它需要使用硫酸、硫酸鋅、
硫酸鈉 的混合液作為粘膠抽絲的凝固浴。每生產1t粘膠纖維,需要消耗硫酸1.2~1.5t,每生產1t維尼龍短纖維,就要消耗98%硫酸230kg,每生產1t卡普綸單體,需要用1.6t20%發煙硫酸。此外,在尼龍、
醋酸纖維 、
聚丙烯腈纖維 等化學纖維生產中,也使用相當數量的硫酸。
用於化學纖維以外的
高分子 化合物生產塑膠等高分子化合物,在國民經濟中越來越占有重要的地位。每生產1t
環氧樹脂 ,需用硫酸2.68t,號稱“塑膠王”的
聚四氟乙烯 ,每生產1t,需用硫酸1.32t;有機矽樹膠、矽油、丁苯橡膠及丁腈橡膠等的生產,也都要使用硫酸。
用於染料工業幾乎沒有一種染料(或其中間體)的製備不需使用硫酸。偶氮染料中間體的製備需要進行磺化反應,
苯胺 染料中間體的製備需要進行硝化反應,兩者都需使用大量濃硫酸或發煙硫酸。所以有些染料廠就設有硫酸車間,以配合需要。
用於日用品的生產生產合成洗滌劑需要用發煙硫酸和濃硫酸。塑膠的增塑劑(如苯二
甲酸 酐和
苯二甲酸酯 )、賽璐珞製品所需的原料
硝化棉 ,都需要硫酸來製備。玻璃紙、羊皮紙的製造,也需要使用硫酸。此外,紡織印染工業、搪瓷工業、小五金工業、肥皂工業、人造香料工業等生產部門,也都需要使用硫酸。
用於製藥工業磺胺藥物的製備過程中的磺化反應,強力殺菌劑呋喃西林的製備過程中的硝化反應,都需用硫酸。此外,許多抗生素的製備,常用藥物如
阿斯匹林 、
咖啡因 、維生素B2、維生素B12及維生素C、某些激素、異煙肼、汞溴紅、糖精等的製備,無不需用硫酸。
鞏固國防
某些國家硫酸工業的發展,曾經是和軍用炸藥的生產緊密連結在一起的。無論軍用炸藥(發射藥、爆炸藥)或工業炸藥,大都是以硝基化物或硝酸酯為其主要成分。主要的有硝化棉、三硝基甲苯(TNT)、
硝化甘油 、
苦味酸 等。雖然這些化合物的製備是依靠硝酸,但同時必須使用濃硫酸或發煙硫酸。
原子能工業及火箭技術
原子反應堆用的核燃料的生產,反應堆用的鈦、鋁等合金材料的
製備 ,以及用於製造火箭、超聲速噴氣飛機和人造衛星的材料的鈦合金,都和硫酸有直接或間接的關係。從硼砂製備硼烷的過程需要多量硫酸。硼烷的衍生物是最重要的一種高能燃料。硼烷又用做製備硼氫化鈾用來分離鈾235的一種原料。 由此可見,硫酸與國防工業和尖端科學技術都有著密切的關係。
農業用途 土壤改良
在農業生產中,越來越多地採用硫酸改良高pH值的石灰質土壤。過去20年來,尿素-硫酸肥料的產量大幅度提高並在美國西部諸州的土壤中廣泛施用。將硫酸注入牛奶場湖泊,改變湖水pH值,可解決圈養牲畜過程產生的若干空氣和水質問題,將硫酸施入農用土壤和水中,其主要作用是溶解鈣、鎂的碳酸鹽和
碳酸氫鹽 。這些鈣、鎂鹽然後取代可交換的鈉鹽,鈉鹽隨後用水浸洗除去。當碳酸鹽和碳酸氫鹽被分解後,硫酸與更惰性的物質反應,釋放出磷、鐵等植物養分。簡單地降低土壤的pH值可引起許多元素溶解度的變化,提高它們對植物的效力。在高pH值的石灰質土壤上施用硫酸,可使植物更加健壯,收成增加。
化肥生產
用於肥料的生產硫酸銨(俗稱硫銨或肥田粉)和
過磷酸鈣 (俗稱過磷酸石灰或普鈣)這兩種化肥的生產都要消耗大量的硫酸。
用於農藥的生產許多農藥都要以硫酸為原料如硫酸銅、
硫酸鋅 可作植物的殺菌劑,
硫酸鉈 可作殺鼠劑,
硫酸亞鐵 、硫酸銅可作除莠劑。最普通的殺蟲劑,如1059乳劑(45%)和1605乳劑(45%)的生產都需用硫酸。
日常家居用途 世界各地大多數酸性化學通渠用品均含有濃硫酸。這一類的通渠用品就和鹼性的通渠用品一樣,可以溶解淤塞在渠道里的油污及食物殘渣等。不過,由於濃硫酸會與水發生高放熱反應,故建議在使用前儘量保持渠道乾爽,並慢慢倒入有關化學用品,另需佩戴手套。
毒理性質 屬中等毒性。
急性毒性:LD50 2140mg/kg(大鼠經口);LC50 510mg/m3 ,2小時(大鼠吸入);320mg/m3 ,2小時(小鼠吸入)
實驗室風險 一雞爪在數十秒內被濃硫酸嚴重腐蝕及碳化。 硫酸(特別是在高濃度的狀態下)能對皮肉造成極大傷害。正如其他具腐蝕性的強酸強鹼一樣,硫酸可以迅速與蛋白質及脂肪發生醯胺水解作用及酯水解作用,從而分解生物組織,造成化學性燒傷。不過,其對肉體的強腐蝕性還與它的強烈脫水性有關,因為硫酸還會與生物組織中的碳水化合物發生脫水反應並釋出大量熱能。除了造成化學燒傷外,還會造成二級火焰性灼傷。故由硫酸所造成的傷害,很多時都比其他可作比較的強酸(像鹽酸及硝酸)的大。若不慎讓硫酸接觸到眼睛的話就有可能會造成永久性失明;而若不慎誤服,則會對體內器官構成不可逆的傷害,甚至會致命。濃硫酸也具備很強的氧化性,會腐蝕大部分金屬,故需小心存放。
隨著濃度的增加,硫酸的危險性也會增加。這是因為除了酸性物質的比例在加大外,其脫水性及氧化性亦在上升。當一溶液的硫酸含量等同或超過1.5 M 時,就應貼上“腐蝕性”警告標示,而在0.5~1.5 M 之間的,則為“刺激性”。但是,即便在實驗室慣用的“低濃度”硫酸(濃度大約為1 M,10%比重)在一定時間也會蝕穿紙張。
舊時教科書認為,為了避免濃硫酸與水接觸後放出大量的熱,進一步傷害皮膚,套用乾燥的布將皮膚上的濃硫酸擦去再行處理。然而在實際操作中,就如其他腐蝕性物質,第一時間用大量清水沖洗起碼10~15分鐘是有效的辦法,大量的水能夠迅速冷卻受損組織並帶走熱量。由於濃硫酸接觸皮膚後會迅速將皮膚炭化,用乾布擦拭可能會將已受損的皮膚擦破甚至擦掉。而若硫酸意外地濺到保護衣物,應立即將其脫下,並徹底地沖洗有關部位的皮膚。
由於硫酸溶解於水放大量熱,當稀釋濃硫酸時,應把酸倒入水中而不是把水倒入酸中,這樣可以利用水的高比熱容,減低因高溫沸騰使酸濺出的風險。一般在實驗室中,稀釋6 M(約35%比重)或濃度更高的硫酸是最為危險的,因為這個分量的硫酸在與水發生反應時能釋出足夠的熱量使整杯溶液沸騰。
工業風險 雖然硫酸並不是易燃,但當與金屬發生反應後會釋出易燃的氫氣,有機會導致爆炸,而作為強氧化劑的濃硫酸與金屬進行氧化還原反應時會釋出有毒的二氧化硫,威脅工作人員的健康。 另外,長時間暴露在帶有硫酸成分的浮質中(特別是高濃度),會使呼吸管道受到嚴重的刺激,更可導致肺水腫。但風險會因暴露時間的縮短而減少。在美國,硫酸的最多可接觸分量(PEL)被定為 1 mg/m3 ,此數字在其他國家相若。誤服硫酸有機會導致維生素B12缺乏症,其中,脊椎是最易受影響的部位。
急救措施 硫酸與皮膚接觸需要用大量水沖洗,再塗上3%~5%碳酸氫鈉溶液沖,迅速就醫。濺入眼睛後應立即提起眼瞼,用大量流動清水或生理鹽水徹底沖洗至少15分鐘。迅速就醫。吸入蒸氣後應迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。迅速就醫。誤服後套用水漱口,給飲牛奶或蛋清,迅速就醫。
儲存方法 儲存於陰涼、通風的庫房。庫溫不超過35℃,相對濕度不超過85%。保持容器密封。遠離火種、熱源,工作場所嚴禁吸菸。遠離易燃、可燃物。防止蒸氣泄漏到工作場所空氣中。避免與還原劑、鹼類、
鹼金屬 接觸。搬運時要輕裝輕卸,防止包裝及容器損壞。配備相應品種和數量的消防器材及泄漏應急處理設備。倒空的容器可能殘留有害物。稀釋或製備溶液時,應把酸加入水中,避免沸騰和飛濺傷及人員。
 約翰·道爾頓在1808年繪製的早期硫酸分子圖
約翰·道爾頓在1808年繪製的早期硫酸分子圖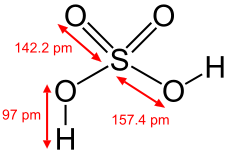 硫酸的結構式及鍵長
硫酸的結構式及鍵長 濃硫酸迅速蝕穿毛巾
濃硫酸迅速蝕穿毛巾 硫酸分子的球棍模型
硫酸分子的球棍模型 一雞爪在數十秒內被濃硫酸嚴重腐蝕及碳化。
一雞爪在數十秒內被濃硫酸嚴重腐蝕及碳化。
