基本介紹
定義
配置方法
電解飽和食鹽水


化學實驗套用
1.收集氯氣
2.吸收氯化氫氣體

3.降低某些反應的化學反應速率
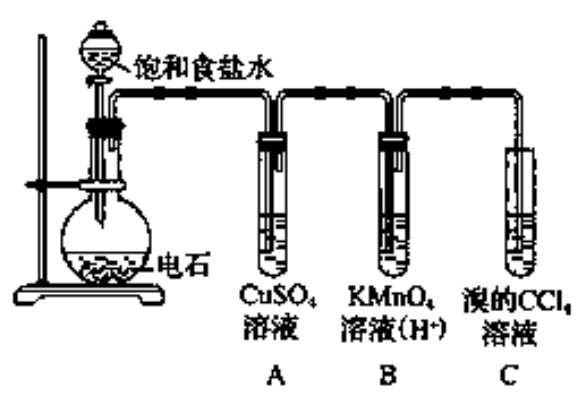







食鹽的主要成分是氯化鈉(NaCl),所以食鹽水主要是由氯化鈉溶液組成的。化學製備 排飽和食鹽水法收集氯氣,氯氣溶於水後部分形成鹽酸,從而形成氯離子(可逆),由於氯化鈉可電離出氯離子 ,使可逆反應向逆反應方向進行,氯化氫又轉化為氯氣...
因此,電解飽和食鹽水的總反應可以表示為:工業上利用這一反應原理,製取燒鹼、氯氣和氫氣。在上面的電解飽和食鹽水的實驗中,電解產物之間能夠發生化學反應,如NaOH溶液和Cl₂能反應生成NaClO、H₂和Cl₂混合遇火能發生爆炸。在工業...
氯鹼工業的主要原料:飽和食鹽水,但由於粗鹽水中含有泥沙、Ca、Mg、Fe等雜質,遠不能達到電解要求,因此必須經過提純精製。工藝設計 一次鹽水 一次澄清鹽水的製備是氯鹼生產工藝至關重要的工段,精製效果的好壞直接影響產品的質量和產量。...
《一種雷貝拉唑鈉的製備方法》包括以下步驟:雷貝拉唑硫醚加入水中,然後加入含有鈉離子的鹼性物質,在0~20℃下滴加入次氯酸鈉溶液攪拌反應12~18小時,過濾反應液,濾液中加入飽和食鹽水,攪拌後過濾,得到的固體減壓烘乾,得雷貝拉唑...
通常一種氣體可能由多種反應產生,例如,對於氯氣,既可以加熱濃鹽酸與二氧化錳得到,也可以電解食鹽水得到,也可以電解熔融的氯化鈉得到。但是限於實驗室的條件與實驗技術,並不是所有反應都適合實驗室製備、收集氣體,如電解飽和食鹽水得到...
飽和食鹽水溶液中存在 和 以及水電離產生的 和 。其中氧化性,還原性 。所以 和 發生還原或氧化反應。陰極:(還原反應)陽極:(氧化反應)總反應的化學方程式:用離子方程式表示:。電鍍套用 電鍍:套用電解原理在某些金屬表面鍍上一...
常用的漂浮液 飽和食鹽水:在1000ml水中加食鹽380g,比重約1.18。 飽和硫代硫酸鈉溶液:在1000ml水中,加硫代硫酸鈉1750g,比重在1.4左右。 此外還有飽和硫酸鎂溶液,硫酸鋅溶液等。 (3) 錦綸篩兜集卵法:取糞便5-10g,...
飽和食鹽水醃製法 水和鹽的用量按鴨蛋的多少來定。醃製時先將食鹽溶於燒開的水中,達到飽和狀態(濃度約為20%)。待鹽水冷卻後倒入壇中,並將洗淨晾乾的鴨蛋,逐個放進鹽水中,密封壇口,置通風處,25天左右即可開壇取蛋煮食。此...
第二次醃漬,就是將第一次醃漬的蕨菜和食鹽按20:1的比例,一層鹽一層蕨菜放入,最上一層還要多放一些鹽。同時,再用100kg水加35kg鹽對成飽和食鹽水,灌滿淹漬缸,蓋好木蓋,用石頭壓緊,放在陰涼處醃製14-16天即成。第二次...
在一裝有溫度計、分水器和回流冷凝管的100mL三頸瓶中按一定配料加入環己酮、1,2-丙二醇、帶水劑環己烷和一定量的催化劑,加熱反應並回流分水,至幾乎無水分出時,再延長10—20 min,稍冷,反應液用飽和食鹽水洗滌,洗滌後的有機...
加入2.5升飽和食鹽水,以乙酸乙酯3×1.2升萃取,有機相合併以飽和食鹽水洗滌一次,無水硫酸鈉乾燥,回收溶劑。剩餘油狀物矽膠柱分離,以8%的乙酸乙酯/石油醚和10%乙酸乙酯/石油醚洗脫,得到137.7克(0.3摩爾)無色油狀物,收率...
反應停止後,在反應液中加入25mL乙酸乙酯,依次分別以蒸餾水,飽和食鹽水各洗滌三次,分出有機相。有機相以無水硫酸鈉乾燥過夜後,過濾,蒸除有機溶劑,得粗產物。粗產物經柱色譜分離(石油醚和乙酸乙酯為洗脫劑)真空乾燥得純品。實...
,滴加完畢後加熱回流1小時,冷卻至室溫後,用1N鹽酸將反應液的PH值調至3~4,加入5毫升的水和5毫升乙醚,分液,水相用3×10毫升乙醚萃取,合併有機相,用飽和食鹽水(3×30毫升)洗,無水硫酸鈉乾燥,蒸除溶劑,所得殘餘物減壓...
飽和食鹽水在吸入氨氣後用二氧化碳進行碳化,便得到重鹼(碳酸輕鈣)沉澱和氯化銨溶液。在氯化銨溶液中加入石灰乳便得到氯化鈣氨水溶液,然後用二氧化碳對其進行碳化便得到碳酸鈣沉澱。熟化與硬化 生石灰(CaO)與水反應生成氫氧化鈣的過程,稱...
2.飽和食鹽水醃製法。水和鹽的用量按鴨蛋的多少來定。醃製時先將食鹽溶於燒開的水中,達到飽和狀態(濃度約為20%)。待鹽水冷卻後倒入壇中,並將洗淨晾乾的鴨蛋,逐個放進鹽水中,密封壇口,置通風處,25天左右即可開壇取蛋煮食...
反應完畢,離心,上層為生物柴油,下層為甘油,分液漏斗中分別用稀酸和熱的飽和食鹽水洗滌至下層清亮,分離出上層液,真空乾燥即得產品。3 GC檢測乾燥完畢的生物柴油,用SP-2100型氣相色譜儀檢測產物中脂肪酸甲酯(生物柴油)的含量,...
粗品四苯硼酸鈉配成溶液後加活性炭,攪拌4h,過濾脫色,濾液加熱濃縮至有少量鹽析出,維持溫度為90℃, 攪拌下加入pH=8~9的90℃的飽和食鹽水進行鹽析,趁熱過濾,結晶於60℃烘乾。所得四苯硼酸鈉分次少量加到5℃以下的丙酮中,用...
飽和食鹽水在吸入氨氣後用二氧化碳進行碳化,便得到重鹼(碳酸輕鈣)沉澱和氯化銨溶液。在氯化銨溶液中加入石灰乳便得到氯化鈣氨水溶液,然後用二氧化碳對其進行碳化便得到碳酸鈣沉澱。石灰熟化與硬化 編輯 語音 生石灰(CaO)與水反應生成氫氧化...
加完後攪拌反應30分鐘,加入少量水淬滅反應,減壓蒸除大部分THF,殘液中加入適量6N的鹽酸溶液使溶液酸化,二氯甲烷萃取兩到三次,合併有機層,飽和食鹽水洗滌,無水硫酸鎂乾燥。過濾除去乾燥劑,減壓濃縮得油狀化合物13,無需純化,可...
由電石(碳化鈣)與水作用製得。實驗室中常用電石跟水反應製取乙炔。與水的反應是相當激烈的,可用分液漏斗控制加水量以調節出氣速度。也可以用飽和食鹽水。原理:電石發生水解反應,生成乙炔。裝置:燒瓶和分液漏斗(不能使用啟普發生器...
⑴鹽漬所用的食鹽質量必須符合GB5461的有關規定。⑵配製成飽和食鹽水,過濾備用。⑶鹽水深度為18波美度,鹽漬時間為10~15分鐘,原料為鮮魚時,鹽漬時間應增加2~3分鐘。⑷鹽水與魚塊的重量之比為1﹕2。⑸鹽水可連續使用5次,但每次...
在一裝有溫度計、分水器和回流冷凝管的100mL三頸瓶中按一定配料加入環己酮、1,2-丙二醇、帶水劑環己烷和一定量的催化劑,加熱反應並回流分水,至幾乎無水分出時,再延長10—20 min,稍冷,反應液用飽和食鹽水洗滌,洗滌後的有機...
優選地,上述所述埃索美拉唑鈉新晶型的製備方法為,將4克埃索美拉唑鈉溶於17毫升純化水,加入27毫升甲苯,用乙酸調節pH7-8後分液,有機層用10毫升飽和食鹽水洗滌1次,再將有機層用無水硫酸鈉乾燥後過濾,濾液加入2.4毫升乙醇和1克...
第一次醃漬出的鹽水不能復用,避免引起腐爛;第二次醃漬時,蕨菜和食鹽的比例為20:1,採用第一次醃漬時蕨菜和鹽的放置方法,同時,再用100千克水加35千克鹽配成的飽和食鹽水,灌滿醃漬缸,蓋好蓋,用石頭壓緊,放置於蔭涼處,醃漬...
防治方法:用麩皮拌敵百蟲,撒在害蟲經常活動的地方進行毒餌誘殺;在栽培床及周邊環境噴灑敵百蟲、澳氰菊酯等農藥,亦可撤生石灰、飽和食鹽水;注意栽培場所的清潔衛生,枯枝敗葉要及時清除場外。植物文化 觀賞價值極高,花姿優雅,玲瓏可愛...
2.飽和食鹽水醃製法。水和鹽的用量按鴨蛋的多少來定。醃製時先將食鹽溶於燒開的水中,達到飽和狀態(濃度約為20%)。待鹽水冷卻後倒入壇中,並將洗淨晾乾的鴨蛋,逐個放進鹽水中,密封壇口,置通風處,25天左右即可開壇取蛋煮食...
⑴鹽漬所用的食鹽質量必須符合GB5461的有關規定。 ⑵配製成飽和食鹽水,過濾備用。 ⑶鹽水濃度為18波美度,鹽漬時間為10~15分鐘。原料為鮮魚時,鹽漬時間應增加2~3分鐘。 ⑷鹽水與魚塊的重量之比為1:2。 ⑸鹽水可連續使用5次,...
