《阿森納平的合成工藝》是上海華升生物科技有限公司於2011年4月27日申請的專利,該專利申請號:2011101065512,專利公布號:CN102229613B,專利公布日:2013年8月7日,發明人是:肖鋒、樓旭初、張淑彥、龔明明。
《阿森納平的合成工藝》公開了一種阿森納平的合成工藝,該方法以化合物18為關鍵中間體通過如下步驟製備:步驟1.1,化合物18在鹼性條件下,以銅粉做催化劑,經烏爾曼反應,生成醚19;步驟1.2,醚19經還原羰基得到目標化合物阿森納平1。《阿森納平的合成工藝》採用便宜易得的鄰溴苯甲醛為起始原料,經縮合、加成、還原胺化並內關環、胺基甲基化、開環轉位後再閉環、去甲基及烏爾曼閉環反應合成了阿森納平1。《阿森納平的合成工藝》提供的方法巧妙地對順反異構體進行了轉位,得到了反式產物,簡化了工藝,便於操作;原料易得,價格便宜,每步反應均為常規反應,條件溫和,總收率大大提高,降低生產的成本,且產品純度高,經HPLC檢測,產品純度大於99%。
2021年8月16日,《阿森納平的合成工藝》獲得安徽省第八屆專利獎銀獎。
基本介紹
- 中文名:阿森納平的合成工藝
- 公布號:CN102229613B
- 公布日:2013年8月7日
- 申請號:2011101065512
- 申請日:2011年4月27日
- 申請人:上海華升生物科技有限公司
- 地址:上海市普陀區中山北路3663號358幢304室
- 發明人:肖鋒、樓旭初、張淑彥、龔明明
- Int.Cl.:C07D491/044(2006.01)I
- 專利代理機構:上海信好專利代理事務所
- 代理人:賈慧琴
- 類別:發明專利
- 對比檔案:CN 101484456 A,2009.07.15,說明書第11-12頁.、CN 101646677 A,2010.02.10,說明書第2頁.
專利背景,發明內容,專利目的,技術方案,改善效果,技術領域,權利要求,實施方式,榮譽表彰,
專利背景
阿森納平(asenapine),即反式-5-氯-2-甲基-2,3,3a,12b-四氫-1H-二苯並[2,3:6,7]-氧雜卓並[4,5-C]吡咯的馬來酸鹽是一種具有中樞神經系統抑制活性,且具有抗組胺和抗5-羥色胺活性的化合物。研究已經證實阿森納平馬來酸鹽是一種廣譜高效的5-羥色胺、去甲腎上腺素和多巴胺的拮抗劑,具有較強的抗精神病活性,並且可以用於治療抑鬱症。已經有報導描述阿森納平的製劑用於精神病類疾病的臨床治療,因此大規模合成該藥是必需的。
截至2011年4月,阿森納平的合成方法已有多篇文獻報導。美國專利US4145434中描述了阿森納平的一般合成方法,其合成路線如下所示: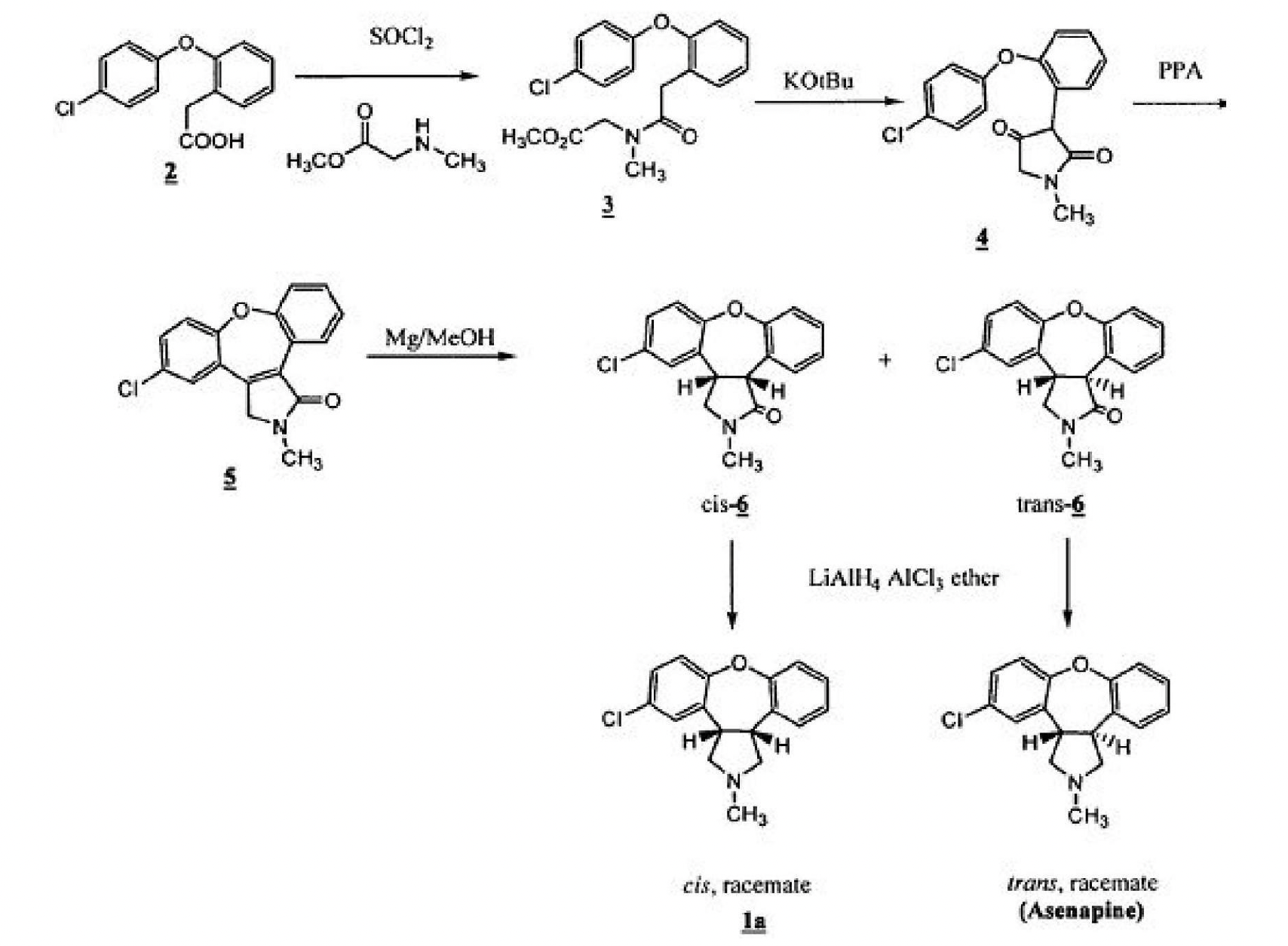

在該合成路線中,取代苯乙酸2首先和氯化亞碸(SOCl2)反應,生成醯氯後與N-甲基肌氨酸甲酯反應生成醯胺化合物3;該醯胺化合物3隨後在叔丁醇鉀(KOtBu)存在的條件下,在甲苯中閉環得到二酮化合物4;該二酮化合物4在PPA作用下在閉環得到烯醯胺5。然後,在甲醇中,用金屬鎂還原雙鍵得到順式內醯胺cis-6和反式內醯胺trans-6的混合物,二者通過柱層析分離,其中,順式內醯胺占優;然後分別用四氫鋁鋰/三氯化鋁(LiAlH4/AlCl3)還原得到順式產物1a和目標的反式產物1,即化合物asenapine。由於順式產物占優,所以該路線收率極低,成本高,不適合工業大生產。
後有文獻報導,通過還原反式醯胺trans-6得到阿森納平,因此化合物trans-6成了合成阿森納平的關鍵中間體。
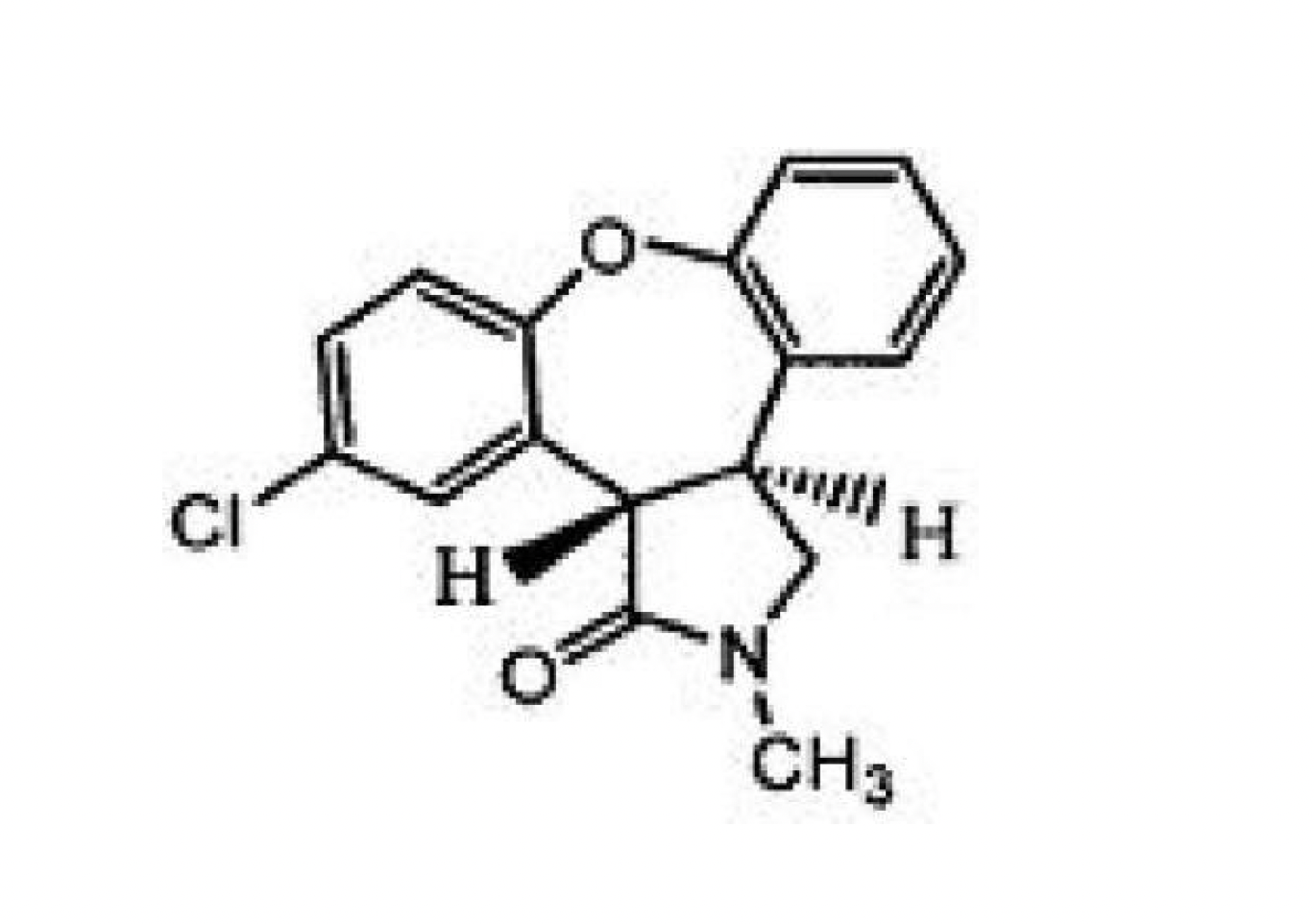
文獻EP1710241報導了合成化合物trans-6的新方法,其合成路線如下:
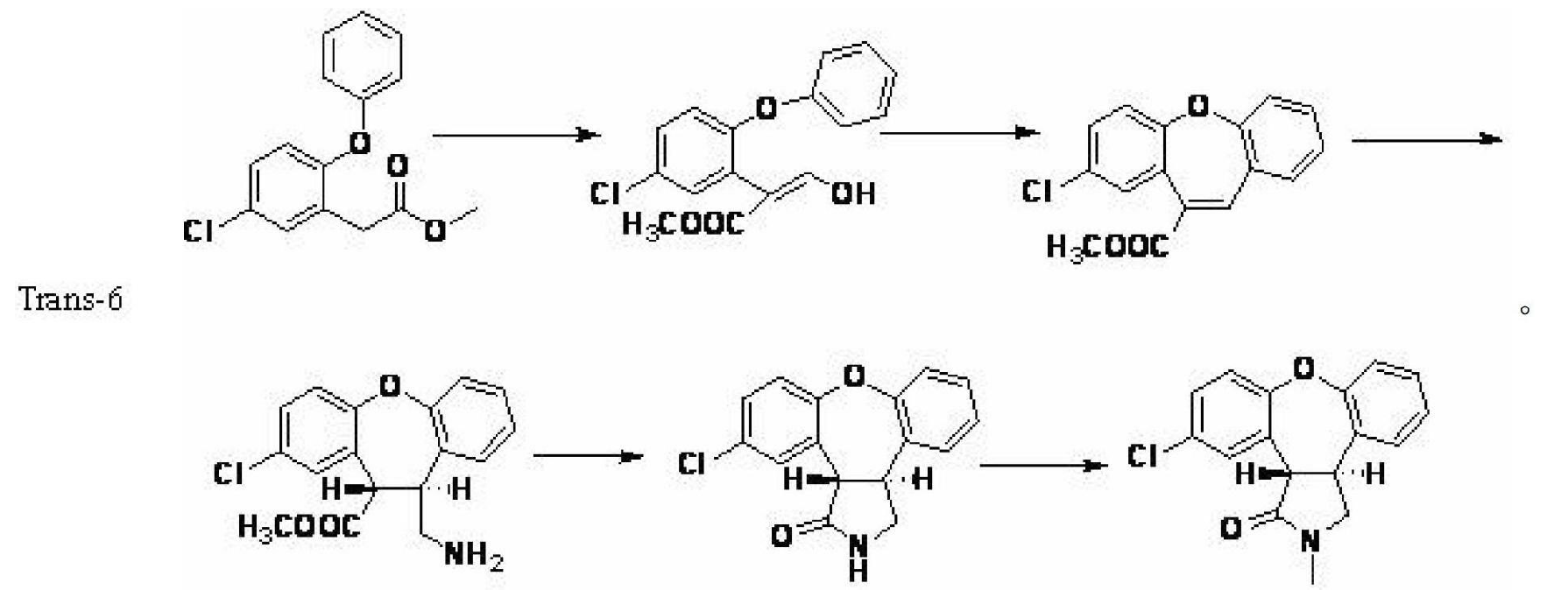
該路線的一個缺點是在醯胺甲基化的反應中,仍然會有一部分化合物轉化成了不需要的順式結構。而CN101484456,WO2008003460報導:以鄰溴苄溴為原料,在有或無溶劑的條件下與亞磷酸三乙酯反應得到磷酸酯衍生物,再與三甲胺-N-氧化物.二水合物反應得到閉環產物。最後通過烏爾曼反應在閉環得到目標化合物。
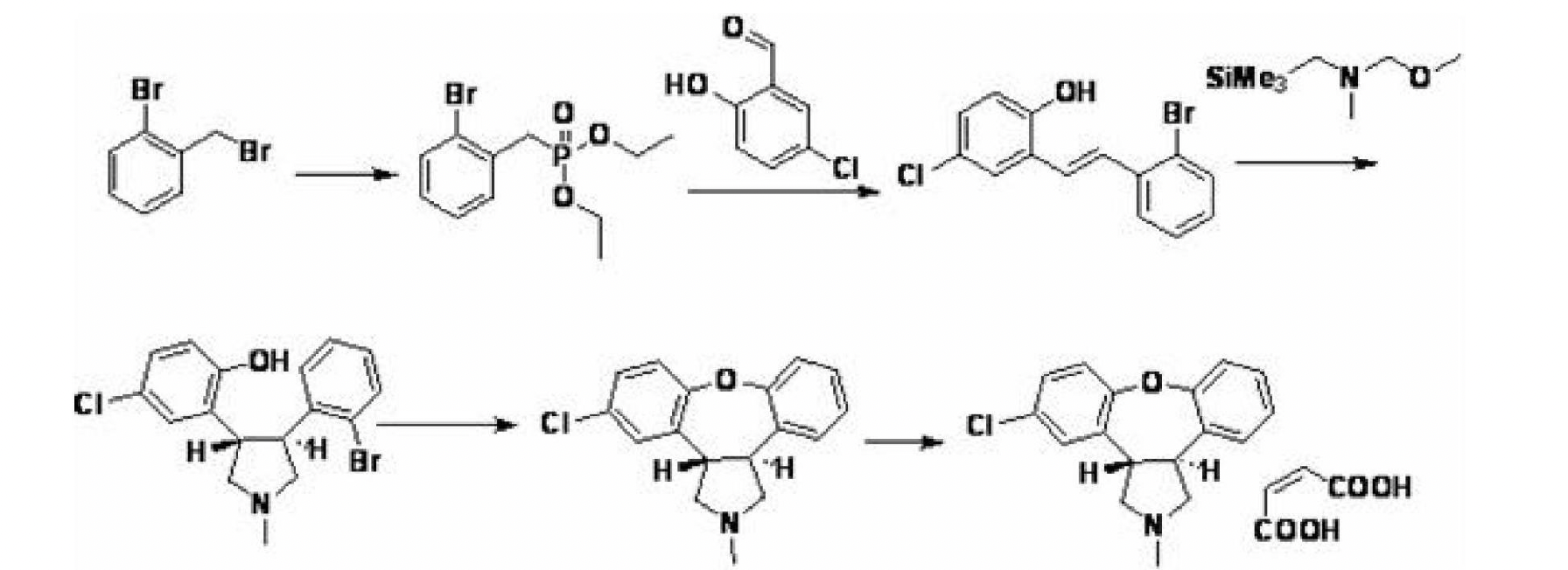
這條工藝的主要問題是:(1)反應總收率不高;(2)有多步反應,例如在三甲胺-N-氧化物的製備過程中,反應進程較難監測等缺點。
另外,WO2008081010報導以化合物7為起始原料,經雙鍵還原後得到化合物8,化合物8經過經硼氫化鈉還原得到二醇9,隨後在二醇的羥基上引入離去基團後得到化合物10,再和甲胺反應即得到目標化合物。但是由於該方法的中的起始原料化合物7不易得到,因此該反應也難以工業化。
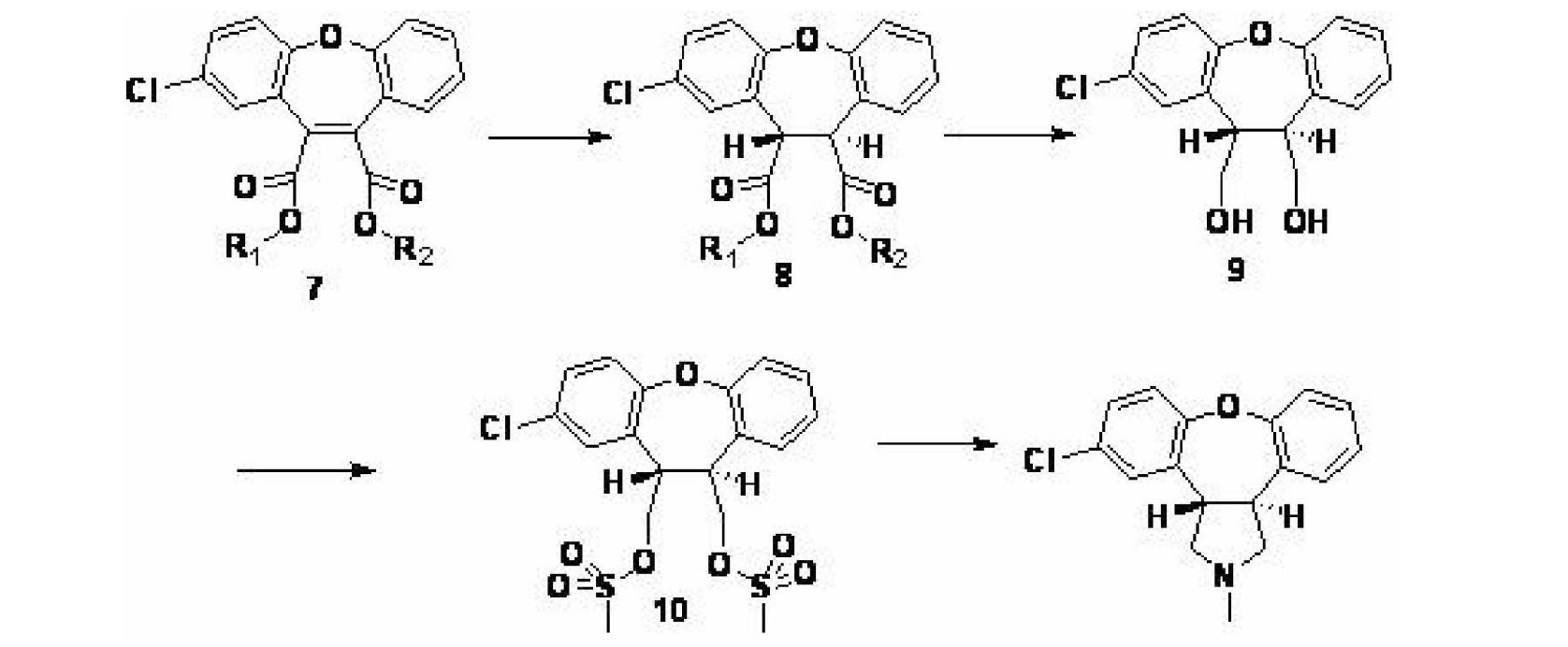
因此,希望開發一種新的工藝生產阿森納平,新工藝應該具有成本低廉、產率和純度高、易於工業生產且避免使用高毒性的溶劑或試劑等特徵。
發明內容
專利目的
《阿森納平的合成工藝》的目的是提供一種合成阿森納平的新工藝,通過簡單、易於工業化生產的工藝,以較高收率,較低成本,合成了高純度的阿森阿平,從而為阿森納平的臨床套用研究提供可靠的原料。
技術方案
為了達到上述目的,《阿森納平的合成工藝》提供了一種阿森納平的合成新工藝,該工藝路線如下:
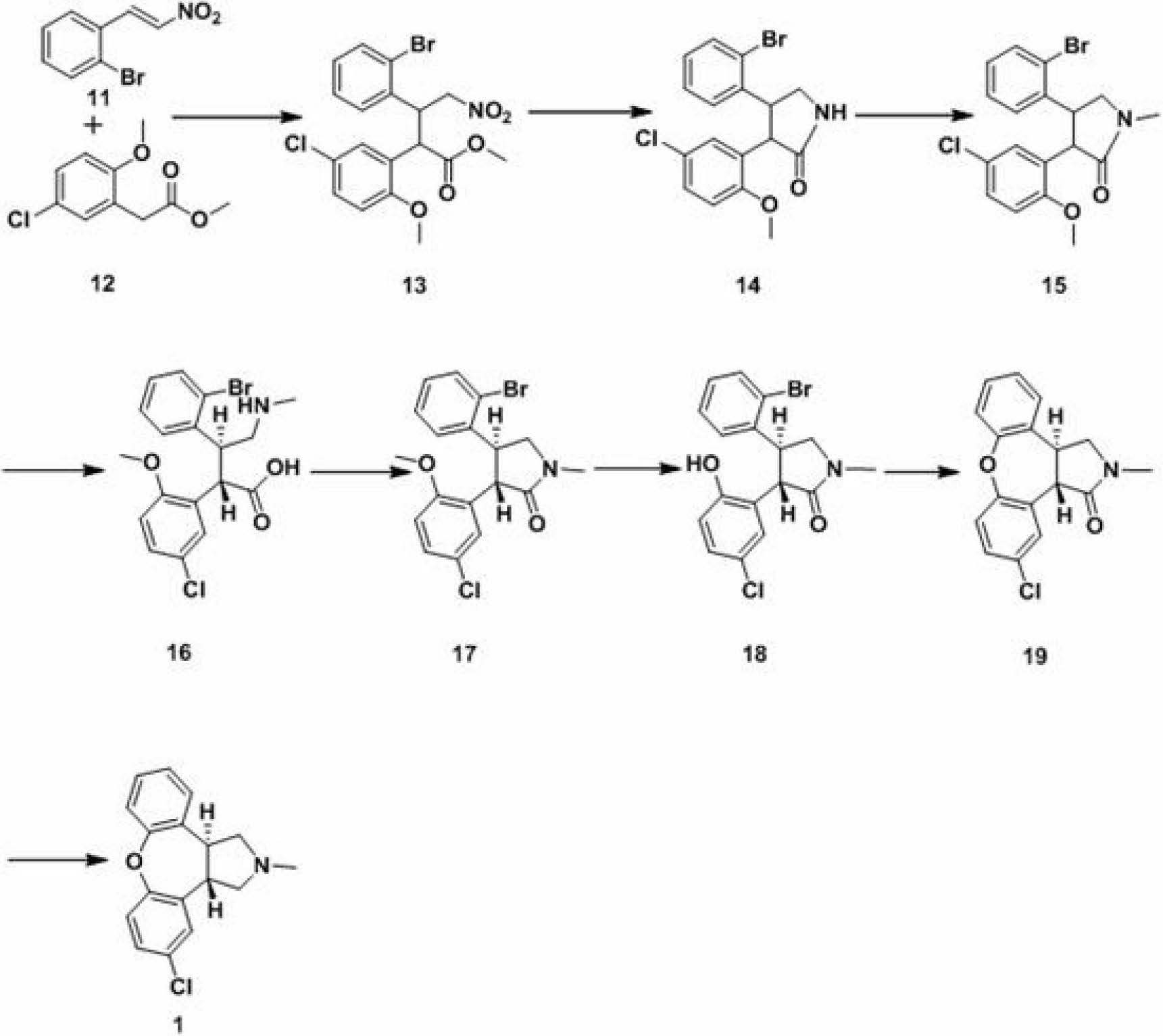
其中,2-溴-β-硝基苯乙烯11是以鄰溴苯甲醛與硝基甲烷進行縮合反應以高收率製得。
《阿森納平的合成工藝》的具體內容為:
(1)由鄰溴苯甲醛為原料,與硝基甲烷發生縮合反應,高收率的得到化合物11。
(2)將化合物11溶解在有機溶劑中,加入取代的苯乙酸甲酯12,雙鍵加成反應,經TLC檢測反應完成後,加入飽和氯化銨溶液洗滌,濃縮蒸乾得到化合物13。所述的有機溶劑選擇異丙醇、四氫呋喃等。
(3)將化合物13溶解在有機溶劑中,經催化加氫還原硝基,生成的胺基進攻酯基直接閉環,經TLC檢測反應完成後,過濾去除催化劑,減壓濃縮溶劑得到內醯胺化合物14。所述的催化劑選擇,例如鈀碳,雷尼鎳(RaneyNi)等。
(4)將內醯胺化合物14溶解在有機溶劑中,在合適鹼存在的條件下,滴加碘甲烷,反應完成後,水洗,濃縮有機層得到化合物15。所述的鹼選擇碳酸鈉、碳酸鉀、氫氧化鈉等無機鹼或者三乙胺、吡啶等有機鹼。
(5)在惰性氣體保護下,將化合物15溶解在乙醇中,加入強鹼,加熱水解開環轉位,主要得到反位產物,轉位完成後,蒸去一部分乙醇,加入適量水,甲苯萃取,濃鹽酸酸化,析晶,經抽濾、重結晶後得到16。所述的強鹼是指氫氧化鈉、氫氧化鉀等無機鹼。
(6)化合物16溶入甲苯中,加入適量催化劑,回流脫水反應,閉環得到反式產物17。所述的催化劑是指醋酸鈉。
(7)化合物17懸於甲苯中,三氯化鋁存在的條件下,回流脫甲基,反應完畢後,滴加稀鹽酸溶液,攪拌均勻後過濾得到化合物18。
(8)化合18在合適的溶劑中,以碳酸鉀做鹼,銅粉作為催化劑發生烏爾曼反應(UllmannReaction)成醚,反應完畢後先加入甲苯,再加入水,攪拌,過濾,靜置分層,甲苯層分別用10%氫氧化鈉水溶液,飽和鹽水洗滌,蒸乾甲苯層,乙醇活性炭脫色,濃縮乙醇得關鍵中間體19。
(9)化合19在合適的溶劑中,用合適的還原劑還原醯胺鍵的羰基後得到目標化合物1(asenapine)。《阿森納平的合成工藝》採用便宜易得的鄰溴苯甲醛為原料,經縮合、加成、還原胺化並內關環、胺基甲基化、開環轉位後再閉環、去甲基及烏爾曼閉環反應合成了阿森納平1。
《阿森納平的合成工藝》的新工藝的核心在於:
(1)通過化合物11和12的加成反應,得到硝基化合物13經過還原胺化,並進一步關環形成吡咯環結構,得到化合物14,胺基甲基化得到化合物15;
(2)化合物15在合適的溶劑中,經強鹼水解開環轉位後再閉環得到重要的中間體17,此步反應轉位效果好,收率高,解決了以前合成路線中常有順式產物生成的缺點。
改善效果
(1)起始原料易得且價格便宜,每步反應均為常規反應,反應條件溫和,使該工藝符合藥品生產的要求。
(2)巧妙地對順反異構體進行了轉位,得到了反式產物,簡化了工藝,便於操作。
(3)該工藝總收率大大提高,降低生產的成本,且產品純度高,經HPLC檢測,產品純度大於99%。
技術領域
《阿森納平的合成工藝》涉及用於製備抗精神抑鬱藥物的阿森納平,即反式-5-氯-2-甲基-2,3,3a,12b-四氫-1H-二苯並[2,3:6,7]-氧雜卓並[4,5-C]吡咯的製備方法,及其所涉及的中間體。
權利要求
1.一種阿森納平的合成工藝,其特徵在於,該方法以化合物(18)為關鍵中間體通過如下步驟製備: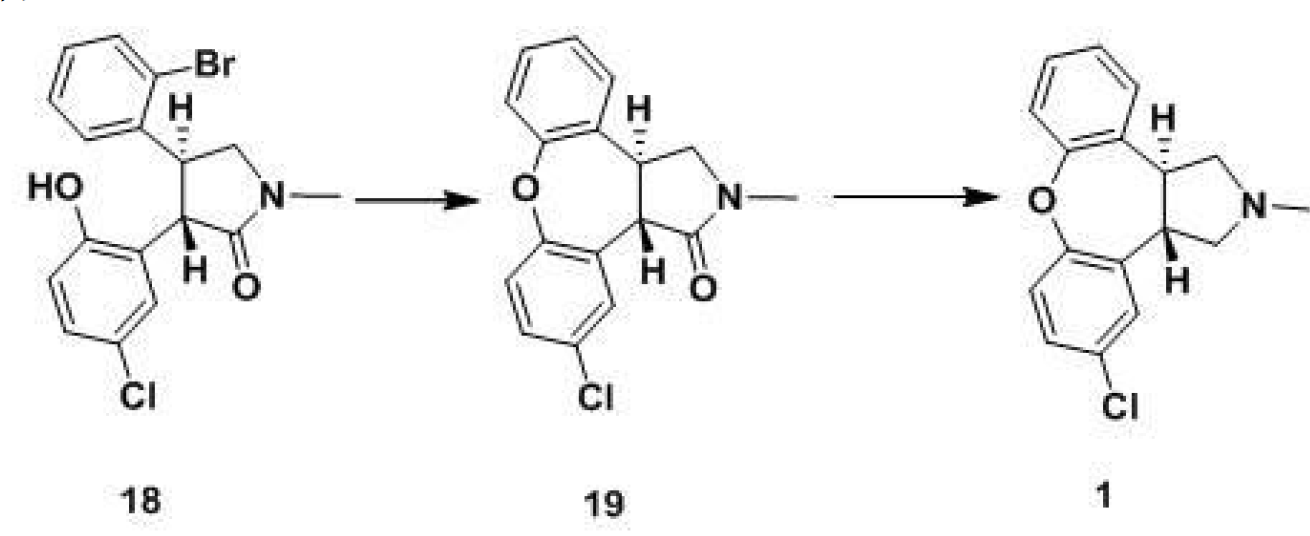

步驟1.1,化合物(18)在鹼性條件下,以銅粉做催化劑,經烏爾曼反應,生成醚(19);
步驟1.2,醚(19)經還原羰基得到目標化合物阿森納平(1);
其中,所述的關鍵中間體化合物(18)是中間體化合物(15)通過如下步驟製得:
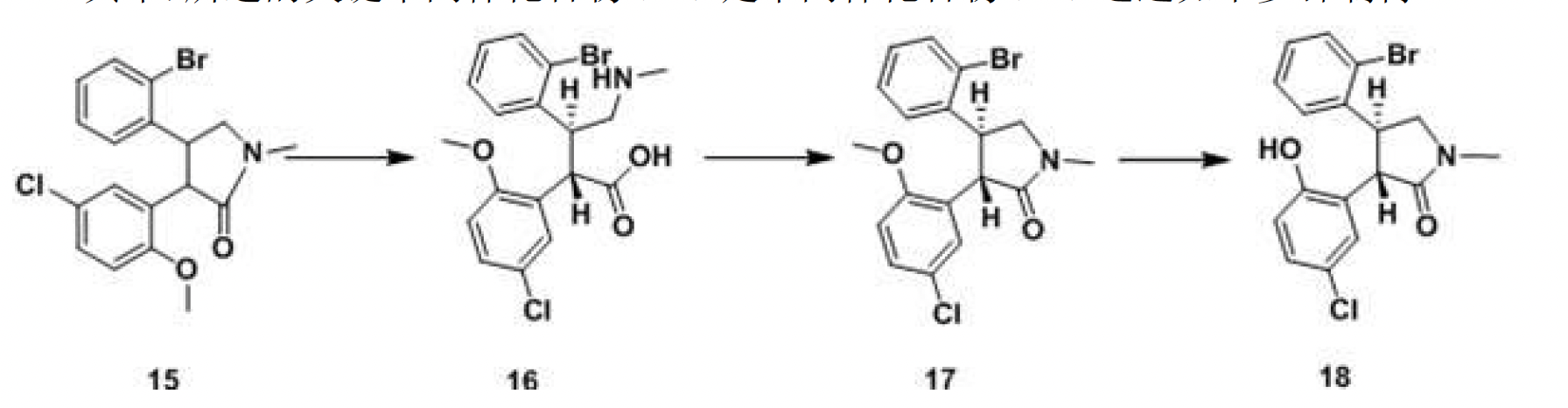
步驟3.1,中間體化合物(15)在鹼性條件下,加熱,水解開環轉位,得到反式化合物(16);
步驟3.2,加入適量催化劑,回流脫水,關環成內醯胺化合物(17);
步驟3.3,內醯胺化合物(17)在三氯化鋁存在下,回流脫去甲基得到化合物(18)。
2.如權利要求1所述的阿森納平的合成工藝,其特徵在於,在所述的步驟1.2,是採用三氯化鋁及四氫鋁鋰作為還原劑還原羰基。
3.如權利要求1所述的阿森納平的合成工藝,其特徵在於,所述的中間體化合物(15)是以化合物(13)通過如下步驟製得:
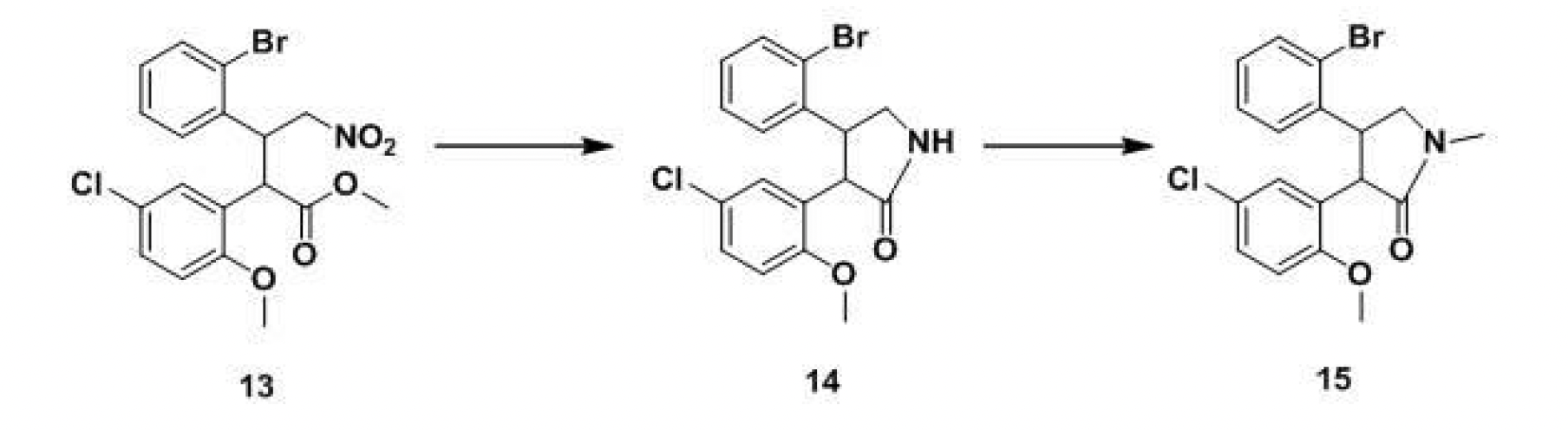
步驟4.1,化合物(13)經催化氫化還原反應,將硝基還原為胺基,該胺基同時與酯基反應,關環成內醯胺化合物(14);步驟4.2,內醯胺化合物(14)在鹼性條件下,與碘甲烷反應,在胺基上引入甲基,得到化合物(15)。
4.如權利要求3所述的阿森納平的合成工藝,其特徵在於,所述的中間體化合物(13)是2-甲氧基-5-氯苯乙酸甲酯(12)為原料,與2-溴-β-硝基苯乙烯(11)通過雙鍵加成反應製得。
5.如權利要求4所述的阿森納平的合成工藝,其特徵在於,所述的2-溴-β-硝基苯乙烯(11)是以鄰溴苯甲醛與硝基甲烷進行縮合反應製得。
實施方式
- 實施例1:化合物11的製備
將68克鄰溴苯甲醛、200毫升硝基甲烷和40克乙酸銨在50毫升冰醋酸中回流2小時,反應完畢後,向體系中加入1300毫升水,攪拌均勻後過濾,得到的黃色粗品在乙醇中重結晶,得到78克2-溴-β-硝基苯乙烯,即化合物11,收率87.2%。
- 實施例2:化合物13的製備
將38.6克乾燥異丙醇溶於150毫升的乾燥四氫呋喃(THF)中,體系冷卻至-60攝氏度以下,攪拌下滴加192毫升的正丁基鋰的正己烷溶液。攪拌反應30分鐘後,滴加94.5克的2-甲氧基-5-氯苯乙酸甲酯於300毫升乾燥THF形成的溶液。再攪拌15分鐘後,在攪拌條件下滴加64.4克2-溴-β-硝基苯乙烯(11)在600毫升乾燥THF中形成的溶液,保持溫度低於50攝氏度。加完後攪拌反應30分鐘,加入少量水淬滅反應,減壓蒸除大部分THF,殘液中加入適量6N的鹽酸溶液使溶液酸化,二氯甲烷萃取兩到三次,合併有機層,飽和食鹽水洗滌,無水硫酸鎂乾燥。過濾除去乾燥劑,減壓濃縮得油狀化合物13,無需純化,可直接投入下一步反應。
- 實施例3:化合物14的製備
將上步反應所得油狀化合物13溶解於1000毫升乙醇中,加入10克的10%的Pd/C,加氫反應過夜,反應完畢後過濾去除催化劑,減壓濃縮濾液,加入適量乙醚,得灰白色固體,乙醇重結晶得醯胺化合物14的精品103克(順反異構混合物),兩步收率76.4%。
- 實施例4:化合物15的製備
將76.0克的醯胺化合物14及41.0克無水碳酸鉀溶於500毫升DMF中,冰浴,滴加29.6克碘甲烷,滴加完畢後撤去冰浴繼續反應1小時,反應完畢後倒入2000水中,稀鹽酸調節至弱酸性,攪拌均勻,過濾,乾燥得75.0克化合物15,收率95.0%。
- 實施例5:化合物16的製備
將75.0克化合物15的順反異構混合物加入到600毫升乙醇中,溶清後加入20.0克的氫氧化鉀(KOH),加熱回流反應5小時,反應完畢後冷卻至室溫。加入500毫升甲苯,5M的鹽酸調節pH到1,析出固體,過濾,得固體。水相以甲苯萃取,棄去有機相,水相減壓蒸除乙醇至固體析出,放置,室溫析晶,合併,得固體化合物16,備用。
- 實施例6:化合物17的製備
將上步固體化合物16加到500毫升反應瓶內,加入300毫升甲苯,無水乙酸鈉2.0克。加熱升溫,使用分水器,使其回流分水,無水分出時反應結束,冷卻至室溫,加入水200毫升;攪拌30分鐘;濾去固體。濾液分去水層後;甲苯層水洗一次。甲苯層濃縮至微量,冷卻析晶,過濾得到化合物17計51.0克,兩步收率68.0%。
- 實施例7:化合物18的製備
將12.0克的無水三氯化鋁加到500毫升反應瓶內,加入200毫升甲苯,分批加入30.0克的化合物17,回流反應2小時,反應完畢後滴加稀鹽酸100毫升淬滅反應,攪拌均勻後過濾,濾渣水洗至中性,乾燥得化合物18計25.1克,收率90.1%。
- 實施例8:化合物19的製備
將9.8克碳酸鉀及1.5克的銅粉懸浮於40毫升的DMF中,氮氣保護,加熱至140攝氏度,加入上步產物23.5克,充分攪拌反應約20個小時,反應完畢後過濾除去不溶物,濾液倒入水中,過濾,乙醇重結晶得化合物19計13.7克,收率75.1%。
- 實施例9:阿森納平1的製備
在0℃條件下,將6.9克的三氯化鋁分批加入100毫升的乾燥THF中,繼續攪拌的條件下添加2.5克的LiAlH4,加完後冷卻體系至0℃,攪拌15分鐘。將10.0克的化合物19溶解於100毫升的乾燥THF中,滴加於上述體系中,保持溫度低於15℃。攪拌反應1小時,反應完畢後滴加1N的氫氧化鈉溶液60毫升,加入150毫升甲苯及100毫升水,保持體系溫度低於15度,攪拌15分鐘。分離有機層,水層用甲苯萃取兩次,每次50毫升,合併有機層,減壓蒸去溶劑,得到9.3克的阿森納平1,收率97.9%。
榮譽表彰
2021年8月16日,《阿森納平的合成工藝》獲得安徽省第八屆專利獎銀獎。。

