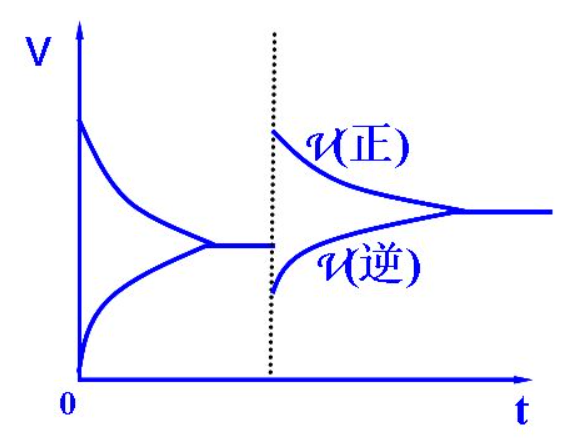
概念
基本含義
化學平衡的建立是以可逆反應為前提的。
可逆反應是指在同一條件下既能正向進行又能逆向進行的反應。絕大多數化學反應都具有可逆性,都可在不同程度上達到平衡。化學平衡則是指在巨觀條件一定的可逆反應中,化學反應正逆反應
速率相等,反應物和生成物各組分濃度不再改變的
狀態。可用Δ
rG
m=Σν
Αμ
Α=0判斷,μ
A是反應中A物質的化學勢。根據
吉布斯自由能判據,當Δ
rG
m=0時,反應達最大限度,處於
平衡狀態。根據
勒夏特列原理,如一個已達平衡的系統被改變,該系統會隨之改變來抗衡該改變。
化學平衡在分析化學中有著極為重要的套用。
平衡常數
化學平衡常數,是指在一定溫度下,可逆反應無論從正反應開始,還是從逆反應開始,也不管反應物起始濃度大小,最後都達到平衡,這時各生成物濃度的
化學計量數次冪的乘積除以各反應物濃度的化學計量數次冪的乘積所得的比值是個常數,用K表示,這個常數叫化學平衡
常數。
反應aA(g)+bB(g)=cC(g)+dD(g)
K=(Cc×Dd)/(Aa×Bb)
平衡移動
在
化學反應條件下,因反應條件的改變,使可逆反應從一種平衡狀態轉變為另一種平衡狀態的過程,叫化學平衡的移動。化學平衡發生移動的根本原因是正逆反應速率不相等,而平衡移動的結果是可逆反應到達了一個新的平衡狀態,此時正逆反應速率重新相等(與原來的速率可能相等也可能不相等)。
平衡過程
(1)過程(動力學角度)
從動力學角度看,反應開始時,反應物濃度較大,
產物濃度較小,所以正反應速率大於逆反應速率。隨著反應的進行,反應物濃度不斷減小,產物濃度不斷增大,所以正反應速率不斷減小,逆反應速率不斷增大。當正、逆反應速率相等時,系統中各物質的濃度不再發生變化,反應就達到了平衡。此時系統處於
動態平衡狀態,並不是說反應進行到此就完全停止.
(2)過程(微觀角度)
從微觀角度講則是因為在可逆反應中,反應物分子中的化學鍵斷裂速率與生成物化學鍵的斷裂速率相等所造成的平衡現象。
等效平衡
定義
同一可逆反應,一定條件下,當改變起始時反應物或生成物
物質的量或物質的量濃度,達到平衡時,混合物中各
組分的百分組成相等,這樣的平衡稱等效平衡。
產生原因:平衡,只與溫度、壓強和濃度有關,與加料順序無關。
根據氣體狀態方程,pV=nRT,可以發現:如果保持溫度不變,恆容體系,只要“一邊倒”之後,各組分n相同,壓強也相同,平衡狀態也相同。如果保持溫度不變,恆壓體系,只要“一邊倒”之後,各組分n成同一比例,濃度也相同,那么平衡狀態也相同。
規律與判斷
如反應 2SO2+O2=(可逆)=2SO3 在(A)、(B)條件時建立等效平衡
(A) 起始時加入:2mol SO2 + 1mol O2
(B) 起始時加入:2mol SO3
注意:此情況下,無論反應物還是生成物,起始時物質的量一定要與化學計量數比相同。
(2) 一般可逆反應,恆溫恆壓時,當起始反應物或生成物的物質的量比(不一定要求與化學計量數比相同)相同時,即建立等效平衡。
如反應 2SO2+O2=(可逆)=2SO3 在(C)、(D)時建立等效平衡
(C)起始時加入:1mol SO2 + 1mol O2
(D)起始時加入:2mol SO2 + 2mol O2
(3) 對於反應前後體積不變的氣體反應,恆溫
恆容時,當起始反應物或者生成物的物質的量比(不一定要求與
化學計量數比相同)相同時,建立等效平衡。
如反應 H2+I2(氣) 2HI 在(E)、(F)時建立等效平衡
(E)起始時加入:1mol H2+2mol I2
(F)起始時加入:2mol H2+4mol I2
影響化學平衡因素
影響化學平衡的因素有很多,如壓強、溫度、濃度等。
勒夏特列原理:如果改變影響平衡的一個條件(濃度壓強或溫度等),平衡就向能夠減弱這種改變的方向移動。
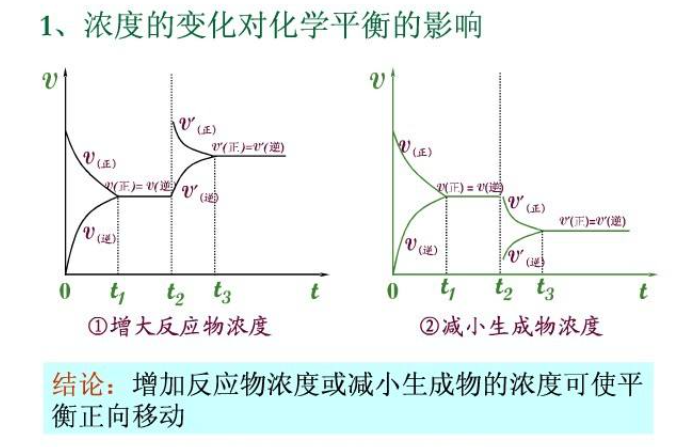
濃度影響
在其他條件不變時,增大
反應物的濃度或減小生成物的濃度,有利於正反應的進行,平衡向右移動;增加生成物的濃度或減小反應物的濃度,有利於
逆反應的進行平衡向左移動。單一物質的濃度改變只是改變正反應或逆反應中一個反應的反應速率而導致正逆反應速率不相等,而導致平衡被打破。
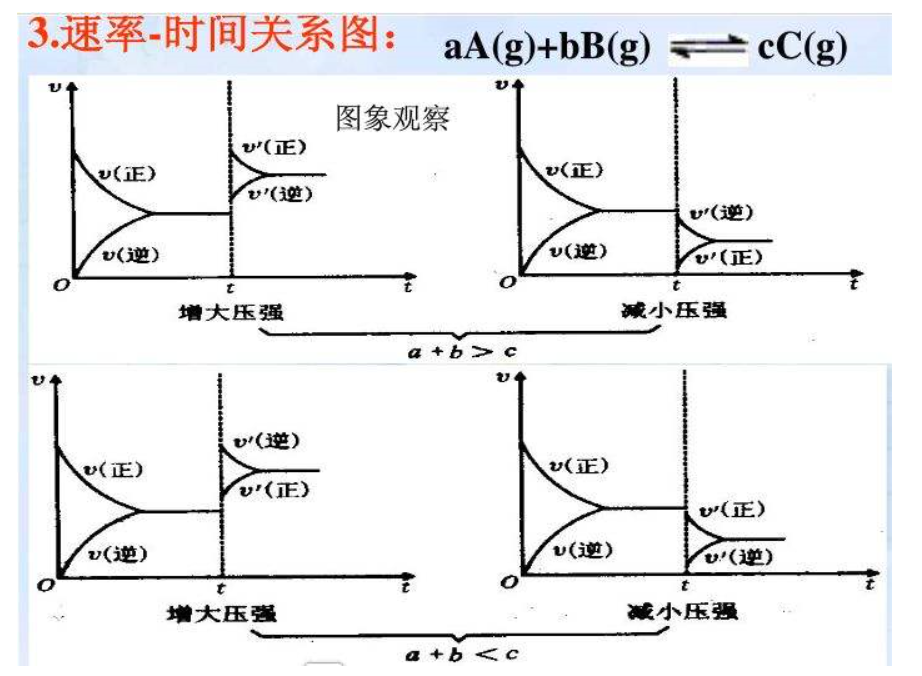
壓強影響
對於氣體
反應物和氣體生成物分子數不等的可逆反應來說,當其它條件不變時,增大總壓強,平衡 向 氣體分子數減少即氣體體積縮小的方向移動;減小總壓強,平衡向氣體分子數增加即氣體體積增大的方向 移動。若反應前後氣體總分子數(總體積)不變,則改變壓強不會造成平衡的移動。壓強改變通常會同時改變正,
逆反應速率,對於氣體總體積較大的方向影響較大,例如,正反應參與的氣體為三個單位體積,逆反應參與的氣體為兩個單位體積,則增大壓強時正反應速率提高得更多,從而使v正>v逆,即平衡向正反應方向移動;而減小壓強時,則正反應速率減小得更多,平衡向
逆反應方向移動。
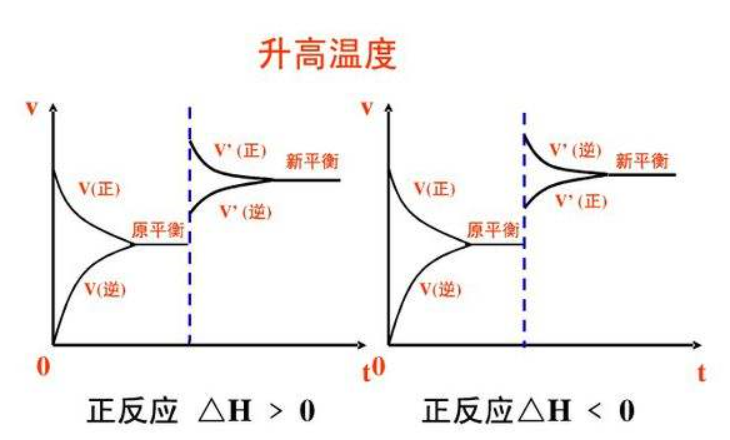
溫度影響
在其他條件不變時,升高反應溫度,有利於
吸熱反應,平衡向吸熱反應方向移動;降低反應溫度,有利於放熱反應,平衡向放熱反應方向移動。與壓強類似,溫度的改變也是同時改變正,
逆反應速率,升溫總是使正,逆反應速率同時提高,降溫總是使正,逆反應速率同時下降。對於吸熱反應來說,升溫時正,反應速率提高得更多,而造成v正>v逆的結果;降溫時吸熱方向的反應速率下降得也越多。與壓強改變不同的是,每個化學反應都會存在一定的熱效應,所以改變溫度一定會使平衡移動,不會出現不移動的情況。
催化劑影響
催化劑能同等程度的改變v正和v逆,對化學平衡移動無影響,但能縮短達到平衡所用的時間。
平衡判定
基本特徵
化學平衡狀態具有逆,等,動,定,變、同等特徵。
逆:化學平衡研究的對象是可逆反應。
等:處於密閉體系中的可逆反應,平衡時,正逆
反應速率相等,即v
正=v
逆。(對於同一個物質,v正=v逆數值上相等;對於不同物質,v
A正:v
B逆=a:b,即等於係數比)
動:平衡時,反應仍在進行,是動態平衡,反應進行到了最大程度。(V正=V逆且都不等於0)
定:達到平衡狀態時,反應混合物中各組成成份的(百分)含量保持不變,反應速率保持不變,反應物的轉化率保持不變。
變:化學平衡跟所有的動態平衡一樣,是有條件的,暫時的,相對的,當條件發生變化時,平衡狀態就會被破壞,由平衡變為不平衡,再在新的條件下建立新平衡。
同:對於一個確定的可逆反應,不管是從
反應物開始反應,還是從生成物開始反應,亦或是從反應物和生成物同時開始, 只要滿足各組分物質濃度相當,都能夠達到相同的平衡狀態。
基本模型
關於氣體的化學平衡有這兩種基本模型,即一種是等容裝置,另一種是等壓裝置。
對於一個反應Aa+Bb=Cc+Dp 其中A,B,C,D為
方程式前的計量數。
第一大類:TV不變,即容積不變時。
(1)A+B>C+D 或A+B<C+D
這個時候只能建立
等同平衡,這種相同是建立在平衡的基礎上的,百分含量不變。
(2)A+B=C+D的時候
這個時候可以建立
等效平衡,即在平衡時候之前加入的個生成物是按比例生成的,此時各物質濃度會隨著加入的比的變化而變化,但這兩種情況各物質的百分含量是不變的。
第二大類:TP不變 即容器的壓強不變
這類的容器一般與活塞相連,保證了活塞內氣體的作用力不變。
(1)A+B>C+D 或A+B<C+D
這種類型的可逆反應。由於壓強是會隨著反應的改變而改變的,但在這種容器中外界的大氣壓力會使反應時刻處於平衡狀態。故這種平衡下什麼都是不變的,如各物質的濃度百分比。
(2)A+B=C+D
這種類型的可以說是以上所有類型的綜合體。就是真正意義上的什麼都不變。就好像是進行同一個反應,一個用大碗一個用小碗一樣。
限度判斷
(1)體系中各組分的
物質的量的濃度或體積分數、物質的量分數保持不變;
(2)全是氣體參加的、前後
化學計量數改變的可逆反應,壓強保持不變;
(4)對於有顏色的物質參加或生成的可逆反應,顏色不隨時間發生變化;
(5)對同一物質而言,斷裂
化學鍵的物質的量與形成化學鍵的物質的量相等。
(6)V正=V逆。
研究歷史
19世紀50-60年代,
熱力學的基本規律已明確起來,但是一些熱力學概念還比較模糊,數字處理很煩瑣,不能用來解決稍微複雜一點的問題,例如
化學反應的方向問題。當時,大多數化學家正致力於有機化學的研究,也有一些人試圖解決化學反應的方向問題。這種努力除了
質量作用定律之外,還有其他一些人試圖從別的角度進行反應方向的探索,其中已有人提出了一些經驗性的規律。
在這一時期,丹麥人湯姆生和貝特羅試圖從化學反應的
熱效應來解釋化學反應的方向性。他們認為,
反應熱是
反應物化學
親合力的量度,每個簡單或複雜的純化學性的作用,都伴隨著熱量的產生。貝特羅更為明確地闡述了與這相同的觀點,並稱之為“最大功原理”,他認為任何一種無外部能量影響的純
化學變化,向著產生釋放出最大能量的物質的方向進行。雖然這時他發現了一些
吸熱反應也可以自發地進行,但他卻主觀地假定其中伴有放熱的物理過程。這一錯誤的論斷在30年代終於被他承認了,這時他才將“最大功原理”的套用範圍限制在固體間的反應上,並提出了實際上是“
自由焓”的化學熱的概念。
19世紀60-80年代,
霍斯特曼、
勒夏特列和
范霍夫在這一方面也做了一定的貢獻。首先,霍斯特曼在研究氯化銨的升華過程中發現,在熱分解反應中,其分解壓力和溫度有一定的關係,符合
克拉配龍方程(克勞胥斯一
克拉佩隆方程):dp/dt=Q/T(V'-V)
其中Q代表分解熱,V、V'代表分解前後的總體積。范霍夫依據上述方程式導出的下式:
lnK=-(Q/RT)+c
此式(
范托霍夫方程)可套用於任何反應過程,其中Q代表體系的吸收的熱(即
升華熱)。范霍夫稱上式為動態平衡原理,並對它加以解釋,他說,在物質的兩種不同狀態之間的任何平衡,因溫度下降,向著產生熱量的兩個體系的平衡方向移動。1874年和1879年,穆迪埃和
羅賓也分別提出了這樣的原理。穆迪埃提出,壓力的增加,有利於體積相應減少的反應發生。在這之後,勒夏特列又進一步普遍地闡釋了這一原理。他說,處於化學平衡中的任何體系,由於平衡中的多個因素中的一個因素的變動,在一個方向上會導致一種轉化,如果這種轉化是惟一的,那么將會引起一種和該因素變動符號相反的變化。
然而,在這一方面做出突出貢獻的是
吉布斯,他在熱力化學發展史上的地位極其重要。吉布斯在勢力化學上的貢獻可以歸納4個方面。第一,在克勞胥斯等人建立的第二定律的基礎上,吉布斯引出了平衡的判斷依據,並將熵的判斷依據正確地限制在孤立體系的範圍內。使一般實際問題有了進行普遍處理的可能。第二,用內能、熵、體積代替溫度、壓力、體積作為變數對體系狀態進行描述。並指出湯姆生用溫度、壓力和體積對體系體狀態進行描述是不完全的。他倡導了當時的科學家們不熟悉的
狀態方程,並且在內能、熵和體積的
三維坐標圖中,給出了完全描述體系全部
熱力學性質的曲面。第三,吉布斯在熱力學中引入了“濃度”這一變數,並將明確了成分的濃度對內能的
導數定義為“熱力學勢”。這樣,就使熱力學可用於處理多組分的多相體系,化學平衡的問題也就有了處理的條件。第四,他進一步討論了體系在電、磁和表面的影響下的平衡問題。並且,他導出了被認是熱力學中最簡單、最本質也是最抽象的熱力學關係,即
相律,在,而平衡狀態就是相律所表明的
自由度為零的那種狀態。
吉布斯對平衡的研究成果主要發表在他的三篇文章之中。1873年,他先後將前兩篇發表在康乃狄克州學院的學報上,立即引起了
麥克斯韋的注意。吉布斯前兩篇文可以說只是一個準備,1876年和1878年分兩部分發表了第三篇文章-《關於復相物質的平衡》,文章長達300多頁,包括700多個公式。前兩篇文章是討論單一的化學物質體系,這篇文章則對多組分復相體系進行了討論。由於熱力學勢的引入,只要將
單組分體系狀態方程稍加變化,便可以對多組分體系的問題進行處理了。
對於吉布斯的工作,勒夏特列認為這是一個新領域的開闢,其重要性可以與質量不滅定律相提並論。然而,吉布斯的三篇文章發表之後,其重大意義並未被多數科學家們所認識到,直到1891年才被奧斯特
瓦德譯成德文,1899年
勒夏特列譯成法文出版之後,情況頓然改變。在吉布斯之後,熱力學仍然只能處理
理想狀態的體系。這時,美國人洛易斯分別於1901年和1907年發表文章,提出了“
逸度”與“
活度”的概念。路易斯談到“逃逸趨勢”這一概念,指出一些熱力學量,如溫度、壓力、濃度、熱力學勢等都是逃逸趨勢量度的標度。
路易斯所提出的逸度與活度的概念,使吉布斯的理論得到了有益的補充和發展,從而使人們有可能將理想體系的偏差進行統一,使實際體系在形式上具有了與理想體系完全相同的熱力學關係式。
綜上所述,
化學平衡狀態是指在一定條件下的可
逆反應,正反應和逆反應的速率相等,反應混合物中各組分的濃度保持不變的狀態。