物理概念
在無機反應中,有元素化合價升降,即電子轉移(得失或偏移)的化學反應是氧化還原反應。在有機反應中,有機物引入氧或脫去氫的作用叫做氧化反應,引入氫或失去氧的作用叫做還原反應。
氧化與還原的反應是同時發生的,即是說氧化劑在使被氧化物質氧化時,自身也被還原。而還原劑在使被還原物還原時,自身也被氧化。
氧化還原反應的特徵是元素化合價的升降,實質是發生電子轉移。
判斷依據
無機反應時,得到了電子(或電子對偏向)的元素被還原,失去了電子(或電子對偏離)的元素被氧化。有機物反應時,把有機物引入氧或脫去氫的作用叫氧化,引入氫或失去氧的作用叫
還原。
即應看其是失去了電子(或電子對偏離),還是得到了電子(或電子對偏向)或者看其化合價是升高了還是降低了。
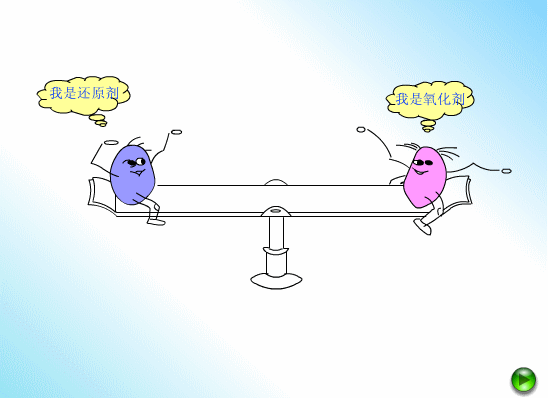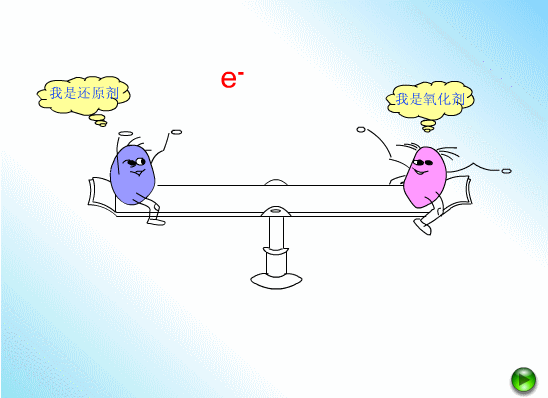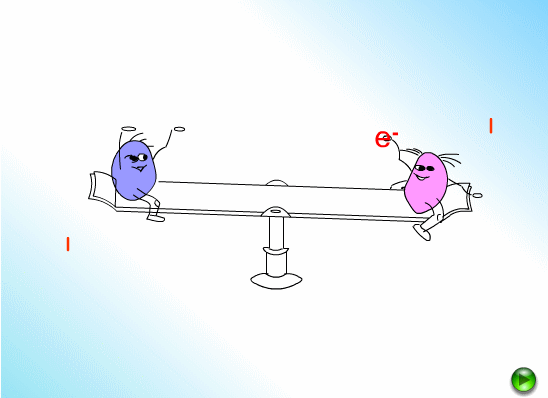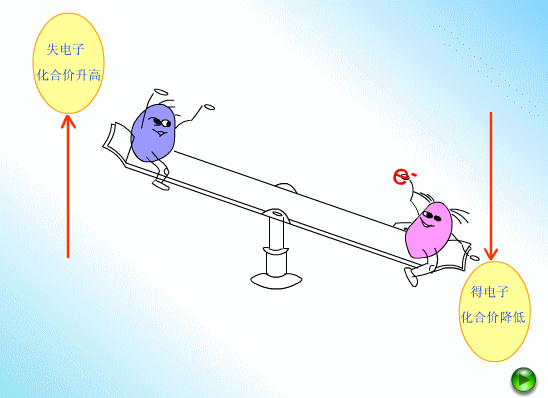
在反應物中:失去了電子(或電子對偏離)即為
還原劑,其化合價升高。得到了電子(或電子對偏向)即為氧化劑,其化合價降低。
在產物中:被氧化的產物叫做
氧化產物,其化合價在反應的過程中升高了。被還原的產物叫做
還原產物,其化合價在反應的過程中降低了。
一般來說,在氧化劑、還原劑、氧化產物、還原產物中,氧化劑的
氧化性最強,還原劑的
還原性最強。可以用來判斷氧化還原反應的發生。
反應類型
歧化反應即反應中同一元素從一個價態轉化為兩個價態。一個高價態,一個低價態,也就是說同一物質既做氧化劑又做還原劑。(例如NO2和水的反應,或Cl2和水的反應)
歸中反應是指同一元素的不同價態升至或降至相鄰價態。但要注意符合化合價不能交叉的原理。
置換反應一定是氧化還原反應,有單質生成的分解反應和化合反應也是氧化還原反應,複分解反應一定不是氧化還原反應。
由單質生成的不一定是氧化還原反應,同素異形體就不是,如石墨(C)在高溫高壓下化學反應生成金剛石(C),化合價沒變,所以不是氧化還原反應。
記憶口訣
得電子者氧化劑。
氧化劑還原劑,相依相存永不離。
前兩行也可以是:上失氧,下得還。
解釋 :化合價上升失電子被氧化,本身作為還原劑;化合價下降得電子被還原,本身作為氧化劑。
升失氧還氧【諧音記憶法:師生還陽】(化合價升高,失去電子,氧化反應,還原劑,被氧化)
降得還氧還(化合價降低,得到電子,還原反應,氧化劑,被還原)
還原劑——化合價升高——失去電子——被氧化——發生氧化反應——生成氧化產物;
氧化劑——化合價降低——得到電子——被還原——發生還原反應——生成還原產物。
先標化合價,
再看價變化,
起止同元素,
橋上標變化,
上標升失氧,
下標降得還,
電子轉移數,
原數乘變價。
氧化還原反應的定義、性質、特徵口訣:
升失氧,降得還;
若說劑,兩相反。
"氧氧得意"。“還還失意”(氧化劑,得電子,還原劑,失電子)
氧化數法
氧化數:表示元素氧化態的代數值,反映在一個化合物中電子的偏離情況,即化合物中某元素所帶形式電荷的數值,代表了元素價態的高低。
氧化劑:在氧化還原反應中得電子氧化數降低被還原的物質。
還原劑:在氧化還原反應中失電子氧化數升高被氧化的物質。
氧化數法配平基本原則是:反應中氧化劑元素氧化數降低值等於還原劑元素氧化數增加值,或得失電子的總數相等。
用此法配平氧化還原反應方程式的具體步驟是:
1.先找出反應式中氧化數發生變化的元素。
2.標出反應式中氧化數發生變化的元素(氧化劑、還原劑)的氧化數。
3.標出反應式中氧化劑、還原劑氧化數變化值。
4.按最低公倍數即“氧化劑氧化數降低總和等於還原劑氧化數升高總和”原則。在氧化劑和還原劑分子式前面乘上恰當的
係數。
5.配平方程式中兩邊的H和O的個數。
根據介質不同,在酸性介質中O多的一邊加H+,少的一邊加H2O,在鹼性介質中,O多的一邊加H2O,O少的一邊加OH-。在中性介質中,一邊加H2O另一邊加H+或OH-。
6.檢查方程式兩邊是否質量平衡,電荷平衡,元素平衡。
物理配平
簡單的化學方程式是很容易配平的。但是,有機化合物中
原子間一般都以
共價鍵相結合,所以沒有電子得失的問題,在氧化還原反應過程中化合價不發生變化,因此,反應
方程式的配平比較複雜。加之,有機化學反應的特點之一是副反應多,所以在書寫一個有機化學反應方程式時,常常只表示它的
主反應和主要反應產物,因此在
反應物和生成物之間常用“→”號表示,由此對反應方程式的配平也就不象寫無機化學反應方程式那么嚴格要求了。我們在一些有機化學書中常見到的化學反應方程式都不是完全配平的。我們從學習了無機化學反應方程式配平的基礎上,簡單介紹一下有機化合物氧化還原反應方程式的一般配平法。
根據電子得失的個數相等來配平氧化還原反應方程式是無機化合物反應中常用的方法,稱為電子法。在有機化合物的氧化還原反應中較普遍地採用氧化數法來配。
氧化還原反應的配平是正確書寫氧化還原反應方程式的重要步驟,它是高中化學教學中要培養學生的一項基本技能,同時氧化還原反應的配平也一直是高考考查的熱點。考查氧化還原反應配平的試題,一般其難度都不低,因此,掌握較好的解題方法,快速、準確地進行配平是解決這類問題的關鍵。下面介紹兩種簡單、通用、快速、準確的配平方法。
一、電子守恆法
1. 配平原理
發生氧化還原反應時,還原劑失去電子、氧化劑得到電子。因為整個過程的本質好比是還原劑把電子給了氧化劑,在這一失一得之間,電子守恆。故根據還原劑失去電子的數目和氧化劑得到電子的數目相等,結合二者化合價的改變情況,可以分別把氧化劑、還原劑的計量數計算出來,這樣整個氧化還原反應就順利配平了。
2. 方法和步驟
①標出發生變化的元素的化合價,確定氧化劑和還原劑,並確定氧化還原反應的配平方向
在配平時,需要確定先寫方程式那邊物質的計量數。有時先寫出方程式左邊反應物的計量數,有時先寫出方程式右邊生成物的計量數。一般遵循這樣的原則:
自身氧化還原反應→ 先配平生成物的計量數;
部分氧化還原反應 → 先配平生成物的計量數;
一般的氧化還原反應→既可先配平生成物的計量數,也可先配平反應物的計量數。
②列出化合價升降的變化情況。當升高或降低的元素不止一種時,需要根據不同元素的原子個數比,將化合價變化的數值進行疊加。
③根據電子守恆配平化合價變化的物質的計量數。(如A元素降低3價,B元素上升5價,則需找到3與5的最低公倍數15,則有5molA、3molB參與氧化還原)
④根據質量守恆配平剩餘物質的計量數。最終並根據質量守恆檢查配平無誤。
3. 實戰演練
+7 -1 0 +2
⑴ KMnO4+HCl ——Cl2+MnCl2+KCl+H2O
標出化合價,因該反應是部分氧化還原反應,故確定先配平生成物Cl2和MnCl2,同時列出化合價升降情況,配平化合價變化的物質Cl2和MnCl2的計量數。
+7 +2
降低Mn → Mn 5e ×
-1 0
升高Cl → Cl2 2e × 5
所以先配平為 KMnO4+HCl—— 5Cl2+2MnCl2+KCl+H2O
再根據質量守恆配平剩餘的物質,並根據質量守恆檢查配平無誤。最終配平結果為
2KnO4+16HCl ==5Cl2+2MnCl2+2KCl+8H2O
-3 +6 0 +4
⑵ (NH4)2SO4—— NH3+N2+SO2+H2O
標出化合價,因該反應是自身氧化還原反應,故確定先配平生成物N2和SO2 ,同時列出化合價升降的情況,配平化合價變化的物質N2和SO2的計量數。
+6 +4
降低S → S 2e × 3
-3 0
升高N N2 6e × 1
所以方程式先配平為 (NH4)2SO4 ——NH3+1N2+3SO2+H2O
再根據質量守恆配平剩餘的物質,並根據質量守恆檢查配平無誤。最終配平結果為
3(NH4)2SO4 ==4NH3+1N2+3SO2+6H2O
+1-2 +5 +2 +6 +2
⑶ Cu2S+HNO3——Cu(NO3)2+H2SO4+NO+H2O
標出化合價,因該反應是部分氧化還原反應,故確定先配平生成物Cu(NO3)2 、H2SO4和NO,同時列出化合價升降的情況,配平化合價變化的物質Cu(NO3)2 、H2SO4和NO的計量數。(因為Cu和S的化合價均升高,且它們來自於反應物Cu2S,Cu和S的原子個數比為2:1,按此比例疊加化合價變化數目)
+5 +2
降低N N 3e × 10
-2 +6
升高S S
+1 +2 10e × 3
2Cu 2Cu
所以方程式先配平為Cu2S+HNO3 ——6Cu(NO3)2+3H2SO4+10NO+H2O
再根據質量守恆配平剩餘的物質,並根據質量守恆檢查配平無誤。最終配平結果為
3Cu2S+22HNO3 ==6Cu(NO3)2+3H2SO4+10NO+8H2O
〔練一練〕配平下列氧化還原反應方程式。
1. FeS2+O2 ——SO2+Fe2O3
2. Cu+HNO3——Cu(NO3)2+NO+H2O
3. AgNO3—— Ag+NO2+O2
參考答案:
1. 4FeS2+11O2 ==8SO2+2Fe2O3
2. 3Cu+8HNO3==3Cu(NO3)2+2NO+4H2O
3. 2AgNO3== 2Ag+2NO2+O2
二、待定係數法
1. 配平原理
質量守恆定律告訴我們,在發生化學反應時,反應體系的各個物質的每一種元素的原子在反應前後個數相等。通過設出未知數(如x、y、z等均大於零)把所有物質的計量數配平,再根據每一種元素的原子個數前後相等列出方程式,解方程式(組)。計量數有相同的未知數,可以通過約分約掉。
2. 方法和步驟
對於氧化還原反應,先把元素化合價變化較多的物質的計量數用未知數表示出來,再利用質量守恆把其他物質的計量數也配平出來,最終每一個物質的計量數都配平出來後,根據某些元素的守恆,列方程解答。
3. 實戰演練(將以上所列出的方程式一一利用待定係數法配平)
⑴ KMnO4+HCl—— Cl2+MnCl2+KCl+H2O
因為錳元素和氯元素的化合價變化,故將Cl2和MnCl2的計量數配平,分別為x、y,再根據質量守恆將其他物質配平,即配平為
yKMnO4+(3y+2x)HCl==xCl2+yMnCl2+yKCl+4yH2O,最後根據氫元素守恆,列出x和y的關係式:3y+2x=8y,得出2.5y=x,把方程式中的x都換成y,即
yKMnO4+8yHCl==2.5yCl2+yMnCl2+yKCl+4yH2O,將x約掉,並將計量數變為整數,故最終的配平結果為
2KMnO4+16HCl ==5Cl2+2MnCl2+2KCl+8H2O。
⑵ (NH4)2SO4—— NH3+N2+SO2+H2O
因為氮元素和硫元素的化合價變化,故將N2和SO2的計量數配平,分別為x、y,再根據質量守恆將其他物質配平,即配平為y(NH4)2SO4 =(2y-2x)NH3+xN2+ySO2+(y+3x)H2O,最後根據氧元素守恆,列出x和y的關係式:
4y=2y+y+3x,得出3x=y,把方程式中的y都換成x,即3x(NH4)2SO4 =4xNH3+xN2+3xSO2+6xH2O ,將x約掉,故最終的配平結果為
3(NH4)2SO4 =4NH3+N2+3SO2+6H2O。
⑶ Cu2S+HNO3——Cu(NO3)2+H2SO4+NO+H2O
因為氮元素和銅元素、硫元素的化合價變化,故將Cu2S和HNO3的計量數配平,分別為x、y,再根據質量守恆將其他物質配平,即配平為
xCu2S+yHNO3 =2xCu(NO3)2+xH2SO4+(y-4x)NO+(2y-12x)H2O ,最後根據氫元素守恆,列出x和y的關係式:y=2x+4y-24x,得出x=y,把方程式中的y都換成x ,即 xCu2S+xHNO3=2xCu(NO3)2+xH2SO4+xNO+xH2O,
將x約掉,並將計量數變為整數,故最終的配平結果為
3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO+8H2O。
也可將上述反應中第一個反應物設為1,第二個設為X,解起來會更簡便。
氧化數升降法
基本原則
基本步驟
1. 標變價:寫出反應物和生成物的
化學式,標出變價元素的氧化數。
2. 列升降:列出反應前後元素氧化數的升降變化值。
3. 求總數:使氧化數升高和降低的總數相等。
4. 配係數:用觀察的方法配平其他物質的化學計量數,配平後,把單線改成等號。
5. 查守恆:檢查方程式兩邊是否“質量守恆”、“電荷守恆”和“元素守恆”。
在配平時,是先考慮
反應物,還是先考慮生成物,一般有如下規律:
1. 若氧化劑/還原劑中某元素的氧化數全部改變,配平宜從氧化劑、還原劑開始,即先考慮反應物。(正向配平);若氧化劑/還原劑中某元素氧化數只有部分改變,配平宜從
氧化產物、
還原產物開始,即先考慮生成物。(逆向配平)
2. 自身氧化還原反應方程式,宜從生成物開始配平。(逆向配平)
3. 同一反應物中有多種元素變價,可將該物質作為一個整體考慮,即求該物質的一個分子中各變價元素的氧化數升、降值的代數和。
4. 零價法:先令無法用常規方法確定氧化數的物質中各元素均為零價,然後計算出各元素氧化數的升降值,並使元素氧化數升降值相等,最後用觀察法配平其他物質的化學計量數。
5.平均標價法:當同一反應物中的同種元素的原子出現兩次且價態不同時,可將它們同等對待,即假定它們的氧化數相同,根據化合物中氧化數代數和為零的原則予以平均標價,若方程式出現雙原子分子時,有關原子個數要擴大兩倍。
6. 整體標價法:當某一元素的原子或原子團(多見於有機反應配平)在某化合物中有數個時,可將它作為一個整體對待,根據化合物中元素氧化數代數和為零的原則予以整體標價。
強弱判定
1. 物質的氧化性是指物質得電子的能力,還原性是指物質失電子的能力。物質氧化性、還原性的強弱取決於物質得失電子的能力(與得失電子的數量無關)。
2. 從方程式與元素性質的角度,氧化性與還原性的有無與強弱可用以下幾點判定:
(1)從元素所處的價態考慮,可初步分析物質所具備的性質(無法分析其強弱)。最高價態——只有氧化性,如H2SO4、KMnO4中的S、Mn元素;最低價態,只有還原性,如Cl-、S2-等;中間價態——既有氧化性又有還原性,如Fe、S、SO2等。
(2)根據氧化還原的方向判斷:
氧化性:氧化劑>氧化產物;還原性:還原劑>還原產物。
(3)根據反應條件判斷:
當不同的氧化劑與同一種還原劑反應時,如氧化產物中元素的價態相同,可根據反應條件的高、低進行判斷,如是否需要加熱,是否需要酸性條件,濃度大小等等。
53. 需要注意的是,物質的氧化還原性通常與外界環境,其他物質的存在,自身濃度等緊密相關,通過以上比較僅能粗略看出氧化還原性大小。如欲準確定量地比較氧化還原性的大小,需要使用
電極電勢。