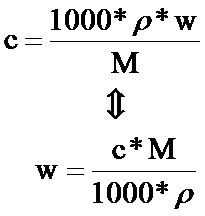基本符號
物質的量——n 物質的質量——m
物質的量(mol)=物質的質量(g)/物質的摩爾質量(g/mol)
以單位體積溶液里所含
溶質B(B表示各種溶質)的物質的量來表示溶液組成的物理量,叫做溶質B的物質的量濃度。
常用單位:mol/L或mol/m3。
氣體的體積V=物質的量(mol)x氣體摩爾體積(Vm)
常數關係
阿伏加德羅常數
N
A以0.012kgC-12(請注意,此處C-12中C-12 是指
原子核內有6個質子和6箇中子的
碳原子)所含的碳原子數作基準,其近似值為6.0221367×10
23mol
-1.1mol的任何物質所含有的該物質的微粒數叫
阿伏伽德羅常數,近似值為N
A=6.0221367×10
23,單位為1/mol。
注意<1>1mol任何微粒的
粒子數為阿伏伽德羅常數,其不因溫度
壓強等條件的改變而改變。
<2>套用阿伏伽德羅定律及理論(在相同的溫度和壓強下,相同體積的任何氣體都含有相同數目的分子)時要滿足:物質在所給溫度及壓強下為氣體
2018年11月16日,國際計量大會通過決議,1摩爾將定義為“精確包含6.02214076×10^23個原子或分子等基本單元的系統的物質的量”。與此同時修改了阿伏伽德羅常數為6.02214076×10^23。
與粒子數的關係
n=N/NA
滿足上述關係的粒子是構成物質的基本粒子(如分子、
原子、離子、
質子、
中子、電子)或它們的特定組合.
如:1molCaCl
2與
阿伏加德羅常數相等的
粒子是CaCl
2粒子,其中Ca
2+為1mol、Cl
-為2mol,陰陽離子之和為3mol或
原子數為3mol.
在使用摩爾表示物質的量時,應該用化學式指明粒子的種類,而不使用該粒子的中文名稱。例如說“1mol氧”,是指1mol
氧原子,還是指1mol氧分子,含義就不明確。又如說“1mol碳原子”,是指1molC-12,還是指1molC-13,含義也不明確。
粒子集體中可以是原子、分子,也可以是離子、質子、中子、電子等。例如:1 mol F,0.5 mol CO2,1k mol CO32-,a mol e-,1.5 mol Na2CO3·10H2O等。
1mol F中約含6.02×10
23個F原子
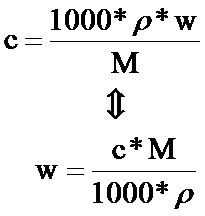
0.5mol CO2中約含0.5×6.02×1023個CO2分子
1k mol CO32-(碳酸根離子)(2-為得到了兩個電子而帶2個單位的負電荷)中約含1000×6.02×1023個CO32-(2-為它顯負電荷)離子
a mol e-中約含a×6.02×1023個e-
1.5 mol Na2CO3·10H2O中約含1.5×6.02×1023個Na2CO3·10H2O,即約含有3×6.02×1023個Na+、1.5×6.02×1023個CO32-、15×6.02×1023個H2O.
摩爾質量
1mol 近似值為6.02×10
23摩爾質量(M) 單位 g/mol (公式M=m/n) 1.定義:單位物質的量的物質所具有的質量(1mol物質的質量)叫
摩爾質量,即1mol該物質所具有相對原子質量與摩爾質量的數值等同。
物質的量(n)、質量(m)、摩爾質量(M)之間的關係為:n=m/M
2.1mol粒子的質量以克為單位時在數值上都與該粒子的
相對原子質量(Ar)或
相對分子質量(Mr)相等。(摩爾質量的數值與式量相同)
ρ關係
W=(C*M)/(1000*ρ)×100%
拓展:C=(1000·w·ρ)/M
相關公式
平均摩爾質量
混合物利用
平均摩爾質量求物質的量之比:平均摩爾質量 =混合物中各組分的摩爾質量×該組分的物質的量分數(若是氣體組分可以是體積分數)。
(M1 M2表示混合物中兩種物質的摩爾質量 M平均 指混合物質的平均摩爾質量)
M1-M平均 n2
—————— = ———
M平均-M2 n1
在台灣被稱為物量