基本介紹
假設
公式
公式的意義
計算方法
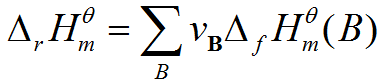
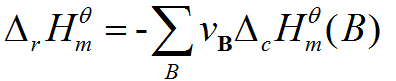



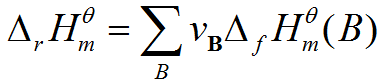
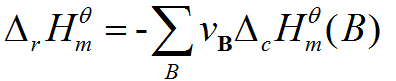
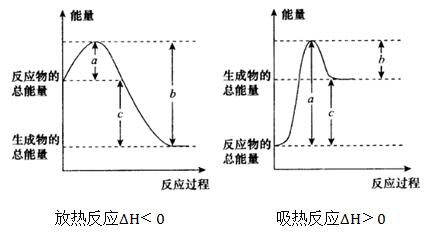
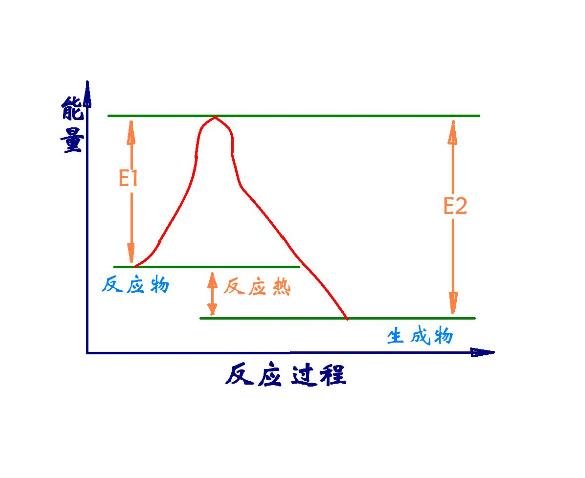
化學反應過程中放出或吸收的熱量叫做化學反應的反應熱。在恆溫、恆壓的條件下,化學反應過程中所吸收或釋放的熱量稱為反應的焓變。其符號記為△H,單位為kJ/mol。規定吸熱反應的焓變大於零,放熱反應的焓變小於零。焓和反應焓變 焓又稱熱函,是熱力學函式之一,也是體系的狀態函式之一。通常用符號“H”表示。焓的...
chemical reaction heat 參見“反應熱效應”。簡稱反應熱,即系統發生化學變化後,使反應產物的溫度回到反應前始態的溫度,系統放出或吸收的熱量。化學反應熱通常有恆容反應熱和恆壓反應熱兩種。反應熱原則上可用兩種實驗方法測定:(1)用量熱計直接測量,例如使反應在絕熱的密閉容器中進行,通過能量衡算便可算出反應...
標準反應熱是指在只有膨脹功的 條件下,由標準狀態的反應物變成標準狀態的產物時化學放應的應熱效應。用 標準反應熱的含義 當發生化學反應時,如果體系不做非體積功,當反應終態的溫度恢復到反應始態溫度時,體系所吸收或放出的熱量,稱為該化學反應的反應熱。熱化學方程式的書寫注意事項 (g) + 1/2 (g)...
等容反應熱(heat of reaction at constant volume)是在等容反應中化學反應放出或吸收的熱。在等容反應中化學反應放出或吸入的熱(始態的和終態的溫度與熱源相同)Qv=∑U(生成物)-∑U(反應物)=△U。等容反應熱(Qₚ)與等壓反應熱(Qv)的關係近似地可以表示如下:Qₚ=Q+p(V₂-V₁)=Qv+△nRT。...
溶液中的反應熱,溶液中化學反應的熱效應。解釋 物質在溶液中可以發生各種不同類型的化學反應,同時產生各種熱效應。水解熱 水解反應是一個重要的化學過程,通常無副反應伴生,甚至室溫下也能很快完成。許多無機物和有機物都能發生水解反應,如鹽類、鹵化物、氫化物、硼的化合物、酸酐、酯類、金屬有機化合物、蛋白質...
《化學反應熱的計算》是凌海二高中提供的微課課程,主講教師是李季。課程簡介 本課簡單介紹蓋斯定律,並從常見題型出發,引導學生怎樣做反應熱的習題,讓學生感覺蓋斯定律的計算更簡單,更便捷!設計思路 首先介紹了蓋斯定律,讓學生對所要運用的原理有個初步的了解,然後帶著學生通過習題來慢慢學會蓋斯定律的運用方法,...
2.物質的氣、液、固三態的變化與反應熱的關係。方程式 書寫 .熱化學反應方程式的書寫 ⑴△H只能寫在標有反應物和生成物狀態的化學方程式的右邊,用“;”隔開。若為放熱反應,△H為“-”;若為吸熱反應,△H為“+”。△H的單位為kJ/mol。⑵反應熱△H與測定條件(如溫度、壓強等)有關。所以書寫熱化學反應...
《蓋斯定律型反應熱的計算》是耒陽市第二中學提供的微課課程,主講教師為黃甲。課程簡介 利用蓋斯定律求算反應熱是高考化學中的必考內容,但學生真正去解答這類試題時,又非常容易出錯。在筆者的教學公眾號MeetChem上收到學生的求助後,製作了該微課,同時在微信教學公眾號上推送、分享教學資源,進行網路教學、答疑,...
標準摩爾反應焓變是指參加反應的各物質都處於標準態時的反應焓變,記為△Hₘ,單位為kJ/mol。計算標準摩爾反應焓變的理論基礎是Hess定律,即在恆容或恆壓條件下,一個化學反應不論是一步完成或分幾步完成,其反應熱(即摩爾反應焓變)完全相同。Hess定律的實質是指出了反應只取決於物質的初、終狀態,而與經歷的...
《化學反應熱動力學理論與方法》是2003年化學工業出版社出版的圖書,作者是曾憲誠。內容介紹 化學反應熱力學是依據自然界一切物理變化、化學變化以及生物代謝過程都伴隨著熱效應,而且反應熱效應(或反應的放熱速)與反應的速率及反應時間等密切相關的規律,通過測定化學反應過程中反應的熱焓變化來確定化學反應的速率和...
除燃燒反應以外的其他化學反應的反應熱測量技術。從歷史和發展的情況來看,反應量熱學測定的是以下反應的反應熱:不飽和烴的加氫反應、鹵化反應和不飽和烴與鹵化氫的加合作用;水解反應;溶解反應;聚合反應;配位化合物的生成反應。反應熱的測定,除了可為化工生產提供必要的設計數據外,還可用來計算反應中的某一...
《利用蓋斯定律計算反應熱》是西安市第八十五中學提供的微課課程,主講教師是馮越。課程簡介 這節微課套用了PPT.及Camtasia Studio軟體製作。時間6分58秒,25.1MB。 從爬山途徑與高度有沒有關係引入反應熱與反應途徑是否有關引入課題,用圖示法介紹蓋斯定律的主要內容,直觀清楚。隨後通過兩個例題總結利用蓋斯定律計算...
自熱反應 autothermal reaction 利用反應熱把原料加熱到反應溫度來發生的化學反應。化學反應需達到一定溫度才能明顯發生。一般需將冷的原料加熱至一定的反應溫度。許多化學反應都是放熱反應。對於在反應中能放出大量反應熱的過程,往往把反應器設計成使冷原料與反應物有換熱的結構,以利於發生自熱反應。
幫助學生達成以下目標 1、了解化學反應中能量轉化的原因和常見的能量轉化形式; 2、認識化學反應過程中同時存在著物質和能量的關係 ; 3、了解反應熱和焓變的含義 4、認識熱化學方程式的意義並能正確書寫熱化學方程式 設計思路 一、複習預習 1能量的釋放或吸收是以發生變化的物質為基礎,二者密不可分。 2學反應的...
標準摩爾反應焓變是指參加反應的各物質都處於標準態時的反應焓變,記為 ,單位為kJ/mol。計算標準摩爾反應焓變的理論基礎是Hess定律,即在恆容或恆壓條件下,一個化學反應不論是一步完成或分幾步完成,其反應熱(即摩爾反應焓變)完全相同。Hess定律的實質是指出了反應只取決於物質的初、終狀態,而與經歷的具體...
《化工工藝反應熱風險特徵數據計算方法》是2020年08月01日實施的一項行業標準。起草人 徐偉、石寧、楊哲、費軼、張帆、孫峰、黃飛、王振剛、孫冰、於風清、陳利平、馮俊傑、張玉霞。起草單位 中國石油化工股份有限公司青島安全工程研究院、國家應急管理部化學品登記中心、南京理工大學。適用範圍 本標準宜套用於符合阿倫...
《利用狀態速比反應熱大小》是西安市第八十五中學提供的微課課程,主講老師是馮越。知識點 高中 化學 1.六.化學反應與能量/1.化學反應與熱能/F.反應熱、焓變的概念及反應過程中能量變化與放熱、吸熱的關係 設計思路 1、畫面精緻,學科性強。 2、知識結構合理,方法獨特。 3、音效合適,學習更有興趣。
摩爾反應熱 摩爾反應熱(molar reaction heat)是1998年發布的電氣工程名詞。公布時間 1998年經全國科學技術名詞審定委員會審定發布。出處 《電氣工程名詞》第一版。
標準反應焓 標準反應焓(standard enthalpy of reaction)是2019年發布的物理學名詞。公布時間 2019年經全國科學技術名詞審定委員會審定發布。出處 《物理學名詞》第三版。
這些不需要外力作用,便可自發進行的過程稱為自發過程(化學過程稱為自發反應)定義 反應方向(reaction direction)是指反應物和生成物均處於標準態時反應進行的方向。影響因素 焓變 化學反應中所吸收或放出的能量有多種形式:熱能、光能、聲能和電能等。其中所吸收或放出的熱量稱為反應熱(或熱效應)。眾所周知,反應...
在恆溫恆壓的條件下,化學反應過程中吸收或放出的熱量稱為反應熱,用ΔH表示,單位kJ·mol 概念 ΔH是化學反應焓變,焓是物體的一個熱力學能狀態函式,焓變即物體焓的變化量 公式 ΔH=ΔU+pΔV,ΔH在等壓且只做體積功條件下 ΔH=Q 焓的物理意義可以理解為恆壓和體積功為零的特殊條件下,Q=ΔH,即...
熱效應(Thermal effects)是指在一定溫度下,體系在變化過程中放出或吸收的熱量。隨著變化性質的不同,有燃燒熱、溶解熱、稀釋熱、生成熱、中和熱等。化學反應中的熱效應又稱反應熱,熱效應數據廣泛套用於科學研究和工業生產方面。熱效應概述 簡述 一切化學反應實際上都是原子或原子團的重新排列組合,在舊鍵破裂和...
若系統在變化過程中保持體積恆定,此時的反應熱稱為定容熱,用符號Q表示。定義 當只做體積功的化學反應在密封的容器中進行時,反應體系的體積不變,即體積變化量為零(ΔV=0),所以體積功也為零(W=-pΔV=0)。依照熱力學第一定律,此時體系的熱力學能ΔU變化:ΔU=Q+W=Q-pΔV=Q 上式中:Q為定容熱,...
焓變是生成物與反應物的焓值差。作為一個描述系統狀態的狀態函式,焓沒有明確的物理意義。ΔH(焓變)表示的是系統發生一個過程的焓的增量。ΔH=ΔU+Δ(pV)在恆壓條件下,ΔH(焓變)數值上等於恆壓反應熱。焓變是制約化學反應能否發生的重要因素之一,另一個是熵變。熵增焓減,反應自發;熵減焓增,反應逆向...
化學熱儲存是將化學反應熱通過化學物質儲存起來,吸熱反應儲存能量,其逆反應放出能量。基本任務 能量儲存的基本任務就是克服能量供應和需求之間的時間性或地域性的差別。這種差別是由於能量需求突然變化(如季節變化造成的用能高峰變化)和一次能源與能源轉換裝置之類的原因造成的。原理 將化學反應熱通過化學物質儲存起來...
分解熱是指在一定溫度和壓力下,摩爾化合物全部分解時所吸的熱,即此分解反應的反應熱。例如298.15開(25℃)、101.325千帕(1大氣壓)下氨氣的分解熱為46.19千焦/摩。簡介 由於焦煤資源日益短缺,煉焦工序污染嚴重以及昂貴的焦炭價格,高爐大量以煤代焦煉鐵,有重大經濟效益和社會效益。高爐富氧與噴煤有良好的...
玻恩-哈伯循環是一種用於計算反應熱的方法,由德國科學家馬克斯·玻恩和弗里茨·哈伯發明。有時反應熱很難或甚至無法直接測出,但根據赫斯定律,反應熱的大小與反應物及生成物的初狀態與末狀態有關,與反應的途徑無關,因此如果能夠測出各個反應途徑的反應熱,那么原反應的反應熱也就可以計算出來了。簡介 玻恩-哈伯...
