能量變化
熱變

⑴燃燒熱:在101kPa時,1mol可燃物
完全燃燒生成穩定的氧化物時所放出的熱量。
2.物質的氣、液、固三態的變化與反應熱的關係。
方程式
書寫
⑴△H只能寫在標有反應物和生成物狀態的
化學方程式的右邊,用“;”隔開。若為
放熱反應,△H為“-”;若為
吸熱反應,△H為“+”。△H的單位為kJ/mol。
⑵
反應熱△H與測定條件(如溫度、
壓強等)有關。所以書寫
熱化學反應方程式的時候,應該注意標明△H的測定條件。
⑶必須標註物質的聚集狀態(s(固體)、l(液體)、g(氣體)溶液(aq)才能完整的書寫出熱化學反應方程式的意義。方程式中不用“↑”、“↓”、“→”這些符號,而用"="來表示。
蓋斯定律
化學反應的
反應熱只與反應的初始狀態有關和終極狀態有關,而與反應的途徑無關。
測定
實驗目的
H+OH=H20 ΔH中和=一57.36kJ·mol
上式可作為
強酸與強鹼中和反應的通式的的的。由此還可以看出,這一類中和反應與酸的
陰離子或鹼的
陽離子並無關係。
若以
強鹼(NaOH)中和
弱酸(CH3COOH)時,則與上述強酸、強鹼的
中和反應不同。因為在中和反應之前,首先是弱酸進行解離,其反應為:
CH3COOH =H+CH3COOΔH解離
H+OH=H20 ΔH中和
總反應:CH3COOH+OH=H20+CH3COO ΔH
由此可見,ΔH是弱酸與強鹼中和反應總的
熱效應,它包括
中和熱和解離熱兩部分。根據
蓋斯定律可知,如果測得這一反應中的熱效應ΔH以及ΔH中和,就可以通過計算求出弱酸的
解離熱ΔH解離。
儀器試劑
數字式
貝克曼溫度計; 杜瓦瓶; 量筒; 秒表; 雙路可跟蹤直流穩定電源; 濃度各為1.0mol的NaOH、HCI和CH3COOH溶液。
操作步驟
1、實驗準備
清洗儀器。打開數字式
貝克曼溫度計,預熱5分鐘。調節基溫選擇按鈕至20~C,按下溫度/溫差按鍵,使錶盤顯示溫差讀數(精確至0.001℃)。打開直流穩壓電源,調節電壓10.0V。連線穩壓直流電源與量熱計。
2.量熱計常數的測定
用量筒量取500ml蒸餾水注入用淨布或濾紙擦淨的杜瓦瓶中,輕輕塞緊瓶塞。接通電源,調節旋鈕記下10.0V時電流讀數。均勻攪拌4分鐘。然後,切斷電源,每分鐘記錄一次貝克曼溫度計的讀數,記錄10分鐘。讀第10個數的同時,接通電源,並連續記錄溫度。在通電過程中,電流、電壓必須保持恆定(隨時觀察電流表與電壓表,若有變化必須馬上調節到原來指定值)。記錄電流、電壓值。通電4分鐘後,停止通電。繼續攪拌及每隔一分鐘記錄一次水溫,測量10分鐘為止。用作圖法確定由通電而引起的溫度變化ΔT1。按上述操作方法重複兩次,取其平均值。
取50ml 1mol.lNaOH溶液注入鹼貯存器中。用量筒量取400ml蒸餾水注入用淨布或濾紙擦掙的杜瓦瓶中,然後加入50ml 1mol.lHCl溶液。輕輕塞緊瓶塞,用攪拌器均勻攪拌,並記錄溫度(每分鐘一次)。計10個數後,將鹼貯存器稍稍提起,用玻璃棒將膠塞捅掉(不要用力過猛,以免玻璃棒碰破杜瓦瓶之內壁而損害儀器)。捅掉膠塞後,即將鹼貯存器上下移動兩次,使鹼液全部流出。此後不斷攪拌,並繼續每隔一分鐘記錄一次溫度。待溫度變化緩慢後,再記錄10分鐘就停止測定。用作圖法確定ΔT2。按上述方法重複兩次,取其平均值。
用CH3COOH代替HCI,重複上述操作,求ΔT3。
5.實驗結束
斷水、斷電,清洗儀器,清理實驗桌。
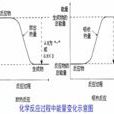
1.溫度變化的校正一雷諾曲線法
圖中凸點相當於開始通電加熱或開始反
應之點,c點為觀察到的最高溫度讀數
點,由於杜瓦瓶和外界的熱量交換,曲
線ab及cd經常發生傾斜。EE'表示環境
輻射進來的熱量所造成量熱計溫度的升
高,必須扣除。FF'表示量熱計向環境輻
射出熱量而造成量熱計溫度的降低,必
須加入。因此作圖確定出ΔT1、ΔT2、ΔT3
注意:此法校正時,體系溫度與外界溫度最好不超過2~3℃,否則會引進誤差。
2.量熱計常數的計算
由實驗可知,通電所產生的熱量使量熱計溫度上升ΔT1,由焦耳一
楞次定律可得:
Q=UIt=KΔT1。
式中:Q為通電所產生的熱量(J):I為電流強度(A):U為電壓(V):t為通電時間(s);ΔT1為通電使溫度升高的數值(℃);K為量熱計常數其
物理意義是量熱計每升高1℃所需之熱量。它是由杜瓦瓶以及其中儀器和試劑的質量和比熱所決定的。當使用某一固定量熱計時,K為常數。由上式可得: K=UIt/ΔT1(
平均值)代入上式,求出量熱計常數K。
反應的
摩爾熱效應可表示為:ΔH =-KΔT×1000/cV
式中:c為溶液的濃度:V為溶液的體積(mL): ΔT為體系的溫度升高值。
利用上式,將K及ΔT2及ΔT3(平均值)代入,分別求出強酸、
弱酸與強鹼
中和反應的摩爾熱效應ΔH中和和ΔH。利用
蓋斯定律求出弱酸分子的摩爾離解熱ΔH解離,即:
ΔH解離=ΔH-ΔH中和
吸放過程
吸熱反應
②弱電解質的電離
N2+O2=
放電=2NO CO2+C=高溫=2CO
C(s)+H2O(g)=高溫=CO↑(g)+H2↑(g)(水煤氣) CuO(s)+H2(g)=高溫=Cu(s)+H2O(g)
⑥Ba(OH)2·8H2O晶體與NH4Cl晶體的反應
放熱反應
⒉常見放熱反應
①燃燒
③金屬與酸或水的反應
重點討論的三個平衡:N2、H2合成NH3、SO2催化氧化生成SO3、NO2二聚為N2O4均為放熱反應
⑧大多數氧化