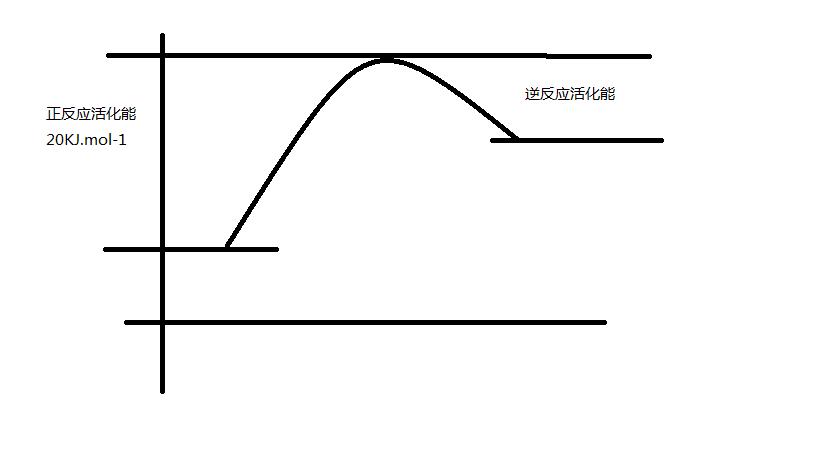
簡介
例如:C+H
2O=(高溫)CO+H
2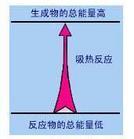 吸熱反應示意圖
吸熱反應示意圖分解反應一般為吸熱反應,如2NaHCO
3→(加熱)Na
2CO
3+H
2O+CO
2↑。
注意:不是需要加熱的反應都是吸熱反應,燃燒大多數要“
點燃”,都是
放熱反應。
吸熱反應就是在
化學變化中,需要不斷吸收大量熱量的反應。
不是所有需要使用催化劑的反應都是吸熱反應。C+CO2=(高溫)2CO是吸熱反應。
有些反應在開始時,需要提供一定的條件,如加熱、點燃等,一旦反應進行開了,去掉條件反應繼續進行,這樣的反應是
放熱反應。
有時根據需要,在
化學反應方程式的右側標明是吸熱還是放熱,通常是+Q吸熱,-Q是放熱
常見吸熱反應類型
(1)大多數分解反應:
CaCO
3=(高溫)CaO+CO
2↑
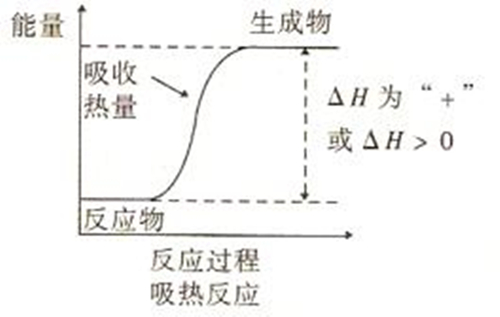 吸熱反應的反應物與生成物的總能量相對大小
吸熱反應的反應物與生成物的總能量相對大小CuSO4·5H2O=CuSO4+5H2O
(2)鹽水解反應
(3)電離
(4)少數化合反應
C(s)+CO2(g)=(高溫)2CO
I
2+H
2=2HI(此反應為可逆反應,因為生成的
碘化氫不穩定)
(5)其它:
2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O
C+H2O(g)=(高溫)CO+H2
易錯點
解釋:判斷反應熱效應的兩個標準是實驗實測以及通過熱力學進行計算,而C、H2、CO還原很多情況都是放熱反應,如以下實例:
反應1:CuO(s)+H2(g)=Cu(cr)+H2O(g)
反應2:CuO(s)+CO(g)=Cu(cr)+CO2(g)
反應3:CuO(s)+(石墨)=Cu(cr)+CO2(g)
計算化學反應熱效應可以直接使用ΔH,此處忽略溫度對ΔH的影響。
相應物質標準生成焓:(單位:kJ/mol)
分子式 | 標準生成焓 |
H2O(g) | -241.82 |
C(石墨) | 0.00 |
H2(g) | 0.00 |
CO(g) | -110.53 |
CO2(g) | -393.51 |
Cu(s) | 0.00 |
CuO(cr) | -157.30 |
數據代入計算可知:
ΔH1=0+(-241.818)-(-157.3)-(0)=-84.518<0,即反應放熱;
ΔH2=0+(-393.509)-(-110.525)-(-157.3)=-125.684<0,即反應放熱;
ΔH3=-393.509+0-(-157.3)-0=-236.209<0,即反應放熱;
綜上可證這三個反應都是放熱反應,即本詞條原有的,網路上充斥的所謂“C,H2,CO做還原劑的反應(吸熱)”等所謂的“知識總結”實質是錯誤的。
 吸熱反應示意圖
吸熱反應示意圖 吸熱反應的反應物與生成物的總能量相對大小
吸熱反應的反應物與生成物的總能量相對大小