基本介紹
- 中文名:反應焓變
- 外文名:reaction enthalpies
- 意義:反應中所吸收或釋放的熱量
- 數值:吸熱反應>0,放熱反應<0
焓和反應焓變
相關定義
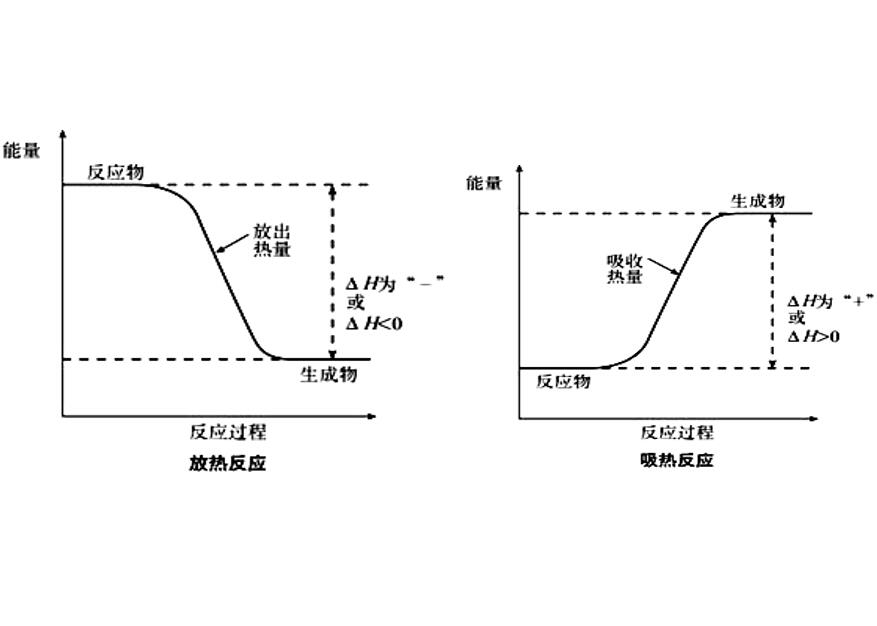
放熱反應和吸熱反應
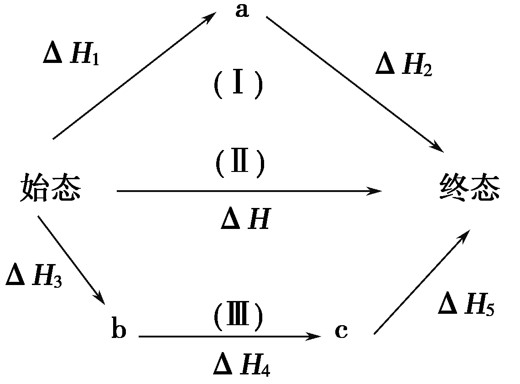
蓋斯定律
反應焓變的計算
計算依據
套用技巧
常用計算方法
計算時應注意的問題
蓋斯定律的套用
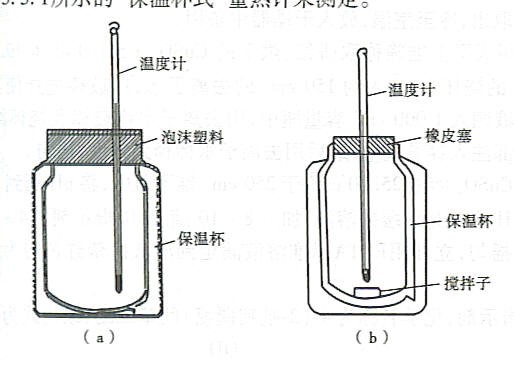
反應焓變的測定






化學反應過程中放出或吸收的熱量叫做化學反應的反應熱。在恆溫、恆壓的條件下,化學反應過程中所吸收或釋放的熱量稱為反應的焓變。其符號記為△H,單位為kJ/mol。規定吸熱反應的焓變大於零,放熱反應的焓變小於零。焓和反應焓變焓...
(1) 恆容反應焓:恆溫、恆容、非體積功為零時反應的焓變稱為恆容反應焓。(2) 恆壓反應焓:恆溫恆壓、非體積功為零時反應分焓變稱為恆壓反應焓。測定 背景:量熱學的發展, 已經由測量燃燒焓(氧彈:待測有機物在充滿氧氣的...
焓變是生成物與反應物的焓值差。作為一個描述系統狀態的狀態函式,焓沒有明確的物理意義。ΔH(焓變)表示的是系統發生一個過程的焓的增量。ΔH=ΔU+Δ(pV)在恆壓條件下,ΔH(焓變)數值上等於恆壓反應熱。焓變是制約化學反應能否...
通過計算反應的焓變,可以預測反應的能量變化和反應方向,為化學反應的設計和控制提供依據。在工程設計中,比焓常與其他熱力狀態參數,如壓力、比熵(見熵)等組成各種圖或表,利用圖表的計算設計方法具有廣泛的用途。例如,在空調系統中,...
標準摩爾反應焓變是指參加反應的各物質都處於標準態時的反應焓變,記為△Hₘ,單位為kJ/mol。計算標準摩爾反應焓變的理論基礎是Hess定律,即在恆容或恆壓條件下,一個化學反應不論是一步完成或分幾步完成,其反應熱(即摩爾反應焓變...
在標準壓力(100kPa)下,在進行反應的溫度時,由最穩定的單質合成標準 壓力p下單位量物質B的反應焓變,叫做物質B的標準摩爾生成焓,用符號△Hₘ表示。定義 在標準壓力(100kPa)下,在進行反應的溫度時,由最穩定的單質合成標準 壓...
標準摩爾燃燒焓是指一摩爾物質在標準狀況下完全燃燒時的反應焓變,用符號ΔHₘ表示,其中下標“c”表示燃燒(combustion),其單位為kJ/mol(又作kJ·mol)。如標準狀況下,甲烷完全燃燒時的反應式如下:CH₄(g) + 2 O₂(g) ...
假設,存在一個系統。通過計算得出反應前後系統的焓變為ΔH。如果ΔH 計算為負值,則反應必為放熱反應。比如:燃燒就是燃料與空氣中氧氣劇烈反應放出熱量。如果ΔH 計算是正值,則反應必為吸熱反應。比如:石灰石在高溫下反應分解出氧化...
而一般化學反應中,舊鍵的斷裂所吸收的總能量與新鍵形成所放出的總能量是不相等的,而這個差值就是反應中能量的變化。所以化學反應過程中會有能量的變 二、知識講解 考點1:反應熱 焓變 1、定義:恆壓條件下,反應的熱效應等於焓變 ...
計算標準反應焓 對任一化學反應,利用各種反應物和生成物的標準摩爾生成焓變的數據,就可以求得該反應的標準摩爾反應焓變 。物質的標準摩爾生成焓變的數值可從各種化學、化工手冊或熱力學數據手冊中查到。可以通過設定路徑來計算反應的...
嚴格的標準熱化學方程式格式: H2(g)+1/2O2(g)==H2O(l) ΔrHθm=-286kJ·mol-1(θ表示標準態,r表示反應,m表示1mol反應.含義為標準態下進行一摩爾反應的焓變)我們構想在同一溫度下發生同上的1mol反應:2H2(g)+O2(g)=2H2O...
例如,人體內進行的一系列反應,基本上是恆溫恆壓反應。恆壓反應的反應熱在數值上等於反應焓變。對於反應焓變,可作如下理解:反應的吸熱或放熱表明,反應物和產物各自有不同的“焓”(H),當反應物的焓比產物的焓高(多)時,由反應...
但實驗事實告訴我們,反應焓變隨溫度的變化並不太大,當溫度相差不大時,可近似地看作反應焓不隨溫度變,以下內容只作這種近似處理,不考慮焓變隨溫度的變化。實驗和熱力學理論都可以證明:反應在不同壓力下發生,焓變不同!但當壓力...
共價電子從高能級向低能級躍遷,釋放能量,而舊鍵的斷裂則需要吸收能量,所以最終化學反應是吸熱還是放熱看的是反應前後能量變化差值,如果能量不足,則需要從外界吸熱,反之放熱,通常我們用焓變(△H)來衡量反應前後的熱現象.
標準反應焓 標準反應焓(standard enthalpy of reaction)是2019年發布的物理學名詞。公布時間 2019年經全國科學技術名詞審定委員會審定發布。出處 《物理學名詞》第三版。
ΔH是化學反應焓變,焓是物體的一個熱力學能狀態函式,焓變即物體焓的變化量 公式 ΔH=ΔU+pΔV,ΔH在等壓且只做體積功條件下 ΔH=Q 焓的物理意義可以理解為恆壓和體積功為零的特殊條件下,Q=ΔH,即反應的熱量變化。因為...
(13)在SI單位制中,標準壓力應為101.3kPa,但是這個數字使用不太方便,國際純粹與套用化學聯合會(IUPAC)建議以1x10⁵Pa作為氣態物質的熱力學標誌狀態,符號為p,若壓力不為p,反應焓變符號為△Hₘ。(14)中學化學課本將△H...
C和O2的反應不可能控制在CO而無CO₂生成的程度,因此無法通過實驗測定這樣反應的反應熱。然而根據蓋斯定律,利用C和CO的燃燒熱,很容易計算生成CO反應的焓變。定律影響 儘管蓋斯定律是出現在熱力學第一定律提出前的經驗定律,但亦可通過...
甲烷與氨和氧氣在鉑催化下,生成氰化氫和水的反應。原理 甲烷與氨和氧氣在鉑催化下,生成氰化氫和水的反應:2CH₄+2NH₃+3O₂=2HCN+6H₂O 特點 反應劇烈放熱,反應焓變 -481.06 kJ. 存在多個副反應:CH₄ + H₂O ...
如果假設反應焓變在不同溫度下保持恆定,則在不同溫度 T₁和 T₂下,等式的定積分為 這裡 K₁是在絕對溫度T₁下的平衡常數, K₂是在絕對溫度T₂下的平衡常數。 ΔH是標準焓變,R 是氣體常數。推導 由 和 得到 因此,...
當反應進度ξ=1mol,即反應按所給反應式的計量係數比例進行時,則ΔrH=ΔrUm,稱“摩爾反應熱力學能變”,而ΔrH=ΔrHm,稱“摩爾反應焓變”,其中下標符號γ意反應,m示摩爾,量綱單位為J·mol-1。現以A、D代表反應物而G、H...
對於等溫下的化學反應,若反應吸熱,產物的焓高於反應物的焓;若反應放熱,產物的焓應低於反應物的焓。焓變 焓是與內能有關的物理量,反應在一定條件下是吸熱還是放熱由生成物和反應物的焓值差即焓變(△H)決定。在化學反應過程中所...
此式表明,溫度對平衡常數的影響與反應的焓變的正負號是有關的,對於吸熱反應,反應焓為正值,溫度升高,平衡常數增大,對於放熱反應,反應焓為負值,溫度升高,平衡常數減小。下面是兩個具體反應的例子:從熱力學數據表中可查獲,氮氣和...
在這種情況下,在將滴定劑加入滴定液的過程中,有可能發生一個或多個反應。各個反應進行的程度和產生的熱效應與該反應的平衡常數K和反應的焓變有關。把熱效應、K和ΔH聯繫起來的公式一般是複雜的。如果容器中總共包含n個反應,則這些...
1902年T.W.理查茲在研究電池的電動勢隨溫度變化的關係時發現,溫度越低,電池反應的摩爾焓變ΔHm與摩爾吉布斯函式變ΔGm越接近。德國物理化學家W.H.能斯脫在理查茲工作的基礎上進一步研究了低溫下凝聚物系的反應。定義 表述為在接近絕對...
一般地,化學物質在氣相中與H⁺結合是放熱反應,為了使用方便,將質子親和能規定為正值,即PA = -ΔH;例如,乙烯與H⁺結合形成乙基正離子的氣相反應焓變為-162.8 kcal/mol,則乙烯的質子親和能就等於162.8 kcal/mol。C₂H...
