基本介紹
- 中文名:標準生成焓變化
- 外文名:Change of standard enthalpy
- 學科:無機化學
- 定義:標準狀態下化合物的生成熱
- 簡稱:標準生成熱
定義

性質
套用
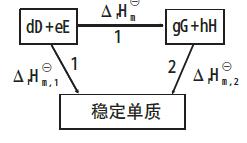
計算標準反應焓






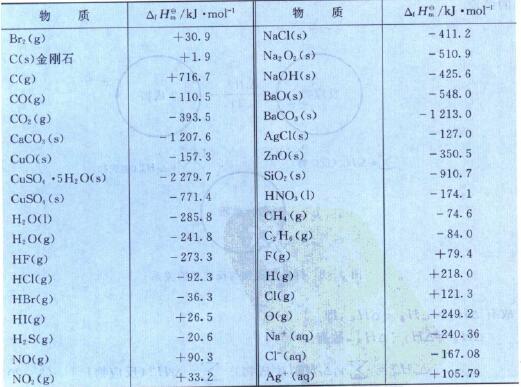
常見物質的標準生成焓









在標準狀態即壓力為100kPa,一定溫度(一般是298.15K)下時,由元素最穩定的單質生成生成1mol純化合物時的熱效應稱為該化合物的生成熱。定溫定壓下的熱效應等於焓變,所以定溫定壓下的生成熱就等於焓變,簡稱為生成焓。...
1、標準摩爾生成焓在使用時必須註明溫度,通常為298.15K。2、一個化合物的標準摩爾生成焓並不是這個化合物的焓的絕對值,它是相對於合成它的單質的相對焓變。最穩定的單質的標準摩爾生成焓為零。3、除了NO、NO₂、C₂H₂(g)...
即一定溫度下,化學反應的標準摩爾反應焓變,等於同溫度下產物的標準摩爾生成焓之和減去反應物的標準摩爾生成焓之和。利用標準摩爾燃燒焓計算 有機物難於直接從單質合成,其標準摩爾生成焓數據難以得到,但有機物容易燃燒,可利用燃燒焓的...
標準生成焓 由標準狀態(壓力為100kPa,溫度TK)下最穩定單質生成標準狀態下單位物質的量的化合物的熱效應或焓變(△H)稱為該化合物的標準生成熱(或焓),以符號△fH表示。最穩定的單質的標準生成熱規定為零。(摩爾的話那么就在規定...
焓是內能和體積的勒讓德變換。它是SpN總合的熱勢能。標準摩爾生成焓 標準摩爾生成焓,也稱標準生成焓(Standard enthalpy of formation)、標準生成熱(Standard heat of formation),符號為 ΔHₘ或 ΔH,單位為kJ/mol(又作 ),...
1.單質的標準摩爾生成焓為零。根據定義,由穩定單質生成穩定單質,也就是由自己生成自己,沒有發生變化,所以焓變為0,因此穩定單質的標準摩爾生成自由能為零。穩定單質大體包括(標態):全部金屬單質、惰性氣體單質、第二周期元素常見...
標準自由能變化與焓類似,物質的自由能無法測定。能夠測定的只是過程的自由能變化。在熱力學中,規定在1大氣壓和一定溫度下,穩定單質的自由能為零。這樣,與標準生成焓類似,在1大氣壓和一定溫度(通常用298K)下,由穩定單質生成1摩爾...
標準摩爾生成焓()定義:在一定的溫度(通常是 298.15K) 時,標準狀態下由指定元素的最穩定單質生成 1mol 某物質時的焓變稱為該物質的標準摩爾生成焓,簡稱標準生成焓。標準摩爾熵 化學反應的方向與兩個因素有關,一是能量因素,二是...
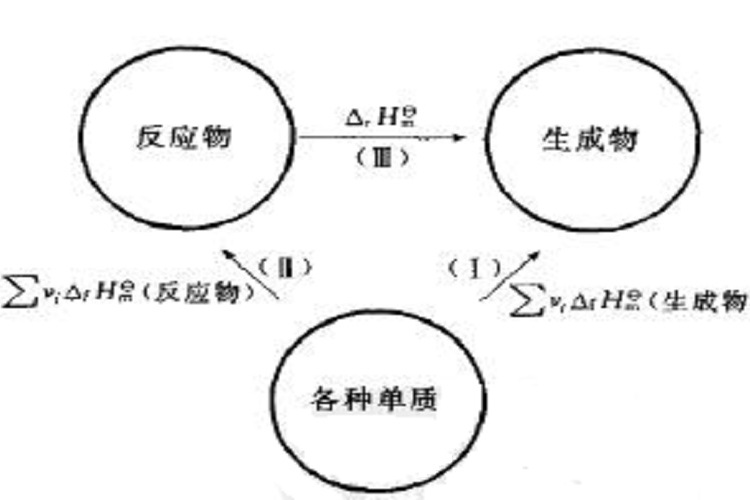
7.根據反應物和生成物的標準摩爾生成焓來計算 對於一定溫度,標準壓力下的反應"0=ΣBVBRB"(這是一種把反應物通過移項變號移動到等號右邊的寫法,在這種寫法中,反應物的係數為負,VB是反應物或生成物RB的化學計量數,ΣB表示對所有...
