簡史
1922年P.迪圖瓦和E.格羅貝特建立熱滴定法,用於
容量分析。1924年P.M.迪安和O.O.瓦茨最早使用測溫滴定這一術語;以後又有人採用熱滴定、焓滴定、測溫焓滴定、量熱滴定和測溫滴定等術語,至今仍未統一。
70年代以來,由於與滴定量熱計相關的一些技術(如恆溫浴、恆速滴定裝置、
反應容器、溫度感測電路以及
數據分析手段等)獲得迅速發展,連續
滴定法結果的精度已可與常用溶液
量熱計比美,而且能夠滴定少於毫克級的試樣。因此熱滴定不僅可用於分析目的,而且已成為一種精密
量熱技術。滴定量熱法特別適用於下述目的:在有
連串反應或並行反應存在的情況下,測定
焓變ΔH;用於包含微弱相互作用物種的反應,求
吉布斯函式改變ΔG;鑒
別絡合反應中存在的物種等。還用於測定
混合熱、物質在兩相中的
分配係數和
吸附容量等,並可用於生物化學、微生物學和環境化學等方面。
裝置
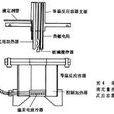
圖1為滴定量熱計框圖。
滴定管內含有一種反應物的滴定劑,可加入到
反應容器內,
滴定劑的濃度一般為被
滴定液的數十倍甚至一百倍左右。反應產生的溫度變化由溫度感測器(例如
熱敏電阻)感知,通過
惠斯通電橋電路轉換為相應的伏特數或
熱功率。這個伏特數由
放大電路放大並記錄於記錄儀上,或者饋入其他的
數據採集系統。反應容器和滴定管置於同一恆溫浴中,恆溫浴溫度由溫度控制器控制,並由溫度感測器測量。滴定劑和反應容器的溫度必須相等,或者它們之間的溫差必須精確知道。
滴定劑的加入方式 ①連續加入法:滴定劑以恆速加入,可以得到滴定進程中熱效應的完整記錄。對於特別複雜的反應,可以從這種記錄圖中選擇任意數目的數據點,用於必要的計算。連續
滴定法要求對溫度變化的回響必須夠快,並且此法只適用於
快速反應。②分次遞增加入法:間歇地每次加入單位增量的滴定劑,在每次加入單位增量前,必須調節反應容器的溫度,使回復到起始溫度,通過加入許多次增量,也能夠得到足夠的測量數據,從而繪製成與連續法相似的圖線。不過,它比連續法的工作量要大一些。遞增法的好處是可以精確研究
動力學上較慢的反應。③連續流動量焓法:使兩種溶液各自以恆速連續流過一個混合(測量)容器。此法的優點是反應物於不存在氣相情況下混合,這對於測量揮發性液體體系非常重要,並且可以忽略表面吸附效應。該法特別適用於研究複雜的生物化學和微生物學過程。此外,此法的裝置可以連線在生產線中進行分析而達到過程控制的目的。
類型
①環境等溫式:將
反應容器浸沒於恆溫浴中,連續監測反應容器內溫度隨著滴定劑加入量的變化;②等溫式:實驗中維持反應容器和器內物(即體系)的溫度恆定,並且嚴格等於其環境的溫度,同時監測流過反應容器的熱量變化。在滴定中,熱量變化僅僅來源於容器內滴定劑與被滴定物的物理或化學變化。等溫法比環境等溫法優異之處是不需要進行體系與環境之間的
熱交換改正。
滴定量熱法包含這樣的假定,即測得的數據表示
量熱計系統既達到了
熱平衡,也達到
化學平衡的結果。當然,實際上達到精確的熱平衡是十分困難的。目前環境等溫式
滴定反應容器已可達到的熱平衡時間約為2秒;等溫式的容器情況更好。環境等溫式滴定量熱計
反應容器的設計,應該使其與環境之間的熱交換為最小。圖2是一種典型的滴定反應容器。由於
杜瓦容器的玻璃內壁很薄,其內部各部件(攪拌器、
熱敏電阻、加熱器等)的質量都很小,所以這種設計有利於迅速建立熱平衡。
右圖為一種等溫滴定量熱計框圖。這種方法的原理可以簡單地歸結為:用
溫差電致冷器恆速冷卻,而用一個可調加熱器的
焦耳熱進行補償調節。對於放熱反應,反應的
熱功率q等於以熱功率表示的致冷量qc與焦耳熱的熱功率qh之差;對於
吸熱反應,則q為qh與qc之差。實驗中qc的數值始終維持不變,而qh的大小則視是吸熱或放熱反應以及
反應熱功率q的大小而不斷調節。因此,qh的變化也就是q的變化值。
利用這種方法,可使體系中附加熱效應(如
攪拌熱、
熱敏電阻自熱)預先得到抵消。即在加入滴定劑的過程中,調節qh的大小,使得反應熱效應得到補償。實驗過程中,始終維持體系與環境溫度嚴格相等。目前這種型式的
量熱計中,
反應容器的溫差不超過5×10-6℃。這種量熱計的基本結構如圖4所示。
測溫
滴定法 是以
反應熱為基礎的滴定方法,用於分析化學時,熱效應的利用可分為兩種方式:①測溫焓滴定,即利用反應熱確定反應終點。在滴定過程中,試樣的溫度作為加入滴定劑體積的函式進行測量。②直接注射法測焓技術,根據反應熱確定滴定劑的加入量,即把滴定過程的總熱量與該反應的已知摩爾熱進行比較。測溫滴定法已經得到普遍套用。無論是
酸鹼滴定法、
沉澱滴定法、
氧化還原滴定法或者
絡合滴定法,只要能觀測到足夠的溫度升高,都可以套用。另外,測溫滴定的
動力學特性也值得重視。例如,當混合物中的兩個組分與滴定劑的反應速率相差很大時,就有可能逐次把兩個組分滴定出來;又如,一個有催化劑與一個無催化劑的體系,滴定時是有差異的,這種差異也可資利用。 圖5為放熱反應的理想
滴定曲線。E為
滴定終點,DD′為溫度升高。在實際過程中,滴定曲線在終點附近往往會出現彎曲的現象,如圖6所示。引起彎曲的原因有二:一是反應的
平衡常數K值小(K<104),反應不完全;二是這種彎曲也可由緩慢反應引起。如果終點區變彎只是由於K值小而引起的,則為了得到滴定終點,可將曲線外延(圖6b)。不過,當外延部分超過反應區的一半時,實驗結果會失去意義。
套用
滴定量熱法在
量熱學中是測定
熱力學函式的有效手段,例如測定
焓變ΔH。圖7是連續量熱滴定得到的典型圖譜。圖中從 D點開始加入滴定劑,P點代表至此點前加入的滴定劑總量所對應的表觀總熱效應。
滴定曲線在圖上分為a、b、d三個區段。a段為熱實驗初期,圖線的
斜率與攪拌熱、
熱敏電阻自熱和
熱漏值的大小有關;b段是滴定期即實驗主期,熱效應包括
反應熱和
稀釋熱、在 D點處滴定劑與被滴定物二者之間的溫差效應以及a段的各種熱效應;d段為實驗末期,此時已停止加入滴定劑,這段圖線的斜率所受影響與a段相同,只是
反應容器內溶液的體積變大了。在這種情況下,在將滴定劑加入
滴定液的過程中,有可能發生一個或多個反應。各個反應進行的程度和產生的熱效應與該反應的
平衡常數K和反應的
焓變有關。把熱效應、K和ΔH聯繫起來的公式一般是複雜的。如果容器中總共包含n個反應,則這些量之間的關係可以表示為:
(1)QC,P是從滴定開始點D到P點間容器中的n個反應的總熱效應;Δni,P是從D到P之間第i個反應產物生成的
摩爾數,它與該反應的平衡常數有關;ΔHi為該反應的焓變。ΔHi的最佳值一般可通過對式 (1)進行最小二
乘方分析處理得到,即對m個數據點的
測量誤差的
平方和s為:
(2)P表示包括所有的數據點;i表示包括所有的反應。運行一次測試 (得一個熱譜圖) 的 ΔHi最佳值應是使s(ΔHi,Ki)最小的ΔH值,因此:
(3)式中k=1,2,3,…,n,實際上式(3)有n個方程,各為ΔHi(i=1,2,3,…,n)的一次方程。如要各個反應的
平衡常數ki為已知,則Δni的值也已知,就可以解出各個ΔHi的最佳值。
滴定量熱法的另一用途是計算
K值。套用量熱法確定體系的平衡常數必須滿足以下條件:①K值和反應物種的濃度必須在一定範圍內(約為104<K<10)以保證熱譜圖有充分的彎曲度;②該反應的ΔH值足夠大,使得測量出來的總熱效應數值的
重複性優於0.5%(更精確的數據要求重複性優於0.2%,此時溫度變化值至少為0.01℃)。這些限制似乎較苛刻,實際上對於有些體系,如質子
電離作用和金屬
配位體相互作用等,選擇使用適宜的滴定劑可以測定任意大小的
K值。由K和 ΔH值可以得到反應的標準
吉布斯函式變化ΔG°和
熵變ΔS°:
ΔG°=-RTlnK
ΔS°=(ΔH°-ΔG°)/T