簡介 混合熱(heat of mixing),多種不同的物質相互混合形成均相系統時產生的熱效應。通常情況下這種混合過程是在定溫定壓下進行的。常見的混合熱有不同氣體或液體之間的混合熱以及溶解熱、稀釋熱等。對於指定的幾種物質,混合熱取決於溫度、壓力和各種物質的物質的量。通常,混合熱是指在一定溫度和壓力下幾種物質按一定比例混合成1mol/L溶液(即n1 +n2 +……=1mol)時的熱效應。混合熱可用量熱計直接測量。低壓氣體的混合熱較小,高壓氣體的混合熱較大;液體,分子結構和大小相近的混合熱較小,分子結構和大小差別較大的混合熱較大。混合熱的大小對混合前後分子間相互作用的變化、溶液中的溶質和溶劑的存在狀態以及它們的相互作用,能提供有益的信息。因此混合熱的測定是溶液研究的重要手段之一。
分解式 兩種或兩種以上氣體或液體混合形成均相系統的熱效應。影響混合熱的因素有溫度、壓力、溶質和溶劑的性質及其相對含量、混合時的體積變化。通常,混合熱是指在一定的溫度和壓力下幾種物質按一定比例混合形成 1摩爾溶液的熱效應,單位是焦/摩爾。若考慮由兩種液體組分形成的二元溶液,假定ni 、Hi 和Mi分別為組分i的摩爾數、純組分i的摩爾焓和溶液中組分i的偏摩爾焓(n1 +n2 +…=1),則摩爾混合熱為:
摩爾混合熱 混合熱的數據可使用恆溫稀釋量熱器或流動型微量量熱器直接測量,能夠得到實驗條件下的全濃度混合熱曲線。不同物質混合時,有的是吸熱過程(如苯加四氯化碳體系);有的是放熱過程(如水加甲醇體系);也有一些體系在不同的濃度區間分別進行吸熱或放熱的過程(如水加
四氫呋喃 和甲醇加
三氯甲烷 體系),情況較為複雜。
混合熱的測定 將兩種以上物質進行混合而製成溶液時,把生成相當於1mol溶液時所伴隨的熱量變化稱為混合熱。混合熱可直接用
量熱計 測定。用於測定液體混合熱的量熱計是由混合容器、
溫度計 、
加熱器 、記時器等組成。在室溫下混合,其熱效應的測定同普通量熱一樣進行,而對於金屬、
合金 、
爐渣 等混合熱的測定是需要高溫下量熱,實際上有很多困難,所以至今高溫混合熱的數據仍不完善。
測定高溫混合熱需要在高溫量熱計中進行,要求盛裝液體的兩個坩堝容器在混合之前處於相同溫度,而且化學穩定性要好,
蒸氣壓 要低,
導熱性 要好。金屬的混合反應,快的僅用十幾秒或幾十秒反應就結束了,一般來說,混合熱都很小,所以若採用高溫絕熱量熱計,絕熱控制也是很困難的。從原理上講採用雙子示差量熱計會更好些,但在技術上也難於實現。日本不破桔等人試製出來外套等溫型高溫混合量熱計,在1200~1600℃溫度範圍測定銅—鈷、銅—鎳合金的混合熱及
鐵合金 的混合熱,誤差只有15%,所用的實驗裝置如圖所示。氧化鋁質的等溫外套用真空鉬絲電阻爐加熱,溫度控制為(1550 +1)℃,反應管內用純
氬氣 保護,防止試料的揮發。進行混合時產生的熱效應使量熱體系溫度發生變化,在1min時間內使量熱體系與等溫外套達到最大的溫差。
外套等溫型高溫混合量熱計 實驗操作同一般量熱。等溫外套處於加熱爐的恆溫帶內,一切實驗儀器設備安裝好後,將反應管內抽真空並用純淨的氬氣充滿其空間,氬氣流量每分鐘100~150mL。在氬氣保護下通電加熱試樣到所定溫度,溫度恆定後(待測物質都處於相同的溫場中)提起塞頭,使之進行混合,把由於混合而引起的溫度變化相對應的熱電勢進行放大測定記錄。而後向在盛溶液容器的底部的鉑銠絲內部加熱器送電,進行標定量熱計的熱當量,標定要反覆進行數次。其結果計算完全與外套等溫法量熱實驗相同。
對於量熱計的內部結構、所用材料的
熱傳導率 、各部分的熱容的相對關係、測溫熱電偶的相對位置等都要充分注意到。比如溫度測量最好採用熱電堆測其平均溫度,等溫外套要有足夠大的熱容量,但又不能過大,熱惰性過大就得加大等溫外套尺寸,所以等溫外套與量熱容器的熱容量之比例要適當。
對於混合過程為
吸熱反應 時,最好採用電能補償法,輸入量熱體系的熱量大體上與欲測體系混合時所吸收的熱量相等,這樣可以減少量熱體系與環境間的熱交換帶來的誤差。
綜上所述,在測定
生成熱 、
反應熱 、
溶解熱 、混合熱、
比熱容 等數據時,首先必須確定一個合適的方法,如果可能,測量一種物質的數據儘量要選用兩種方法來校核。
如果量熱實驗和化學分析及物相分析都做得很正確,最後所得結果的誤差又能很準確地算出來,那么測得的熱數據結果是可靠的。
混合熱效應 焓—濃度圖(H—C圖)或稱為熱焓組成圖。對與工程有關的混合過程和
分離過程 來說,最有用的性質圖就是焓—濃度圖。下圖為NH
3 -H
2 O系統的焓一濃圖,其中的參考態選擇0℃時的液態H
2 O和-77℃時的純液態NH
3 。需要指出的是這些參考態的選擇是任意的,對任何系統,都需指定每一組分的參考狀態。
氨水系統的焓—濃圖 製作焓一濃圖所需要的數據通常通過測量熱量的方法得到。例如NH3 和H2 O在壓力保持不變的情況下在流動態量熱計中混合,為了保持混合物溫度與初態純物質混合前的溫度一致而需要向系統提供或移出熱量,這個熱量稱為混合熱,以Qm 表示,套用穩定系統的能量衡算關係,即下式,有
H1 δn1 +H2 δn2 - Hm δnm +δQm =0
上式變形得:ΔH=Hm - x1 H1 +x2 H2 =Qm
因此在流動態量熱計中測得的熱效應正好等於混合過程的焓變。式中H1 ,H2 ,Hm 均表示單位質量的焓,而ΔH通常稱為混合熱。
研究意義 混合熱在溶液理論的研究中具有重要意義。混合熱Δ
H M 的符號和大小,反映了溶液中溶質與溶劑的存在狀態和它們之間的相互作用,也是檢驗各種經驗規則和溶液理論的重要依據之一。通常,氣體在低壓下混合時熱效應很小,高壓下的混合熱較大。對
有機液體 來說,分子結構相似和大小相近的物質,混合時熱效應小;分子結構和大小差別明顯的有機物的混合熱較大。對於電解質溶液,如果兩種中性鹽溶液混合而無化學反應發生時,熱效應也很小;若混合時有沉澱或難電離的物質生成,則其熱效應較大。
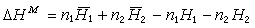 摩爾混合熱
摩爾混合熱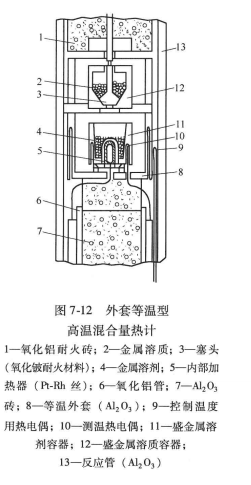 外套等溫型高溫混合量熱計
外套等溫型高溫混合量熱計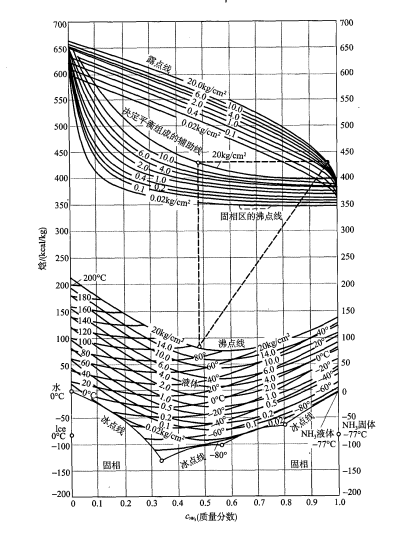 氨水系統的焓—濃圖
氨水系統的焓—濃圖