簡介,概述,定義,性質,影響,發展歷史,早期歷史,近代史,發展史,基本構成,亞原子粒子,電子,電子云,原子核,性質,放射性,磁矩,能級,態,重要參數,質量數,相對原子質量,摩爾(mole),物質構成,起源和現狀,核合成,地球,罕見和理論形式,原子半徑,磁性,概述,核性質,穩定性,光譜,價電子,電離能,電子親和,電負性,
簡介 概述 原子是一種元素能保持其化學性質的最小單位。一個正原子包含有一個
緻密 的原子核及若干圍繞在
原子核 周圍帶負電的電子。而負原子的原子核帶負電,周圍的負電子帶正電。正原子的原子核由帶正電的
質子 和電中性的
中子 組成。負原子原子核中的反質子帶負電,從而使負原子的原子核帶負電。當質子數與電子數相同時,這個原子就是
電中性 的;否則,就是帶有
正電荷 或者
負電荷 的離子。根據質子和中子數量的不同,原子的類型也不同:質子數決定了該原子屬於哪一種元素,而中子數則確定了該原子是此元素的哪一個
同位素 。原子構成分子而分子組成物質中同種電荷相互排斥,不同種電荷相互吸引。
原子直徑的數量級大約是10
- 1 0 m。原子的質量極小,一般為-27次冪,質量主要集中在
質子 和
中子 上。原子核外分布著電子,電子
躍遷 產生
光譜 ,電子決定了一個元素的化學性質,並且對原子的
磁性 有著很大的影響。所有質子數相同的原子組成元素,每種元素大多有一種不穩定的同位素,可以進行
放射性衰變 。
原子最早是哲學上具有
本體論 意義的抽象概念,隨著人類認識的進步,原子逐漸從抽象的概念逐漸成為科學的理論。原子核以及電子屬於
微觀粒子 ,構成原子。而原子又可以構成分子。
定義 化學變化中的最小微粒。
注意:原子是構成物質的最小粒子。是不對的,原子又可以分為原子核與核外電子,原子核又由質子和中子組成,而質子數正是區分各種不同元素的依據。質子和中子還可以繼續再分。所以原子不是構成物質的最小粒子,但原子是化學反應中的最小粒子。
性質 ①原子的質量非常小。
②不停地作無規則運動。
③原子間有間隔。
④同種原子性質相同,不同種原子性質不相同。
影響 原子的力量很大,其中原子核的能量被釋放之後會有相對的危害。但也有好處,就是我們善於利用的話是可以幫助我們的。其中原子核的放射我們可以讓植物吸收來減少我們的傷害。但我們通常可以做的是儘量少用有原子能量的東西,這樣可以減少傷害了。要善於觀察和及時了解新的方法才可以更好地預防。
發展歷史 早期歷史 關於物質是由離散單元組成且能夠被任意分割的概念流傳了上千年,但這些想法只是基於抽象的、哲學的推理,而非實驗和實驗觀察。隨著時間的推移以及文化及學派的轉變,哲學上原子的性質也有著很大的改變,而這種改變往往還帶有一些精神因素。儘管如此,對於原子的基本概念在數千年後仍然被化學家們採用,因為它能夠很簡明地闡述一些化學界的現象。
原子論 是元素派學說中最簡明、最具科學性的一種理論形態。英國自然科學史家
丹皮爾 認為,原子論在科學上“要比它以前或以後的任何學說都更接近於現代觀點”。原子論的創始人是
古希臘 人
留基伯 (公元前500~約公元前440年),他是
德謨克利特 的老師。古代學者在論及原子論時,通常是把他們倆人的學說混在一起的。留基伯的學說由他的學生德謨克利特發展和完善,因此德謨克利特被公認為原子論的主要代表。
德謨克利特 認為,萬物的本原或根本元素是“原子”和“虛空”。“原子”在希臘文中是“不可分”的意思。德謨克利特用這一概念來指稱構成具體事物的最基本的物質微粒。原子的根本特性是“充滿和堅實”,即原子內部沒有空隙,是堅固的、不可入的,因而是不可分的。德謨克利特認為,原子是永恆的、不生不滅的;原子在數量上是無限的;原子處在不斷的運動狀態中,它的惟一的運動形式是“
振動 ”,原子的體積微小,是眼睛看不見的,即不能為感官所知覺,只能通過理性才能認識。
經過二十幾個世紀的探索,科學家在17世紀~18世紀通過實驗,證實了原子的真實存在。19世紀初英國化學家J.道爾頓在進一步總結前人經驗的基礎上,提出了具有近代意義的原子學說。這種原子學說的提出開創了化學的新時代,他解釋了很多物理、化學現象。
原子 是一種元素能保持其化學性質的最小單位。一個原子包含有一個緻密的原子核及若干圍繞在
原子核 周圍帶負電的電子。原子核由帶正電的
質子 和電中性的
中子 組成。原子是化學變化的最小粒子,分子是由原子組成的,許多物質是由原子直接構成的。
原子的英文名是從希臘語轉化而來,原意為不可切分的。很早以前,希臘和印度的哲學家就提出了原子的不可切分的概念。17和18世紀時,化學家發現了物理學的根據:對於某些物質,不能通過化學手段將其繼續的分解。19世紀晚期和20世紀早期,物理學家發現了
亞原子粒子 以及原子的內部結構,由此證明原子並不是不能進一步切分。
量子力學 原理能夠為原子提供很好的模型。
近代史 1661年,自然哲學家
羅伯特·波義耳 出版了《
懷疑的化學家 》(
The Sceptical Chymist )一書,他認為物質是由不同的“微粒”或原子自由組合構成的,而並不是由諸如氣、土、火、水等基本元素構成。
恩格斯 認為,
波義耳 是最早把化學確立為科學的化學家。
1789年,法國科學家
拉瓦錫 定義了原子一詞,從此,原子就用來表示
化學變化 中的最小的單位。
1803年,英語教師及
自然哲學 家
約翰·道爾頓 (
John Dalton )用原子的概念解釋了為什麼不同元素總是呈整數倍反應,即
倍比定律 (
law of multiple proportions );也解釋了為什麼某些氣體比另外一些更容易溶於水。他提出每一種元素只包含唯一一種原子,而這些原子相互結合起來就形成了化合物。
道爾頓在《化學哲學新體系》中描述的原子 1827年,英國植物學家
羅伯特·布朗 (
Botanist Robert Brown )在使用顯微鏡觀察水面上灰塵的時候,發現它們進行著不規則運動,進一步證明了微粒學說。後來,這一現象被稱為為
布朗運動 。
1877年,德紹爾克思(
J. Desaulx )提出
布朗運動 是由於水分子的
熱運動 而導致的。
1897年,在關於
陰極射線 的工作中,物理學家
約瑟夫·湯姆生 (J.J.Thomsom) 發現了電子以及它的
亞原子 特性,粉碎了一直以來認為原子不可再分的構想。湯姆生認為電子是平均的分布在整個原子上的,就如同散布在一個均勻的正電荷的海洋之中,它們的負電荷與那些正電荷相互抵消。這也叫做
葡萄乾蛋糕 模型(棗核模型)。
1905年,
愛因斯坦 提出了第一個數學分析的方法,證明了德紹爾克思的猜想。
1909年,在物理學家
歐內斯特·盧瑟福 (
Ernest Rutherford) 的指導下,菲利普·倫納德(
P.E.A.Lenard )用氦離子轟擊金箔。發現有很小一部分離子的偏轉角度遠遠大於使用湯姆生假設所預測值。盧瑟福根據這個金鉑實驗的結果指出:原子中大部分質量和正電荷都集中在位於原子中心的
原子核 當中,電子則像
行星 圍繞太陽一樣圍繞著原子核。帶
正電 的氦離子在穿越原子核附近時,就會被大角度的反射。這就是原子核的核式結構。
1913年,在進行有關對放射性衰變產物的實驗中,放射化學家
弗雷德里克·索迪 (
Frederick Soddy )發現對於
元素周期表 中的每個位置,往往存在不只一種質量數的原子。瑪格麗特·陶德創造了
同位素 一詞,來表示同一種元素中不同種類的原子。在進行關於離子氣體的研究過程中,湯姆生髮明了一種新技術,可以用來分離不同的同位素,最終導致了穩定同位素的發現;同年,物理學家
尼爾斯·玻爾 (
Niels Bohr )重新省視了
盧瑟福 的模型,並將其與普朗克及愛因斯坦的量子化思想聯繫起來,他認為電子應該位於原子內確定的軌道之中,並且能夠在不同軌道之間躍遷,而不是像先前認為那樣可以自由的向內或向外移動。電子在這些固定軌道間躍遷時,必須吸收或者釋放特定的能量。這種
電子躍遷 的理論能夠很好的解釋氫原子光譜中存在的固定位置的線條,並將
普朗克常數 與
氫原子光譜 的
里德伯常量 取得了聯繫。
1916年,德國化學家柯塞爾(
Kossel )在考察大量事實後得出結論:任何元素的原子都要使最外層滿足8電子穩定結構。路易士發現
化學鍵 的本質就是兩個原子間電子的相互作用。
1919年,物理學家盧瑟福在
α粒子 (氦原子核)轟擊氮原子的實驗中發現質子。弗朗西斯·威廉·阿斯頓(
Francis William Aston )使用
質譜 證實了同位素有著不同的質量,並且同位素間的質量差都為一個整數,這被稱為整數規則。美國化學家
歐文·朗繆爾 提出原子中的電子以某種性質相互連線或者說相互聚集。一組電子占有一個特定的
電子層 。
1923年,美國化學家
吉爾伯特·牛頓·路易斯 (
G.N.Lewis )發展了柯賽爾的理論,提出
共價鍵 的電子對理論。路易斯假設:在分子中來自於一個原子的一個電子與另一個原子的一個電子以“電子對”的形式形成原子間的
化學鍵 。這在當時是一個有悖於正統理論的假設,因為
庫侖定律 表明,兩個電子間是相互排斥的,但路易斯這種構想很快就為化學界所接受,並導致原子間電子自旋相反假設的提出。
1926年,
薛丁格 (
Erwin Schrödinger )使用路易斯·德布羅意(
Louis de Broglie )於1924年提出的
波粒二象性 的假說,建立了一個原子的數學模型,用來將電子描述為一個三維波形。但是在數學上不能夠同時得到位置和動量的精確值。
沃納·海森堡 (
Werner Heisenberg )提出了著名的
測不準原理 。這個概念描述的是,對於測量的某個位置,只能得到一個不確定的動量範圍,反之亦然。儘管這個模型很難想像,但它能夠解釋一些以前觀測到卻不能解釋的原子的性質,例如比氫更大的原子的
譜線 。因此,人們不再使用玻爾的原子模型,而是將原子軌道視為電子高機率出現的區域(電子云)。
質譜 的發明使得科學家可以直接測量原子的準確質量。該設備通過使用一個磁體來彎曲一束離子,而偏轉量取決於原子的質荷比。
弗朗西斯·阿斯頓 使用質譜證實了同位素有著不同的質量,並且同位素間的質量差都為一個整數,這被稱為整數規則。
1930年,科學家發現,
α射線 轟擊鈹-9時,會產生一種
電中性 ,擁有極強穿透力的射線。最初,這被認為是
γ射線 。
1932年,
約里奧·居里 夫婦發現,這種射線能從
石蠟 中打出質子;同年,盧瑟福的學生詹姆斯·查得威克(
James Chadwick )認定這就是中子,而
同位素 則被重新定義為有著相同質子數與不同中子數的元素。
1950年,隨著
粒子加速器 及粒子探測器的發展,科學家們可以研究
高能粒子 間的碰撞。他們發現中子和質子是強子的一種,由更小的
夸克 微粒構成。核物理的標準模型也隨之發展,能夠成功的在亞原子水平解釋整個原子核以及亞原子粒子之間的相互作用。
1985年,
朱棣文 及其同事在
貝爾實驗室 開發了一種新技術,能夠使用雷射來冷卻原子。
威廉·丹尼爾·菲利普斯 團隊設法將納原子置於一個磁阱中。這兩個技術加上由克洛德·科昂-唐努德日團隊基於都卜勒效應開發的一種方法,可以將少量的原子冷卻至微開爾文的溫度範圍,這樣就可以對原子進行很高精度的研究,為
玻色-愛因斯坦凝聚 的發現奠定了基礎。
歷史上,因為單個原子過於微小,被認為不能夠進行科學研究。2012年,科學家已經成功使用一單個金屬原子與一個有機配體連線形成一個單電子電晶體。 在一些實驗中,通過
雷射冷卻 的方法將原子減速並捕獲,這些實驗能夠帶來對於物質更好的理解。
發展史 道爾頓的原子模型
英國自然科學家
約翰·道爾頓 將古希臘思辨的原子論改造成定量的化學理論,提出了世界上第一個原子的理論模型。他的理論主要有以下四點:
①所有物質都是由非常微小的、不可再分的物質微粒即原子組成。
②同種元素的原子的各種性質和質量都相同,不同元素的原子,主要表現為質量的不同。
③原子是微小的、不可再分的實心球體。
④原子是參加
化學變化 的最小單位,在
化學反應 中,原子僅僅是重新排列,而不會被創造或者消失。
雖然,經過後人證實,這是一個失敗的理論模型,但道爾頓第一次將原子從哲學帶入化學研究中,明確了今後化學家們努力的方向,化學真正從古老的
鍊金術 中擺脫出來,道爾頓也因此被後人譽為“近代化學之父”。
葡萄乾布丁模型(棗糕模型)
葡萄乾布丁模型(棗糕模型)由湯姆生提出,是第一個存在著亞
原子結構 的原子模型。
湯姆生在發現電子的基礎上提出了原子的葡萄乾布丁模型(棗核模型),
湯姆生 認為:
①正電荷像流體一樣均勻分布在原子中,電子就像葡萄乾一樣散布在
正電荷 中,它們的負電荷與那些正電荷相互抵消。
湯姆生的學生盧瑟福完成的α粒子轟擊金箔實驗(散射實驗),否認了葡萄乾布丁模型(
棗糕模型 )的正確性。
土星模型
在湯姆生提出葡萄乾布丁模型同年,日本科學家提出了土星模型,認為電子並不是均勻分布,而是集中分布在原子核外圍的一個固定軌道上。
行星模型
①原子的大部分體積是空的。
②在原子的中心有一個體積很小、密度極大的原子核。
③原子的全部正電荷在原子核內,且幾乎全部質量均集中在原子核內部。帶負電的電子在核空間進行高速的繞核運動。
隨著科學的進步,氫原子線狀光譜的事實表明行星模型是不正確的。
玻爾的原子模型
為了解釋
氫 原子線狀光譜這一事實,
盧瑟福 的學生玻爾接受了普朗克的量子論和愛因斯坦的光子概念在行星模型的基礎上提出了核外電子分層排布的原子結構模型。玻爾原子結構模型的基本觀點是:
①原子中的電子在具有確定半徑的圓周軌道(
orbit )上繞原子核運動,不輻射能量。
波爾的原子模型 ②在不同軌道上運動的電子具有不同的能量(E),且能量是量子化的,軌道能量值依n(1,2,3,。..)的增大而升高,n稱為
量子數 。而不同的軌道則分別被命名為K(n=1)、L(n=2)、M(n=3)、N(n=4)、O(n=5)、P(n=6)、Q(n=7)。
③若且唯若電子從一個軌道
躍遷 到另一個軌道時,才會輻射或吸收能量。如果輻射或吸收的能量以光的形式表現並被記錄下來,就形成了光譜。
玻爾的原子模型很好的解釋了氫原子的
線狀光譜 ,但對於更加複雜的光譜現象卻無能為力。
現代量子力學模型
物理學家
德布羅意 、
薛丁格 和
海森堡 等人,經過13年的艱苦論證,在現代量子力學模型在玻爾原子模型的基礎上很好地解釋了許多複雜的光譜現象,其核心是
波動力學 。在玻爾原子模型里,軌道只有一個量子數(主量子數),現代量子力學模型則引入了更多的量子數(
quantum number )。
①
主量子數 (
principal quantum number ),主量子數決定不同的
電子亞層 ,命名為K、L、M、N、O、P、Q。
②
角量子數 (
angular quantum number ),角量子數決定不同的能級,符號“l”共n個值(1,2,3,...n-1),符號用s、p、d、f、g,表示對多電子原子來說,電子的運動狀態與l有關。
③
磁量子數 (
magnetic quantum number )磁量子數決定不同能級的軌道,符號“m”(見下文“磁矩”)。僅在外加磁場時有用。“n”“l”“m”三個量確定一個原子的運動狀態。
④自旋磁量子數(spin m.q.n. )處於同一軌道的電子有兩種自旋,即“↑↓”自旋現象的實質還在探討當中。
基本構成 亞原子粒子 儘管原子的英文名稱(
atom )本意是不能被進一步分割的最小粒子,但是,隨著科學的發展,原子被認為是由電子、質子、中子(氫原子由質子和電子構成)構成,它們被統稱為亞原子粒子。幾乎所有原子都含有上述三種亞原子粒子,但氕(氫的同位素)沒有中子,其離子(失去電子後)只是一個質子。
化合物-原子-原子核-質子-夸克 質子帶有一個正電荷,質量是電子質量的1836倍,為1.6726×10
- 2 7 kg,然而部分質量可以轉化為原子
結合能 。中子不帶電荷,自由中子的質量是電子質量的1839倍,為1.6929×10
- 2 7 kg。中子和質子的尺寸相仿,均在2.5×10
- 1 5 m這一數量級,但它們的表面並沒能精確定義。
原子儘管很小,用化學方法不能再分,但用其他方法仍然可以再分,因為原子也有一定的構成。原子是由中心的帶正電的原子核和核外帶負電的電子構成的(反物質相反),原子核是由質子和中子兩種粒子構成的,電子在核外較大空間內做高速運動。
在物理學
標準模型理論 中,質子和中子都由名叫
夸克 的
基本粒子 構成。夸克是
費米子 的一種,也是構成物質的兩個基本組分之一。另外一個基本組份被稱作是
輕子 ,電子就是輕子的一種。夸克共有六種,每一種都帶有分數的電荷,不是+2/3就是-1/3。質子就是由兩個
上夸克 和一個
下夸克 組成,而中子則是由一個上夸克和兩個下夸克組成。這個區別就解釋了為什麼中子和質子電荷和質量均有差別。夸克由
強相互作用 結合在一起的,由
膠子 作為中介。膠子是
規範玻色子 的一員,是一種用來傳遞力的基本粒子。
亞原子粒子具有量子化特徵和波粒二象性,公式表述為:λ=h/p=h/mv,式中
λ 為
波長 ,p為動量,h為
普朗克常數 ( 6.626×10
- 3 4 J·S)。
電子 在一個內部接近
真空 、兩端封有金屬電極的玻璃管通上高壓直流電,陰極一端便會發出陰極射線。螢光屏可以顯示這種射線的方向,如果外加一個勻強電場,陰極射線會偏向陽極;又若在玻璃管內裝上轉輪,射線可以使轉輪轉動。後經證實,陰極射線是一群帶有負電荷的高速質點,即電子流。電子由此被發現。
電子是最早發現的亞原子粒子,到目前為止,電子是所有粒子中最輕的,只有9.11×10- 3 1 kg,為氫原子的[1/1836.152701(37)],是密立根在1910年前後通過著名的“油滴實驗”做出的。電子帶有一個單位的負電荷,即4.8×10- 1 9 靜電單位或1.6×10- 1 9 庫倫,其體積因為過於微小,現有的技術已經無法測量。
現代物理學認為,電子屬於
輕子 的一種是構成物質的
基本單位 之一(另一種為夸克)。
電子云 電子具有
波粒二象性 ,不能像描述普通物體運動那樣,肯定他在某一瞬間處於空間的某一點,而只能指出它在原子核外某處出現的可能性(即幾率)的大小。電子在原子核各處出現的幾率是不同的,有些地方出現的幾率大,有些地方出現的幾率很小,如果將電子在核外各處出現的幾率用小黑點描繪出來(出現的幾率越大,小黑點越密),那么便得到一種略具直觀性的圖像。這些圖像中,原子核仿佛被帶負電荷的電子云物所籠罩,故稱
電子云 。
氫原子的電子云圖像 在一個原子中,電子和質子因為
電磁力 而相互吸引,也正是這個力將電子束縛在一個環繞著原子核的
靜電 位勢阱中,要從這個
勢阱 中逃逸則需要外部的能量。電子離原子核越近,吸引力則越大。因此,與外層電子相比,離核近的電子需要更多能量才能夠逃逸。
原子軌道 則是一個描述了電子在核內的機率分布的數學方程。在實際中,只有一組離散的(或量子化的)軌道存在,其他可能的形式會很快的坍塌成一個更穩定的形式。這些軌道可以有一個或多個的環或節點,並且它們的大小,形狀和空間方向都有不同。
前五個原子軌道的波函式 每一個原子軌道都對應一個電子的
能級 。電子可以通過吸收一個帶有足夠能量的光子而躍遷到一個更高的能級。同樣的,通過
自發輻射 ,在高能級態的電子也可以躍遷回一個低能級態,釋放出光子。這些典型的能量,也就是不同量子態之間的能量差,可以用來解釋原子
譜線 。
把核外電子出現幾率相等的地方連線起來,作為電子云的界面,使界面內電子云出現的總幾率很大(例如90%或95%),在界面外的幾率很小,有這個界面所包括的空間範圍,叫做原子軌道,這裡的原子軌道與巨觀的軌道具有不同的含義。
在原子核中除去或增加一個電子所需要的能量遠遠小於核子的結合能,這些能量被稱為電子結合能。例如:奪去氫原子中
基態 電子只需要13.6eV。當電子數與質子數相等時,原子是
電中性 的。如果電子數大於或小於質子數時,該原子就會被稱為離子。原子最外層電子可以移動至相鄰的原子,也可以由兩個原子所共有。正是由於有了這種機理,原子才能夠鍵合形成分子或其他種類的化合物,例如離子或共價的網狀晶體。
原子軌道是
薛丁格方程 的合理解,薛丁格方程為一個二階偏微方程:
(δ2 ψ/δx2 )+(δ2 ψ/δy2 )+(δ2 ψ/δz2 )=-(8π2 )/(h2 )·(E-V)ψ,
該方程的解ψ是x、y、z的函式,寫成ψ(x,y,z)。為了更形象地描述波函式的意義,通常用球坐標來描述波函式,即ψ(r,θ,φ)=R(r)·Y(θ,φ),這裡R(r)函式是與徑向分布有關的函式,稱為徑向分布函式;Y(θ,φ)是與角度分布有關的,稱為角度分布波函式。
原子核 原子中所有的質子和中子結合起來就形成了一個很小的原子核,它們一起也可以被稱為核子。原子核的半徑約等於1.07×A^1/3 fm,其中A是核子的總數。原子半徑的數量級大約是105fm,因此原子核的半徑遠遠小於原子的半徑。核子被能在短距離上起作用的殘留強力束縛在一起。當距離小於2.5fm的時候,強力遠遠大於靜電力,因此它能夠克服帶正電的質子間的相互排斥。
同種元素的原子帶有相同數量的質子,這個數也被稱作原子序數。而對於某種特定的元素,中子數是可以變化的,這也就決定了該原子是這種元素的哪一種
同位素 。質子數量和中子數量決定了該原子是這種元素的哪一種
核素 。中子數決定了該原子的穩定程度,一些同位素能夠自發進行放射性衰變。中子和質子都是費米子的一種,根據量子力學中的
泡利不相容原理 ,不可能有完全相同的兩個
費米子 同時擁有一樣量子物理態。因此,原子核中的每一個質子都占用不同的能級,中子的情況也與此相同。不過泡利不相容原理並沒有禁止一個質子和一個中子擁有相同的
量子態 。
如果一個原子核的質子數和中子數不相同,那么該原子核很容易發生放射性衰變到一個更低的能級,並且使得質子數和中子數更加相近。因此,質子數和中子數相同或很相近的原子更加不容易衰變。然而,當原子序數逐漸增加時,因為質子之間的排斥力增強,需要更多的中子來使整個原子核變的穩定,所以對上述趨勢有所影響。因此,當原子序數大於20時,就不能找到一個質子數與中子數相等而又穩定的原子核了。隨著Z的增加,中子和質子的比例逐漸趨於1.5。
核聚變示意圖,圖中兩個質子聚變生成一個包含有一個質子和一個中子的氘原子核,並釋放出一個正電子(電子的反物質)以及一個電子中微子。與此相反的過程是
核裂變 。
如果核聚變後產生的原子核質量小於聚變前原子質量的總和,那么根據
愛因斯坦 的
質能方程 ,這一些質量的差就作為能量被釋放了。這個差別實際是原子核之間的結合能,對於兩個原子序數在鐵或鎳之前的原子核來說。
在
α粒子散射實驗 中,人們發現,原子的質量集中於一個很小且帶正電的物質中,這就是原子核。
原子核也稱作核子,由原子中所有的質子和中子組成,原子核的半徑約等於1.07×A^1/3 fm,其中A是核子的總數。
原子半徑 的數量級大約是105fm,因此原子核的半徑遠遠小於原子的半徑。
組成
原子核由質子與中子組成(氫原子核只有一個質子),
量子態 。
質子 (
proton )
不同同位素中,將核子連在一起所需要的能量 質子由兩個
上夸克 和一個
下夸克 組成,帶一個單位正電荷,質量是電子質量的1836.152701(37)倍,為1.6726231(10)×10
- 2 7 kg,然而部分質量可以轉化為原子結合能。擁有相同質子數的原子是同一種元素,原子序數=質子數=
核電荷數 =核外電子數。
中子是原子中質量最大的亞原子粒子,自由中子的質量是電子質量的1838.683662(40)倍,為1.6749286(10)×10- 2 7 kg。 中子和質子的尺寸相仿,均在2.5×10- 1 5 m這一數量級,但它們的表面並沒能精確定義。
中子由一個上夸克和兩個下夸克組成,兩種夸克的電荷相互抵銷,所以中子不顯電性,但,認為“中子不帶電”的觀點是錯誤的。
而對於某種特定的元素,中子數是可以變化的,擁有不同中子數的同種元素被稱為同位素。中子數決定了一個原子的穩定程度,一些元素的同位素能夠自發進行放射性衰變。
原子核 被一種強力束縛線上度為10
- 1 5 m的區域內。由於質子帶正電,根據庫侖定律,質子間的排斥作用本會使原子核爆裂,但,原子核中有一種力,把質子和中子緊緊束縛在一起,這種力就是核力。在一定距離內,核力遠遠大於靜電力,克服了帶正電的質子間的相互排斥。
核力的作用範圍被稱作力程,作用範圍在2.5fm左右,最多不超過3fm,即,不能從一個原子核延伸到另一個原子核,因此,核力屬於短程力。
具有相同質子數和中子數的原子核稱為核素,而用x軸表示質子數;用y軸表示中子數所得到的圖像就被稱為核素圖,由圖可以發現,在x∈{0,1,2,3,…,20}時,核素圖上的函式近似y=x,但隨著質子數的增加,質子間的庫侖斥力明顯增強,原子核需要比往常更多的中子數維持原子核的未定,在x∈{21,22,23,…,112}時,函式近似為y=1.5x,中子數大於質子數。
結合能 (
energy of the nucleus )
在原子核中,將核子從原子核中分離做功消耗的能量,被稱為結合能。實驗發現,任一原子核的質量總是小於其組成核子的質量和(這一差值被稱為
質量虧損 ),因此,結合能可以由愛因斯坦質能方程推算:
結合能=(原子核內所有質子、中子的靜止質量和-原子核靜止質量)×光速^2
平均結合能 (
binding e.o.t.n )
核素圖&amp 一個原子核中每個核子結合能的平均值被稱作平均結合能,計算公式為:
每個核子的平均結合能=總結合能÷核子數
平均結合能越大,原子核越難被分解成單個的核子。由右圖可以看出:
①重核的平均結合能比中核小,因此,它們容易發生裂變並放出能量。
②輕核的平均結合能比稍重的核的平均結合能小,因此,當輕核發生聚變時會放出能量。
原子核中的質子數和中子數也是可以變化的,不過因為它們之間的力很強,所以需要很高的能量,當多個粒子聚集形成更重的原子核時,就會發生
核聚變 ,例如兩個核之間的高能碰撞與此相反的過程是核裂變,在
核裂變 中,一個核通常是經過放射性衰變,分裂成為兩個更小的核。使用高能的亞原子粒子或光子轟擊也能夠改變原子核。如果在一個過程中,原子核中質子數發生了變化,則此原子就變成了另外一種元素的原子了。
核聚變示意圖 對於兩個原子序數在
鐵 或
鎳 之前的原子核來說,它們之間的核聚變是一個放熱過程,也就是說過程釋放的能量大於將它們連在一起的能量。正是因為如此,
流體靜力平衡 。
性質 放射性 每一種元素都有一個或多個同位素擁有不穩定的原子核,從而能發生放射性衰變,在這個過程中,原子核可以釋放出粒子或電磁輻射。當原子核的半徑大於強力的作用半徑時,放射性衰變就可能發生,而強力的作用半徑僅為幾飛米。
最常見的放射性衰變如下:
α衰變 :原子核釋放一個α粒子,即含有兩個質子和兩個中子的氦原子核。衰變的結果是產生一個
原子序數 低一些的新元素。
β衰變 :弱相互作用的現象,過程中一個中子轉變成一個質子或者一個質子轉變成一個中子。前者伴隨著一個電子和一個
反中微子 的釋放,後者則釋放一個
正電子 和一個
中微子 。所釋放的電子或正電子被叫做β粒子。因此,β衰變能夠使得該原子的原子序數增加或減少一。
γ衰變 :原子核的能級降低,釋放出電磁波輻射,通常在釋放了α粒子或β粒子後發生。
其它比較罕見的放射性衰變還包括:釋放中子或質子,釋放
核子 團或電子團,通過
內轉換 產生高速的電子而非
β射線 以及高能的光子而非伽馬射線。
有Z個質子和N箇中子的同位素的半衰期 每一個放射性同位素都有一個特徵衰變期間,即半衰期。
半衰期 就是一半樣品發生衰變所需要的時間。這是一種指數衰變,即樣品在每一個半衰期內恆定的衰變50%,換句話說,當兩次半衰期之後,就只剩下25%的起始同位素了。
磁矩 基本微粒都有一個固有性質,就像在巨觀物理中圍繞
質心 旋轉的物體都有
角動量 一樣,在
量子力學 中被叫做
自旋 。但是嚴格來說,這些微粒僅僅是一些點,不能夠旋轉。自旋的單位是
約化普朗克常數 ,電子、質子和中子的自旋都是½。在原子裡,電子圍繞原子核運動,所以除了自旋,它們還有軌道角動量。而對於原子核來說,軌道角動量是起源於自身的自旋。
正如一個旋轉的帶電物體能夠產生
磁場 一樣,一個原子所產生的磁場,即它的
磁矩 ,就是
由這些不同的角動量決定的。 然後,自旋對它的影回響該是最大的。因為電子的一個性質就是要符合
泡利不相容原理 ,即不能有兩個位於同樣
量子態 的電子,所以當電子成對時,總是一個自旋朝上而另外一個自旋朝下。這樣,它們產生的磁場相互抵消。對於某些帶有偶數個電子的原子,總的磁偶極矩會被減少至零。
對於
鐵磁性 的元素,例如鐵,因為電子總數為奇數,所以會產生一個淨磁矩。同時,因為相鄰原子軌道重疊等原因,當未成對電子都朝向同一個方向時,體系的總能量最低,這個過程被稱為交換相互作用。當這些鐵磁性元素的磁動量都統一朝向後,整個材料就會擁有一個巨觀可以測量的磁場。
順磁性 材料中,在沒有外部磁場的情況下,原子磁矩都是隨機分布的;施加了外部磁場以後,所有原子都會統一朝向,產生磁場。
原子核也可以存在淨自旋。由於
熱平衡 ,通常這些原子核都是隨機朝向的。但對於一些特定元素,例如
氙 -129,一部分核自旋也是可能被
極化 的,這個狀態被叫做
超極化 ,在
核磁共振成像 中有很重要的套用。
能級 原子中,電子的
勢能 與它離原子核的距離成反比。測量電子的勢能,通常的測量將讓該電子脫離原子所需要的能量,單位是
電子伏特 (eV)。在量子力學模型中,電子只能占據一組以原子核為中心的狀態,每一個狀態就對應於一個能級。最低的能級就被叫做基態,而更高的能級就被叫做激發態。
電子要在兩個能級之間躍遷的前提是它要吸收或者釋放能量,該能量還必須要和這兩個能級之間的能量差一致。因為釋放的
光 子能量只與光子的頻率有關,並且能級是不連續的,所以在
電磁波譜 中就會出現一些不連續的帶。每一個元素都有一個特徵波譜,特徵波譜取決於核電荷的多少,電子的填充情況,電子間的電磁相互作用以及一些其他的因素。
當一束全譜的光經過一團氣體或者一團電漿後,一些光子會被原子吸收,使得這些原子內的電子躍遷。而在激發態的電子則會自發的返回低能態,能量差作為光子被釋放至一個隨機的方向。前者就使那些原子有了類似於濾鏡的功能,觀測者在最後接收到的光譜中會發現一些黑色的吸收能帶。而後者能夠使那些與光線不在同一條直線上的觀察者觀察到一些不連續的譜線,實際就是那些原子的
發射譜線 。對這些譜線進行光譜學測量就能夠知道該物質的組成以及物理性質。
一個吸收譜線的例子:太陽的夫朗和斐譜線 在對譜線進行了細緻的分析後,科學家發現一些譜線有著
精細結構 的
裂分 。這是因為自旋與最外層電子運動間的相互作用,也被稱作
自旋-軌道耦合 。當原子位於外部磁場中時,譜線能夠裂分成三個或多個部分,這個現象被叫做
塞曼效應 ,其原因是原子的磁矩及其電子與外部磁場的相互作用。一些原子擁有許多相同能級電子排布,因而只產生一條譜線。當這些原子被安置在外部
磁場 中時,這幾種電子排布的能級就有了一些細小的區別,這樣就出現了裂分。外部電場的存在也能導致類似的現象發生,被稱為
斯塔克效應 。
如果一個電子在激發態,一個有著恰當能量的光子能夠使得該電子 受激輻射 ,釋放出一個擁有相同能量的光子,其前提就是電子返回低能級所釋放出來的能量必須要與與之作用的光子的能量一致。此時,受激釋放的光子與原光子向同一個方向運動,也就是說這兩個光子的波是同步的。 利用這個原理,人們設計出了
雷射 ,用來產生一束擁有很窄頻率
相干 光源。
態 物質很多不同的
相態 之中都存在原子,這些相態都由一定的物理條件所決定,例如溫度與
壓強 。通過改變這些條件,物質可以在固體、液體、氣體與
電漿 之間轉換。在同一種相態中,物質也可以有不同的形態,例如固態的碳就有石墨和金剛石兩種形態。
玻色-愛因斯坦凝聚態 重要參數 質量數 (mass number)由於質子與中子的質量相近且遠大於電子,所以用原子的質子和中子數量的總和定義相對原子質量,稱為質量數。
相對原子質量 原子的靜止質量通常用統一
原子質量單位 (u)來表示,也被稱作
道爾頓 (Da)。這個單位被定義為電中性的碳12質量的十二分之一,約為1.66×10
- 2 7 kg。氫最輕的一個
同位素 氕是最輕的原子,重量約為1.007825u。一個原子的質量約是質量數與原子質量單位的乘積。最重的穩定原子是鉛-208,質量為207.9766521u。
摩爾(mole) 就算是最重的原子,化學家也很難直接對其進行操作,所以它們通常使用另外一個單位摩爾。摩爾的定義是對於任意一種元素,一摩爾總是含有同樣數量的原子,約為6.022×10
2 3 個【2010年CODATA數據:
】。因此,如果一個元素的原子質量為1u,一摩爾該原子的質量就為(1.66×10
- 2 7 x6.022×10
2 3 =9.99652x10- 4 ≈10x10- 4 =0.001kg) 0.001kg,也就是1克。例如,碳-12的原子質量是12u,一摩爾碳的質量則是0.012kg。
物質構成 金屬單質(例:鐵、銅、鋁等)
少數非金屬單質(例:金剛石、石墨、磷等)
稀有氣體(例:氦氣、氖氣、氬氣)
原子和離子的區別與聯繫
原子
離子
陽離子
陰離子
區
結構
質子數等於核外電子數
質子數大於核外電子數
質子數小於核外電子數
電性
不顯電性
帶正電
帶負電
符號
元素符號(H)
離子符號(H+ )
離子符號(Cl- )
聯繫
起源和現狀 核合成 穩定的質子和電子在
大爆炸 後的一秒鐘內出現。在接下來的三分鐘之內,
太初核合成 產生了宇宙中大部分的
氦 、
鋰 和
氘 ,有可能也產生了一些
鈹 和
硼 。在理論上,最初的原子(有束縛的電子)是在大爆炸後大約380,000 年產生的,這個時代稱為重新結合,在這時宇宙已經冷卻到足以使電子與原子核結合了。自從那時候開始,原子核就開始在
恆星 中通過
核聚變 的過程結合,產生直到鐵的元素。
像鋰-6那樣的同位素是在太空中通過
宇宙射線散裂 產生的。這種現象在高能量的質子撞擊原子核時會發生,造成大量核子被射出。比鐵重的元素在
超新星 中通過
r-過程 產生,或在AGB星中通過
s-過程 產生,兩種過程中都有中子被原子核捕獲。像鉛那樣的元素,大都是從更重的元素通過
核衰變 產生的。
地球 大部分組成地球及其居民的原子,都是在太陽系剛形成的時候就已經存在了。還有一部分的原子是核衰變的結果,它們的相對比例可以用來通過放射性定年法決定
地球的年齡 。大部分地殼中的
氦 都是
α衰變 的產物。
地球上有很少的原子既不是在一開始就存在的,也不是放射性衰變的結果。
碳-14 是大氣中的宇宙射線所產生的。有些地球上的原子是核反應堆或核爆炸的產物,要么是特意製造的,要么是副產物。在所有
超鈾元素 ──原子序數大於92的元素中,只有
鈽 和鎿在地球中自然出現。超鈾元素的壽命比地球的年齡短,因此許多這類的元素都早已衰變了,只有微量的鈽-244例外。鈽和鎿的自然礦藏是在鈾礦中通過
中子俘獲 產生的。
地球含有大約1.33x10E50個原子。在地球的大氣層中,含有少量的
惰性氣體 原子,例如
氬 和
氖 。大氣層剩下的99%的部分,是以分子的形式束縛的,包括
二氧化碳 、雙原子的
氧氣 和
氮氣 。在地球的表面上,原子結合併形成了各種各樣的化合物,包括
水 、鹽、
矽酸鹽 和
氧化物 。原子也可以結合起來組成不含獨立分子的物質,包括晶體和液態或固態金屬。
罕見和理論形式 雖然原子序數大於82(鉛)的元素已經知道是放射性的,但是對於原子序數大於103的元素,提出了“
穩定島 ”的概念。在這些
超重元素 中,可能有一個原子核相對來說比其它原子核穩定。最有可能的穩定超重元素是
Ubh ,它有126 個質子和184 箇中子。
每一個粒子都有一個對應的
反物質 粒子,電荷相反。因此,
正電子 就是帶有正電荷的反電子,反質子就是與質子對等,但帶有負電荷的粒子。不知道什麼原因,在宇宙中反物質是非常稀少的,因此在自然界中沒有發現任何反原子。然而,1996年,在
日內瓦 的
歐洲核子研究中心 ,首次合成了
反氫 ──氫的反物質。
把原子中的質子、中子或電子用相等電荷的其它粒子代替,可以形成
奇異原子 。例如,可以把電子用質量更大的
μ子 代替,形成μ子原子。這些類型的原子可以用來測試物理學的基本預言。
原子半徑 原子沒有一個精確定義的最外層,通常所說的原子半徑是根據相鄰原子的平均核間距測定的。
我們測得
氯氣 分子中兩個Cl原子的核間距為1.988Α,就把此核間距的一半,即0.994Α定為氯原子的半徑,此半徑稱為共價半徑。共價半徑為該元素單質
鍵長 的一半。
另外,我們也可以測得
金屬單質 比如銅中相鄰兩個銅原子的核間距,其值的一半稱為金屬半徑。
指在分子晶體中,分子間以
范德華力 結合,如稀有氣體相鄰兩原子核間距的一半。
部分元素的原子半徑表
下表為一些元素的原子半徑(pm ),數據取自《無機化學-第四版》(2000年)和j.chem.phys (1967)。
元素
半徑
37
122
152
111
88
77
70
66
64
160
元素
半徑
186
160
143
117
110
104
99
191
227
197
元素
半徑
161
145
132
125
124
124
125
125
128
133
元素
半徑
122
122
121
117
114
198
248
215
181
160
元素
半徑
143
136
136
133
135
138
144
149
163
141
元素
半徑
141
137
133
217
265
217
註:表中
非金屬元素 為共價半徑、金屬元素為金屬半徑、稀有氣體為范德華半徑
註:許多元素的半徑值在不同書籍中差異較大,其原因有:
①原子半徑的單位有(pm)和埃(Α)兩種,Α=100pm。
②原子半徑的測定方法不同。
③原子半徑的種類不同。
原子半徑的周期規律
在元素周期表中,原子的半徑變化的大體趨勢是自上而下增加,而從左至右減少。因此,最小的原子是
氫 ,半徑為0.28Α;最大的原子是
銫 ,半徑為2.655Α。因為這樣的尺寸遠遠小於可見光的波長(約400~700nm),所以不能夠通過光學顯微鏡來觀測它們。然而,使用掃描隧道顯微鏡,我們能夠觀察到單個原子。
磁性 概述 電子是一種
帶電體 ,正如所有帶電體一樣,電子旋轉時會產生一個
磁場 ,因此,不同的原子往往有不同的磁學特性。
分子軌道理論可以很好地解釋分子的磁性問題,例如
氧氣 的順磁性。
一些物質的原子中
電子磁矩 互相抵消,合磁矩為零。當受到外加磁場作用時,電子軌道運動會發生變化,而且在與外加磁場的相反方向產生很小的合磁矩。常見的逆磁性金屬有Bi、Cu、Ag、Au。
順磁性物質的主要特點是原子或分子中含有沒有完全抵消的電子磁矩,因而具有原子或分子磁矩。但是
原子磁矩 之間並無強的相互作用(一般為
交換作用 ),因此原子磁矩在熱騷動的影響下處於無規(混亂)排列狀態,原子磁矩互相抵消而無合磁矩。但是當受到外加磁場作用時,這些原來在熱騷動下混亂排列的原子磁矩便同時受到磁場作用使其趨向磁場排列和熱騷動作用使其趨向混亂排列,因此總的效果是在外加磁場方向有一定的磁矩分量。這樣便使
磁化率 (磁化強度與磁場強度之比)成為正值,但數值也是很小,一般順磁物質的磁化率約為十萬分之一(10
- 5 ),並且隨溫度的降低而增大。
核性質 某些物質的
原子核 能發生衰變,放出我們肉眼看不見也感覺不到的射線,只能用專門的儀器才能探測到的
射線 。物質的這種性質叫放射性。
不穩定(即具有放射性)的原子核在放射出
粒子 及能量後可變得較為穩定,這個過程稱為衰變(
Radioactive decay )。這些粒子或能量(後者以
電磁波 方式射出)統稱輻射(
radiation )。由不穩定原子核發射出來的輻射可以是α(氦原子核)粒子、β(電子或正電子)粒子、γ射線或中子。
放射性核素在衰變過程中,該
核素 的原子核數目會逐漸減少。衰變至只剩下原來質量一半所需的時間稱為該核素的
半衰期 (
half-life )。每种放射性核素都有其特定的半衰期,由幾
微秒 到幾百萬年不等。
原子核由於放出某種粒子而變為新核的現象.原子核是一個量子體系,
核衰變 是原子核自發產生的變化,它是一個量子
躍遷 過程,它服從量子
統計規律 .對任何一個放射性核素,它發生衰變的精確時刻是不能預知的,但作為一個整體,衰變的規律十分明確.若在dt時間間隔內發生核衰變的數目為dN,它必定正比於當時存在的原子核數目N,顯然也正比於時間間隔dt。
衰變有3種:α衰變 、β衰變和γ衰變。
核裂變指是一個原子核分裂成幾個原子核的變化,核裂變通常由中子轟擊質量數較大的原子核引起,
原子核裂變 後會形成兩個質量相當的部分,並放出能量,有時會導致
鏈式反應 的發生。能量=質量╳
光速 的平方
核聚變是指由質量小的原子,主要是指氘或氚,在一定條件下(如超高溫和高壓),發生原子核互相聚合作用,生成新的質量更重的原子核,並伴隨著巨大的能量釋放的一種核反應形式。原子核中蘊藏巨大的能量,原子核的變化(從一種原子核變化為另外一種原子核)往往伴隨著能量的釋放。如果是由重的原子核變化為輕的原子核,叫核裂變,如核子彈爆炸;如果是由輕的原子核變化為重的原子核,叫核聚變,如太陽和氫彈。現在人類只能和平利用核裂變,不能和平利用核聚變。
穩定性 原子核的穩定性,是指原子核不會自發地改變其質子數、中子數和它的基本性質。按原子核的穩定性可分為穩定原子核和不穩定(或放射性)原子核兩類。
1.原子核中的質子數等於和大於84的原子核是不穩定的。即原子序數84以後的元素均為放射性元素。
2.具有少於84個質子的原子核,質子數和中子數均為偶數時,其核穩定。
3.質子數或中子數等於2,8,20,28,50,82,126的原子核特別穩定。這些數稱為幻數。質子數和中子數都是幻數,稱為雙幻數核。
4.中子數和質子數之比n/p,在Z<20時n/p=1,原子核穩定。隨著原子序數增加,n/p值增大,比值越大,穩定性越差。
原子核衰變
不穩定的原子核都會自發地轉變成另一種核而同時放出射線,這種變化叫放射性衰變。原子核在衰變過程中放出的射線有三種:α射線、β射線和γ射線.
α射線是α粒子流,它是帶正電的氦核。β射線是高速運動的電子流。
β衰變有β+和β-兩種。β衰變時除放出正電子或負電子外,還放出中微子或反中微子。β-衰變是原子核內中子轉變成質子(留在核內)同時放出一個電子和與電子相聯繫的反中微子。β+衰變是原子核內中子數較少,質子轉變成中子(留在核內),同時放出一個正電子和一個中微子。
γ射線是光子流。通常是在α衰變或β衰變後形成新核時輻射出來的。這是因為放射性母核經上述衰變後,變成處於激發態的子核,子核在躍遷到正常態時,一般輻射出γ光子。
衰變前粒子的電荷總數和質量總數與衰變後所有粒子的電荷總數和質量總數相等
t時刻樣品中有N個核,在dt時間內有dN個發生衰變,有
t=0,N=N0,有
上式稱為放射性衰變定律。
物理意義為:t時刻,每單位時間衰變的原子核數與該時刻原子核總數的比。越大,衰變越快。
習慣上常用半衰期來表征放射性元素衰變的快慢。半衰期的定義是:原子核衰變到N=N0/2所需的時間。用T表示。
有時也用平均壽命τ表示衰變的快慢。平均壽命是指每個原子核衰變前存在的時間的平均值。
放射性活度 (也稱放射性強度)是指一個放射源,在單位時間內發生的核衰變次數。
在國際單位制中,放射性活度的單位是貝克勒爾(Bq)。1Bq表示每秒發生一次核衰變的放射源的活度。常用的單位還有居里(Ci)。
光譜 在穩定狀態下,原子中的電子位於離核最近的軌道上,這時的原子就被稱為
基態原子 ;電子吸收能量後躍遷到更高的軌道上,這時原子就處於
激發態 。由於原子的軌道是量子化的,因此原子的能量發生變化時,會吸收(放出)特定的能量,產生不同的光譜圖像,
古斯塔夫·羅伯特·基爾霍夫 (
Gustav Robert Kirchhoff )和
羅伯特·威廉·本生 (
Robert Wilhelm Bunson )最早套用這一性質對不同元素的原子進行鑑定。
當原子的光譜落在可見光區時,肉眼就可以看見不同的顏色,這是有些元素的原子在灼燒時引起
火焰 顏色變化的原因,這種變化被稱為焰色反應,可以粗略地檢測某些元素原子的存在。
下表給出部分金屬(或金屬離子)焰色反應產生的顏色:
類別
鈉離子
鉀離子
鈣離子
鋇離子
銅離子
顏色
紫紅
黃
淡紫
紫
磚紅
洋紅
黃綠
綠
價電子 價電子 是原子參與化學反應的電子數,價電子數與原子的
化學性質 密切相關,對於主族元素來說,價電子數等於其
最外層電子數 ;對於
副族元素 ,價電子數包括最外層電子數和次外層的d(有時還包括f)軌道的電子數,元素周期表中通常會用
電子排布式 標示一個特定元素的價電子。根據價電子的不同,元素周期表可以分為s區、p區、d區、ds區、f區。
電離能 電離能 的大小反映了原子失去電子的難易。電離能愈小,原子失去電子愈易,反之同理;電離能的大小和原子的有效電荷、原子半徑和電子排布有很大關係。
第一電離能
基態氣體原子失去電子成為帶一個正電荷的氣態正離子所需的能量稱為第一電離能,一般來說,若不作說明,電離能即第一電離能。
1st~10th
以下是已發現所有元素的第一到第十電離能。數據來源不詳。單位:kJ/mol(千焦/摩爾)
1st
2nd
3rd
4th
5th
6th
7th
8th
9th
10th
1312.0
2372.3
5250.5
520.2
7298.1
11815.0
899.5
1757.1
14848.7
21006.6
800.6
2427.1
3659.7
25025.8
32826.7
碳
1086.5
2352.6
4620.5
6222.7
37831
47277.0
氮
1402.3
2856
4578.1
7475.0
9444.9
53266.6
64360
1313.9
3388.3
5300.5
7469.2
10989.5
13326.5
71330
84078.0
氟
1681.0
3374.2
6050.4
8407.7
11022.7
15164.1
17868
92038.1
106434.3
氖
2080.7
3952.3
6122
9371
12177
15238
19999.0
23069.5
115379.5
131432
鈉
495.8
4562
6910.3
9543
13354
16613
20117
25496
28932
141362
鎂
737.7
1450.7
7732.7
10542.5
13630
18020
21711
25661
31653
35458
鋁
577.5
1816.7
2744.8
11577
14842
18379
23326
27465
31853
38473
矽
786.5
1577.1
3231.6
4355.5
16091
19805
23780
29287
33878
38726
磷
1011.8
1907
2914.1
4963.6
6273.9
21267
25431
29872
35905
40950
硫
999.6
2252
3357
4556
7004.3
8495.8
27107
31719
36621
43177
氯
1251.2
2298
3822
5158.6
6542
9362
11018
33604
38600
43961
氬
1520.6
2665.8
3931
5771
7238
8781
11995
13842
40760
46186
鉀
418.8
3052
4420
5877
7975
9590
11343
14944
16963.7
48610
鈣
589.8
1145.4
4912.4
6491
8153
10496
12270
14206
18191
20385
鈧
633.1
1235.0
2388.6
7090.6
8843
10679
13310
15250
17370
21726
鈦
658.8
1309.8
2652.5
4174.6
9581
11533
13590
16440
18530
20833
釩
650.9
1414
2830
4507
6298.7
12363
14530
16730
19860
22240
鉻
652.9
1590.6
2987
4743
6702
8744.9
15455
17820
20190
23580
錳
717.3
1509.0
3248
4940
6990
9220
11500
18770
21400
23960
鐵
762.5
1561.9
2957
5290
7240
9560
12060
14580
22540
25290
鈷
760.4
1648
3232
4950
7670
9840
12440
15230
17959
26570
鎳
737.1
1753.0
3395
5300
7339
10400
12800
15600
18600
21670
銅
745.5
1957.9
3555
5536
7700
9900
13400
16000
19200
22400
鋅
906.4
1733.3
3833
5731
7970
10400
12900
16800
19600
23000
鎵
578.8
1979.3
2963
6180
鍺
762
1537.5
3302.1
4411
9020
砷
947.0
1798
2735
4837
6043
12310
硒
941.0
2045
2973.7
4144
6590
7880
14990
溴
1139.9
2103
3470
4560
5760
8550
9940
18600
氪
1350.8
2350.4
3565
5070
6240
7570
10710
12138
22274
25880
銣
403.0
2633
3860
5080
6850
8140
9570
13120
14500
26740
鍶
549.5
1064.2
4138
5500
6910
8760
10230
11800
15600
17100
釔
600
1180
1980
5847
7430
8970
11190
12450
14110
18400
鋯
640.1
1270
2218
3313
7752
9500
鈮
652.1
1380
2416
3700
4877
9847
12100
鉬
684.3
1560
2618
4480
5257
6640.8
12125
13860
15835
17980
鎝
702
1470
2850
釕
710.2
1620
2747
鐒
719.7
1740
2997
鈀
804.4
1870
3177
銀
731.0
2070
3361
鎘
867.8
1631.4
3616
銦
558.3
1820.7
2704
5210
錫
708.6
1411.8
2943.0
3930.3
7456
銻
834
1594.9
2440
4260
5400
10400
碲
869.3
1790
2698
3610
5668
6820
13200
碘
1008.4
1845.9
3180
氙
1170.4
2046.4
3099.4
銫
375.7
2234.3
3400
鋇
502.9
965.2
3600
538.1
1067
1850.3
4819
5940
534.4
1050
1949
3547
6325
7490
527
1020
2086
3761
5551
533.1
1040
2130
3900
鉕
540
1050
2150
3970
釤
544.5
1070
2260
3990
銪
547.1
1085
2404
4120
軋
593.4
1170
1990
4250
鋱
565.8
1110
2114
3839
鏑
573.0
1130
2200
3990
581.0
1140
2204
4100
鉺
589.3
1150
2194
4120
銩
596.7
1160
2285
4120
鐿
603.4
1174.8
2417
4203
鑥
523.5
1340
2022.3
4370
6445
鉿
658.5
1440
2250
3216
鉭
761
1500
鎢
770
1700
760
1260
2510
3640
840
1600
銥
880
1600
870
1791
金
890.1
1980
汞
1007.1
1810
3300
鉈
589.4
1971
2878
鉛
715.6
1450.5
3081.5
4083
6640
703
1610
2466
4370
5400
8520
812.1
砹
910
電子親和 元素的一個基態氣體原子得到一個電子成為一價氣態
負離子 時所放出的能量稱為該元素的電子親和能(Y)。元素的電子親和能表示得到一個電子形成負離子時放出的能量;若為負值,則表示要吸收能量(親和能為負值的通常是金屬,很難形成負離子)。
電子親和能是元素
氧化性 的一個衡量標準,電子親和能越大,該原子得電子的傾向越大,該原子對應元素的非金屬性越強,電子親和能的規律性並不強。
由於條件限制,電子親和能還沒有準確的測定方法,不同文獻的電子親和能大小相差較大,也未表現出周期變化規律,所以電子親和能的套用並不廣泛。
以下給出部分
主族元素 元素電子親和能大小,數據取自《化學-物質結構與性質(選修)》(2004年)。
元素
碳
氮
鈉
Y
72.8
59.6
-48.6
26.7
122
-7
141
328
52.9
元素
鎂
磷
硫
鉀
鈣
Y
-38.6
42.5
134
72
200
349
48.4
-28.9
28.9
元素
硒
溴
Y
119
78.2
195
325
46.9
-28.9
28.9
107
190
元素
碘
鋇
鉈
鉛
砹
Y
295
45.5
-28.9
19.3
35.1
91.3
183
270
第二(及以上)電子親和能
第二(及以上)電子親和能對於任何元素均為負值,基本無意義。
電負性 電負性 是一組表示原子在分子成鍵時對電子吸引力的相對數值,電負性綜合考慮了電離能和電子親合能,首先由
萊納斯·卡爾·鮑林 (
L.C.Pauling )於1932年提出。元素電負性數值越大,原子在形成化學鍵時對成鍵電子的吸引力越強。
計算方法
電負性的計算方法有多種,每一種方法的電負性數值都不同,比較有代表性的有3種。
① 鮑林提出的標度。根據熱化學數據和分子的
鍵能 ,指定氟的電負性為3.98,計算其他元素的相對電負性。
③阿萊提出的建立在核和成鍵原子的電子
靜電作用 基礎上的電負性。利用電負性值時,必須是同一套數值進行比較。
電負性表
下表給出了常見元素的電負性大小,數據取自《化學-物質結構與性質(選修)》(2004年)。
元素
碳
氮
電負性
2.1
-
1.0
1.5
2.0
2.5
3.0
3.5
4.0
元素
鈉
鎂
磷
硫
<TD v
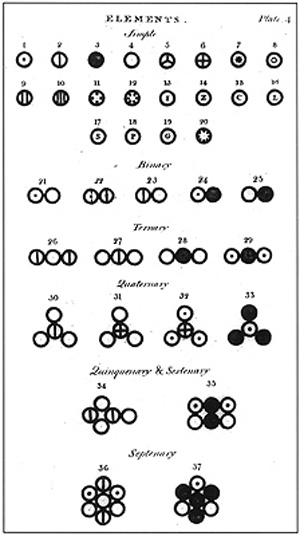 道爾頓在《化學哲學新體系》中描述的原子
道爾頓在《化學哲學新體系》中描述的原子 波爾的原子模型
波爾的原子模型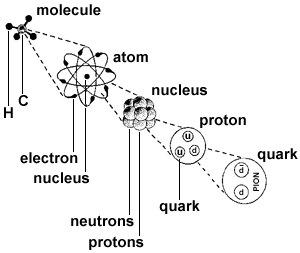 化合物-原子-原子核-質子-夸克
化合物-原子-原子核-質子-夸克 氫原子的電子云圖像
氫原子的電子云圖像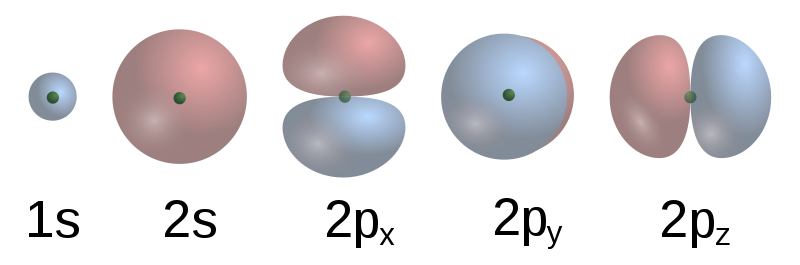 前五個原子軌道的波函式
前五個原子軌道的波函式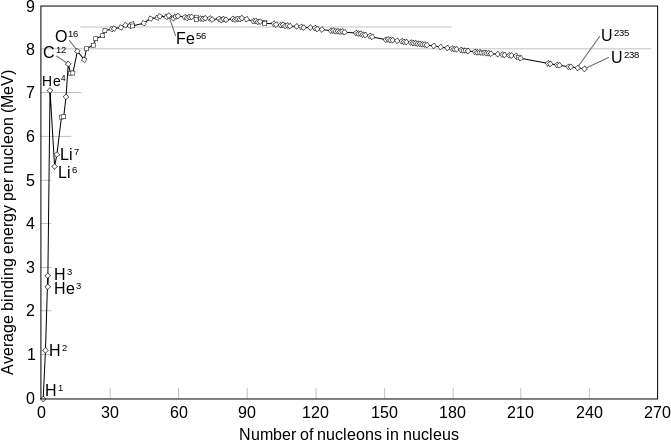 不同同位素中,將核子連在一起所需要的能量
不同同位素中,將核子連在一起所需要的能量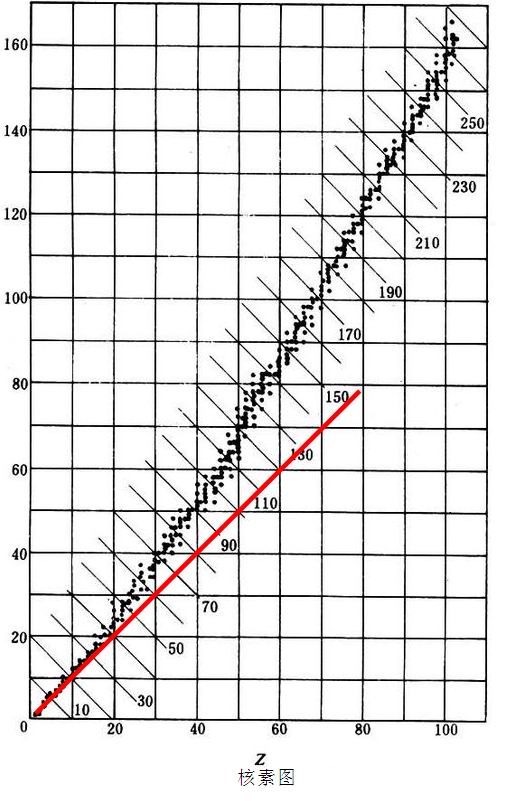 核素圖&amp
核素圖&amp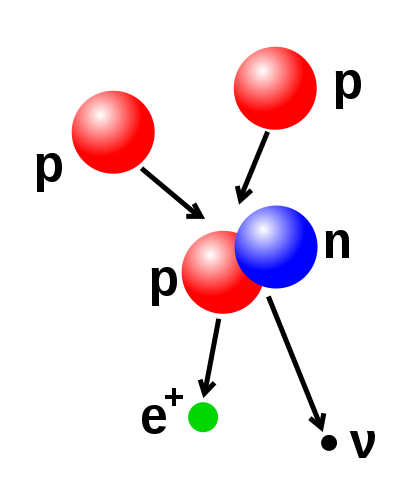 核聚變示意圖
核聚變示意圖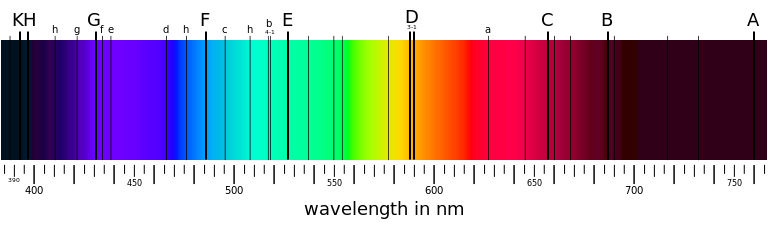 一個吸收譜線的例子:太陽的夫朗和斐譜線
一個吸收譜線的例子:太陽的夫朗和斐譜線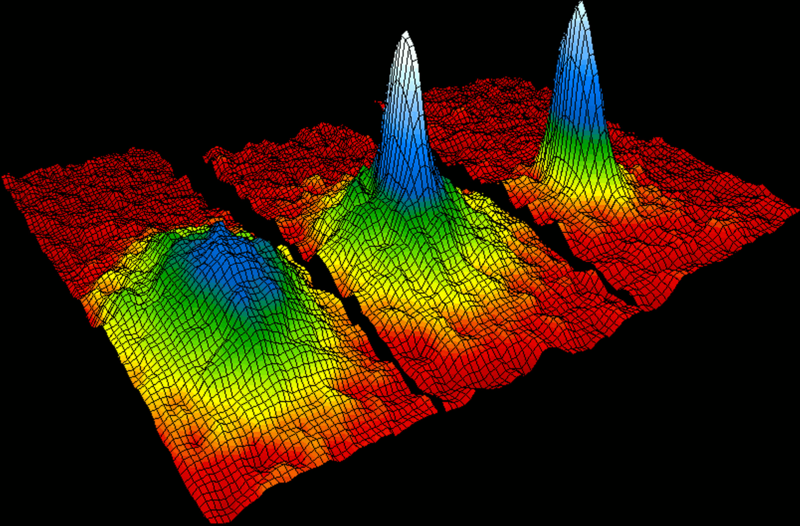 玻色-愛因斯坦凝聚態
玻色-愛因斯坦凝聚態

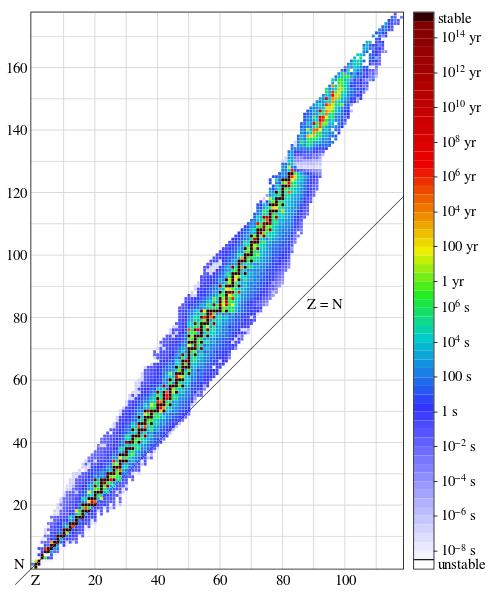 有Z個質子和N箇中子的同位素的半衰期
有Z個質子和N箇中子的同位素的半衰期