發現史 從英國化學家和物理學家
道爾頓 (J.John Dalton ,1766~1844)創立
原子學說 以後,很長時間內人們都認為原子就像一個小得不能再小的玻璃
實心球 ,裡面再也沒有什麼花樣了。
從1869年德國科學家
希托夫 發現
陰極射線 以後,克魯克斯、
赫茲 、勒納、湯姆遜等一大批科學家研究了陰極射線,歷時二十餘年。最終,湯姆生(Joseph John Thomson)發現了電子的存在。通常情況下,原子是不帶電的,既然從原子中能跑出比它質量小1700倍的帶負電電子來,這說明原子內部還有結構,也說明原子裡還存在帶
正電 的東西,它們應和電子所帶的負電中和,使原子呈中性。
簡介 原子中除電子外還有什麼東西,電子是怎么待在原子裡的, 原子中什麼東西帶
正電荷 ,正電荷是如何分布的, 帶負電的電子和帶正電的東西是怎樣相互作用的等等一大堆新問題擺在物理學家面前。根據科學實踐和當時的實驗觀測結果,物理學家發揮了他們豐富的想像力,提出了各種不同的原子模型。
1901年法國物理學家
佩蘭 (Jean Baptiste Perrin,1870-1942)提出的結構模型,認為原子的中心是一些帶正電的粒子,外圍是一些繞轉著的電子,電子繞轉的周期對應於原子發射的光譜線頻率,最外層的電子拋出就發射陰極射線。
原子模型 中性原子模型 1902年德國物理學家
勒納德 (Philipp Edward Anton Lenard,1862—1947)提出了中性微粒動力子模型。勒納德早期的觀察表明,
陰極射線 能通過真空管內鋁窗而至管外。根據這種觀察,他在1903年以吸收的實驗證明高速的陰極射線能通過數千個原子。按照當時盛行的半唯物主義者的看法,原子的大部分體積是空無所有的空間,而剛性物質大約僅為其全部的10-9(即十萬萬分之一)。勒納德構想“剛性物質”是散處於原子內部空間的若干陽電和
陰電 的合成體。
實心帶電球 英國著名物理學家、發明家
開爾文 (Lord Kelvin,1824~1907 )原名W.
湯姆孫 (William Thomson),由於裝設第一條大西洋海底電纜有功,英政府於1866年封他為爵士,並於1892年晉升為開爾文勳爵,開始用開爾文這個名字。開爾文研究範圍廣泛,在
熱學 、
電磁學 、流體力學、光學、地球物理、數學、
工程套用 等方面都做出了貢獻。他一生髮表論文多達600餘篇,取得70種發明專利,他在當時科學界享有極高的名望。開爾文1902年提出了實心帶電球原子模型,就是把原子看成是均勻帶
正電 的球體,裡面埋藏著帶負電的電子,正常狀態下處於
靜電平衡 。這個模型後由J.J.湯姆孫加以發展,後來通稱
湯姆孫 原子模型。
原子內部結構的示意圖 棗糕模型 葡萄乾蛋糕模型(棗糕模型)
湯姆遜(Joseph John Thomson,1856-1940)繼續進行更有系統的研究,嘗試來描繪原子結構。湯姆遜以為原子含有一個均勻的陽電球,若干陰性電子在這個球體內運行。他按照
邁耶爾 (Alfred Mayer)關於浮置
磁體 平衡的研究證明,如果電子的數目不超過某一限度,則這些運行的電子所成的一個環必能穩定。如果電子的數目超過這一限度,則將列成兩環,如此類推以至多環。這樣,電子的增多就造成了結構上呈周期的相似性,而門捷列耶夫周期表中物理性質和化學性質的重複再現,或許也可得著解釋了。
湯姆遜提出的這個模型,
電子分布 在球體中很有點像葡萄乾點綴在一塊蛋糕里,很多人把湯姆遜的原子模型稱為“
葡萄乾蛋糕模型 ”。它不僅能解釋原子為什麼是電中性的,電子在原子裡是怎樣分布的,而且還能解釋陰極射線現象和金屬在紫外線的照射下能發出電子的現象。而且根據這個模型還能估算出原子的大小約10^-8厘米,這是件了不起的事情,正由於湯姆遜模型能解釋當時很多的實驗事實,所以很容易被許多物理學家所接受。
土星模型 日本物理學家
長岡半太郎 (Nagaoka Hantaro,1865-1950)1903年12月5日在東京數學物理學會上口頭髮表,並於1904年分別在日、英、德的雜誌上刊登了《說明線狀和帶狀光譜及放射性現象的原子內的電子運動》的論文。他批評了
湯姆生 的模型,認為正負電不能相互滲透,提出一種他稱之為“土星模型”的結構——即圍繞帶
正電 的核心有電子環轉動的原子模型。一個大質量的帶正電的球,外圍有一圈等間隔分布著的電子以同樣的
角速度 做
圓周運動 。電子的徑向振動發射線光譜,垂直於
環面 的振動則發射
帶光譜 ,環上的電子飛出是β射線,
中心球 的正電粒子飛出是
α射線 。 這個土星式模型對他後來建立原子有核模型很有影響。1905年他從
α粒子 的電荷質量比值的測量等實驗結果分析,α粒子就是氦離子。1908年,瑞士科學家
里茲 (Leeds)提出磁原子模型。
他們的模型在一定程度上都能解釋當時的一些實驗事實,但不能解釋以後出現的很多新的實驗結果,所以都沒有得到進一步的發展。數年後,湯姆遜的“
葡萄乾蛋糕 模型”被自己的學生
盧瑟福 推翻了。
太陽系模型 英國物理學家
歐內斯特·盧瑟福 (Ernest Rutherford,1871~1937)1895年來到英國
卡文迪許實驗室 ,跟隨湯姆遜學習,成為湯姆遜第一位來自海外的研究生。盧瑟福好學勤奮,在湯姆遜的指導下,盧瑟福在做他的第一個實驗——
放射性 吸收實驗時發現了
α射線 。
盧瑟福設計的巧妙的實驗,他把
鈾 、
鐳 等
放射性元素 放在一個鉛制的容器里,在鉛容器上只留一個小孔。由於鉛能擋住放射線,所以只有一小部分射線從小孔中射出來,成一束很窄的放射線。盧瑟福在
放射線 束附近放了一塊很強的磁鐵,結果發現有一種射線不受磁鐵的影響,保持直線行進。第二種射線受磁鐵的影響,偏向一邊,但偏轉得不厲害。第三種射線偏轉得很厲害。
驗證湯姆生模型的實驗 盧瑟福 在放射線的前進方向放不同厚度的材料,觀察射線被吸收的情況。第一種射線不受磁場的影響,說明它是不帶電的,而且有很強的穿透力,一般的材料如紙、木片之類的東西都擋不住射線的前進,只有比較厚的鉛板才可以把它完全擋住,稱為
γ射線 。第二種射線會受到磁場的影響而偏向一邊,從磁場的方向可判斷出這種射線是帶正電的,這種射線的穿透力很弱,只要用一張紙就可以完全擋住它。這就是盧瑟福發現的
α射線 。第三種射線由偏轉方向斷定是帶負電的,性質同快速運動的電子一樣,稱為
β射線 。盧瑟福對他自己發現的α射線特別感興趣。他經過深入細緻的研究後指出,α射線是帶正電的
粒子流 ,這些粒子是
氦原子 的離子,即少掉兩個電子的氦原子。
“計數管”是來自德國的學生漢斯·蓋革(Hans Geiger,1882-1945))發明的,可用來測量肉眼看不見的帶電微粒。當帶電微粒穿過
計數管 時,計數管就發出一個電訊號,將這個電訊號連到報警器上,儀器就會發出“咔嚓”一響,指示燈也會亮一下。看不見摸不著的射線就可以用非常簡單的儀器記錄測量了。人們把這個儀器稱為蓋革計數管。藉助於蓋革計數管,盧瑟福所領導的曼徹斯特實驗室對
α粒子 性質的研究得到了迅速的發展。
1910年
馬斯登 (E.Marsden,1889-1970)來到
曼徹斯特大學 ,盧瑟福讓他用α粒子去轟擊
金箔 ,做練習實驗,利用螢光屏記錄那些穿過金箔的α粒子。按照湯姆遜的
葡萄乾蛋糕 模型,質量微小的電子分布在均勻的帶
正電 的物質中,而α粒子是失去兩個電子的氦原子,它的質量要比電子大幾千倍。當這樣一顆重型炮彈轟擊原子時,小小的電子是抵擋不住的。而金原子中的正物質均勻分布在整個原子體積中,也不可能抵擋住α粒子的轟擊。也就是說,
α粒子 將很容易地穿過金箔,即使受到一點阻擋的話,也僅僅是α粒子穿過金箔後稍微改變一下前進的方向而已。這類實驗,盧瑟福和蓋革已經做過多次,他們的觀測結果和湯姆遜的葡萄乾蛋糕模型符合得很好。α粒子受金原子的影響稍微改變了方向,它的散射角度極小。
馬斯登 和
蓋革 又重複著這個已經做過多次的實驗,奇蹟出現了!他們不僅觀察到了散射的α粒子,而且觀察到了被金箔反射回來的α粒子。在盧瑟福晚年的一次演講中曾描述過當時的情景,他說:“我記得兩三天后,蓋革非常激動地來到我這裡,說:‘我們得到了一些反射回來的α粒子......’,這是我一生中最不可思議的事件。這就像你對著捲菸紙射出一顆15英寸的炮彈,卻被反射回來的炮彈擊中一樣地不可思議。經過思考之後,我認識到這種反向散射只能是單次碰撞的結果。經過計算我看到,如果不考慮
原子質量 絕大部分都集中在一個很小的核中,那是不可能得到這個
數量級 的。”
盧瑟福所說的“經過思考以後”,不是思考一天、二天,而是思考了整整一、二年的時間。在做了大量的實驗和理論計算和深思熟慮後,他才大膽地提出了有核
原子模型 ,推翻了他的老師湯姆遜的實心帶電球原子模型。
盧瑟福檢驗了在他學生的實驗中反射回來的確是α粒子後,又仔細地測量了反射回來的α粒子的總數。測量表明,在他們的實驗條件下,每入射八千個α粒子就有一個α粒子被反射回來。用湯姆遜的實心帶電球原子模型和帶電粒子的散射理論只能解釋α粒子的小角散射,但對大角度散射無法解釋。多次散射可以得到大角度的散射,但計算結果表明,多次散射的幾率極其微小,和上述八千個α粒子就有一個反射回來的觀察結果相差太遠。
湯姆遜原子模型不能解釋α粒子散射,盧瑟福經過仔細的計算和比較,發現只有假設正電荷都集中在一個很小的區域內,α粒子穿過單個原子時,才有可能發生大角度的散射。也就是說,原子的正電荷必須集中在原子中心的一個很小的核內。在這個假設的基礎上,盧瑟福進一步計算了α散射時的一些規律,並且作了一些推論。這些推論很快就被蓋革和馬斯登的一系列漂亮的實驗所證實。
盧瑟福提出的原子模型像一個太陽系,帶正電的原子核像太陽,帶負電的電子像繞著太陽轉的行星。在這個“太陽系”,支配它們之間的作用力是
電磁相互作用力 。他解釋說,原子中帶正電的物質集中在一個很小的核心上,而且原子質量的絕大部分也集中在這個很小的核心上。當α粒子正對著原子核心射來時,就有可能被反彈回去。這就圓滿地解釋了α粒子的大角度散射。盧瑟福發表了一篇著名的論文《物質對α和β粒子的散射及原理結構》。
盧瑟福的理論開拓了研究原子結構的新途徑,為原子科學的發展立下了不朽的功勳。然而,在當時很長的一段時間內,盧瑟福的理論遭到物理學家們的冷遇。
盧瑟福原子模型 存在的致命弱點是正負電荷之間的
電場力 無法滿足穩定性的要求,即無法解釋電子是如何穩定地待在核外。1904年長崗半太郎提出的土星模型就是因為無法克服穩定性的困難而未獲成功。因此,當盧瑟福又提出有核原子模型時,很多科學家都把它看作是一種猜想,或者是形形色色的模型中的一種而已,而忽視了盧瑟福提出模型所依據的堅實的實驗基礎。
盧瑟福具有非凡的洞察力,因而常常能夠抓住本質作出科學的預見。同時,他又有十分嚴謹的科學態度,他從實驗事實出發作出應該作出的結論。盧瑟福認為自己提出的模型還很不完善,有待進一步的研究和發展。他在論文的一開頭就聲明:“在現階段,不必考慮所提原子的穩定性,因為顯然這將取決於原子的細微結構和帶電組成部分的運動。”當年他在給朋友的信中也說:“希望在一、二年內能對原子構造說出一些更明確的見解。”
玻爾模型 盧瑟福的理論吸引了一位來自丹麥的年輕人,他的名字叫尼爾斯·亨利克·大衛·
玻爾 Niels Henrik David Bohr,1885-1962),在盧瑟福模型的基礎上,他提出了電子在核外的量子化軌道,解決了原子結構的穩定性問題,描繪出了完整而令人信服的原子結構學說。
玻爾模型 玻爾出生在哥本哈根的一個教授家庭,1911年獲
哥本哈根大學 博士學位。1912年3-7月曾在盧瑟福的實驗室進修,在這期間孕育了他的原子理論。玻爾首先把
普朗克 的量子假說推廣到原子內部的能量,來解決盧瑟福原子模型在穩定性方面的困難,假定原子只能通過分立的
能量子 來改變它的能量,即原子只能處在分立的
定態 之中,而且最低的定態就是原子的正常態。接著他在友人
漢森 的啟發下從
光譜線 的組合定律達到定態躍遷的概念,他在1913年7、9和11月發表了長篇論文《論原子構造和分子構造》的三個部分。
玻爾的原子理論給出這樣的原子圖像:電子在一些特定的可能軌道上繞核作
圓周運動 ,離核愈遠能量愈高;可能的軌道由電子的角動量必須是
h/2π 的整數倍決定;當電子在這些可能的軌道上運動時原子不發射也不吸收能量,只有當電子從一個軌道躍遷到另一個軌道時原子才發射或吸收能量,而且發射或吸收的輻射是單頻的,輻射的頻率和能量之間關係由
E=hν 給出。玻爾的理論成功地說明了原子的穩定性和氫原子光譜線規律。
玻爾 的理論大大擴展了量子論的影響,加速了量子論的發展。1915年,德國物理學家
索末菲 (Arnold Sommerfeld,1868-1951)把玻爾的原子理論推廣到包括
橢圓軌道 ,並考慮了電子的質量隨其速度而變化的狹義相對論效應,導出光譜的
精細結構 同實驗相符。
1916年,
愛因斯坦 (Albert Einstein,1879-1955)從玻爾的原子理論出發用統計的方法分析了物質的吸收和發射輻射的過程,導出了
普朗克輻射定律 。愛因斯坦的這一工作綜合了量子論第一階段的成就,把普朗克、愛因斯坦、玻爾三人的工作結合成一個整體。
有核模型 盧瑟福的學生中有十幾位諾貝爾獎獲得者,著名的有
玻爾 、
查德威克 、
科克羅夫特 、
卡皮察 、
哈恩 等,原子核發現後,盧瑟福於1919年利用α射線轟擊氮原子核,在人類歷史上首次實現了“鍊金術”,第一次實現了核反應。從此元素在也不是永恆不變的東西了。盧瑟福通過一系列核反應發現了質子也就是
氫離子 是一切原子核的組成成分,並預言了中子,中子後來由他的學生查德威克發現,並且最終確立了以質子和中子為基礎的原子核結構模型。
泡利不相容原理 建立之後,
元素周期律 也得到了解釋。盧瑟福後來被稱為
核物理 之父。當然,就在英國轟轟烈烈的時候,不要忘記法國的
居里 夫婦,因為盧瑟福一系列發現所需要的原子炮彈就是放射性元素(尤其是鐳)放出的
α粒子 。此時的法國成立了居里實驗室,居里因車禍喪生,瑪麗因在放射性方面的成就再獲
諾貝爾化學獎 ,有名著《放射性通論》傳世,居里實驗室後由小居里夫婦:約里奧.居里和伊萊娜.居里主持,同樣人才濟濟,與三大聖地相比也毫不遜色。小居里夫婦運氣差了一點,發現中子被查德威克搶了先,發現正電子被
安德森 搶了先,發現核裂變被
哈恩 搶了先,機遇稍縱即逝。不過最後終於因為
人工放射性 的發現而獲得了諾貝爾獎。如今
放射性同位素 已經達到了幾千種,絕大多數都是人工產生的,這要歸功於小居里夫婦。
有核模型在實驗上取得了成功,但與當時的基礎理論存在嚴重的衝突。按
經典電動力學 ,由於電子作
圓周運動 ,一定會輻射電磁波,由於損失了能量,會在1ns時間內落入原子核,同時發射
連續光譜 。也就是說,理論上根本就不可能存在原子這種東西。但是原子的確存在,而且是穩定的,發射
線狀光譜 ,有大量的實驗事實和整個化學的支持。1911年,一個26歲的丹麥年輕人來到
劍橋 ,隨後轉到
曼徹斯特 的盧瑟福實驗室,從而了解到了原子核這一驚人發現。最終,他找到了有核模型的一個根本性的修正方法,既能說明原子的穩定性,又可以計算原子的半徑。他就是與愛因斯坦齊名的尼爾斯.玻爾。
1885年,瑞士的一位數學教師
巴爾末 發現了氫原子可見光譜的一個經驗公式,後由瑞典物理學家
里德伯 推廣為
里德伯公式 。1900年,德國物理學家普朗克提出了能量
量子化 的概念,解釋了黑體輻射譜。1905年,愛因斯坦提出了
光量子 概念。這些結論給玻爾很大的啟發。在這些啟示下,玻爾於1913年將量子化的概念用到
原子模型 中,提出了玻爾的
氫原子 模型。這一模型的關鍵是玻爾引入的三個假設。
定態假設 :電子只能在一些分立的軌道上運動,而且不會輻射
電磁波 。頻率條件假設:
能級 差與原子吸收(或放出)的
光子 能量相同。
角動量 量子化假設:電子的角動量是約花
普朗克常數 的整數倍。通過一系列推導,氫光譜之謎逐漸浮出水面,取得了巨大成功。玻爾因此榮獲1922年諾貝爾獎。儘管
玻爾模型 現在看來是比較粗糙的,但它的意義並不在於模型本身,而在於建立模型時引入的概念:
定態 、能級、躍遷等。玻爾引入了
對應原理 ,協調了氫原子模型與經典力學間的衝突。玻爾成功後,拒絕了導師盧瑟福的邀請,回到祖國,並在哥本哈根成立了研究所(後改名為玻爾研究所),玻爾研究所吸引了一大批來自世界各地的優秀青年物理學家,其中就包括量子論的創始人
海森伯 、
泡利 和
狄拉克 ,形成了濃郁的學術氣氛,此時的哥本哈根開始了對基本物理規律的探索。
直到現在,物理學仍然大體可以分為兩派,一派是以愛因斯坦為代表的經典物理學派,成員大致有
普朗克 、
德布羅意 、
薛丁格 等;一派是以玻爾為首的
哥本哈根學派 ,成員大致有
波恩 、海森伯、泡利、狄拉克等。自然,這場爭論還沒有結果。那么即玻爾氫原子之後,物理學又發生了什麼變化?兩位科學巨人爭論的焦點又是什麼?
查德威克模型 1935年,英國物理學家詹姆斯·查德威克(Sir James Chadwick 1891~1974)1891年生於英國。 曼徹斯大學畢業後,專攻放射性現象的研究。 後到劍橋大學,在盧瑟福教授的指導下,取得許多成績。 1935年因發現中子獲諾貝爾物理學獎。第二次世界大戰中,曾到美國從事核武器研究。 1974年逝世。
他發現,中子和質子質量相同,但是他不帶電。中子的存在解釋了為什麼原子的質量要比質子和電子的總質量大,他也因發現中子而獲1935年度諾貝爾獎。
原子是由帶正電荷的原子核和圍繞原子核運轉的帶負電荷的電子構成。原子的質量幾乎全部集中在原子核上。起初,人們認為原子核的質量(按照盧瑟福和玻爾的原子模型理論)應該等於它含有的帶正電荷的質子數。可是,一些科學家在研究中發現,原子核的正電荷數與它的質量居然不相等!也就是說,原子核除去含有帶正電荷的質子外,還應該含有其他的粒子。那么,那種“其他的粒子”是什麼呢?
數量關係 構成原子的結構粒子之間的數量關係
①質量數(A)=質子數(Z)+中子數(N)
注意:中子決定原子種類(同位素),質量數決定原子的近似相對原子質量,質子數(核電荷數)決定元素種類;原子最外層電子數決定整個原子顯不顯電性,也決定著
主族元素 的化學性質。
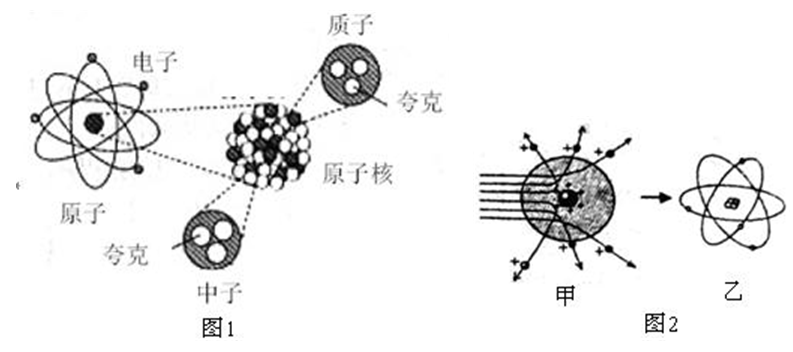 原子內部結構的示意圖
原子內部結構的示意圖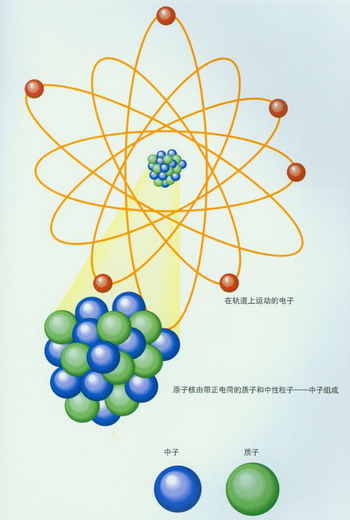
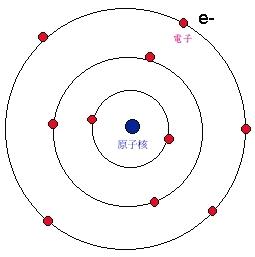 玻爾模型
玻爾模型
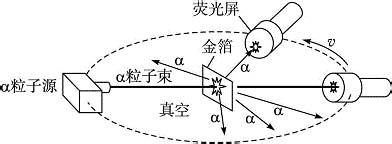 驗證湯姆生模型的實驗
驗證湯姆生模型的實驗