研究歷史,發現歷史,發展歷史,含量分布,物理性質,化學性質,基本性質,化合物,釩鹽,同位素,製備方法,套用領域,工業用途,釩電池,醫療用途,危害與防護,環境危害,對人體危害,危害防治,儲存運輸,行業發展建議,
研究歷史
發現歷史
釩先後被兩次發現。第一次是在1801年由
墨西哥城的礦物學教授節烈里瓦發現的。他發現它在亞釩酸鹽樣本中,這個樣本就是Pb
5(VO
4)
3Cl,由於這種新元素的
鹽溶液在加熱時呈現鮮艷的紅色,所以被取名為“愛麗特羅尼”,即“紅色”的意思,並將這種物品送到巴黎。然而,法國化學家推斷它是一種被污染的鉻礦石,所以沒有被人們公認。
 節烈里瓦
節烈里瓦第二次發現是在1830年,瑞典化學家塞夫斯特倫( Sefstrom.N.G,1787-1845)在研究斯馬蘭礦區的鐵礦時,用酸溶解
鐵,在殘渣中發現了釩。因為釩的化合物的顏色五顏六色,十分漂亮,所以就用
古希臘神話中一位叫凡娜迪絲“Vanadis”的美麗女神的名字給這種新元素起名叫“Vanadium”。中文按其譯音定名為釩。塞夫斯特倫、
維勒、貝采里烏斯等人都曾研究過釩,確認釩的存在,但他們始終沒有分離出
單質釩。後來到了
1830年寫佛寺特勒木在由
瑞典鐵礦石提煉出的鐵中發現了它,並肯定這是一種新元素稱之為釩,他能夠證明它是一種新的元素,並因此擊敗了一位與他競爭的化學家,來自在錫馬潘(
墨西哥)的沃勒(Friedrich Wöhler),他也在對另一種釩礦石進行研究。
 塞夫斯特倫
塞夫斯特倫1840年,俄羅斯礦物工程師蘇賓寫道“含
銅生鐵、黑銅、銅錠是含釩合金,由於釩的存在,使它們具有較高的硬度”。
1869年英國化學家羅斯科(Roscoe.H.E,1833-1915)用氫氣還原二氧化釩,才第一次製得了純淨的金屬釩,而且他證明了之前的金屬樣本其實是氮化釩(VN)。
1939年,在俄羅斯的彼爾姆斯克的含銅砂岩中也發現了釩。
發展歷史
在發現釩這種金屬後,人們慢慢了解到了它的性質,並開始將它套用到人們的生活當中。1882年,英國列·克魯佐特鋼鐵公司用含釩1.1%的煉鋼爐渣製得釩的磷酸鹽,年產量約60t。用戶是生產苯胺黑的染料廠。
在19世紀末20世紀初,俄羅斯開始利用碳還原法還原鐵和釩氧化物,首次製備出釩鐵合金(含V35%~40%)。1902~1903年俄羅斯進行了鋁熱法製取釩鐵的試驗。
1927年,美國的馬爾登和賴奇用金屬
鈣還原五氧化二釩(V2O5),第一次製得了含釩99.3%~99.8%的可鍛性金屬釩。
19世紀末,研究還發現了釩在鋼中能顯著改善鋼材的機械性能,從而使釩在工業上才得到廣泛套用。至20世紀初,人們開始大量開採釩礦。
到目前為止,世界上生產釩的礦石主要以釩
鈦磁鐵礦為主,在俄羅斯、南非、中國、澳大利亞及美國等國家都有豐富的釩鈦磁鐵礦資源,此外在釩鈾礦、
鋁土礦、磷岩礦、碳質頁岩、石油燃燒灰渣、廢催化劑等均可作為回收釩的資源
含量分布
釩的蹤跡遍布全世界。在地殼中,釩的含量並不少,平均在兩萬個原子中,就有一個釩原子,比銅、錫、鋅、鎳的含量都多,但釩的分布太分散了,幾乎沒有含量較多的礦床。在海水中,在
海膽等海洋生物體內,在
磁鐵礦中,在多種瀝青礦物和煤灰中,在落到地球的隕石和太陽的光譜線中,人們都發現了釩的蹤影。釩是地球上廣泛分布的微量元素,其含量約占地殼構成的0.02%,獲取相對容易。
世界釩鈦磁鐵礦的儲量很大,並且集中在少數幾個國家和地區,包括:獨立國協、美國、中國、
南非、挪威、瑞典、芬蘭、加拿大、澳大利亞,並且集中分布在南非洲、北美洲等地區。根據1988年美國礦業局統計資料表明,世界釩儲量基礎為1.6億噸(以釩計)。按目前的開採量計算,世界現探明的釩資源可供開採150年。從儲量基礎看,南非占46%,獨立國協占23.6%,美國占13.1%,中國占11.6%,其它國家的總和不足6%。
在南非,釩通常在
釩磁鐵礦的礦層中產生。這些礦層的平均品位為1.5%。據估計,南非釩儲量約為1250萬噸,世界第一。
礦物有釩酸鉀鈾礦、
褐鉛礦和
綠硫釩礦、石煤礦等。中國是釩資源比較豐富的國家,釩儲量為2055萬噸(以V
2O
5計)主要賦存釩鈦磁鐵礦中,且集中分布在四川的
攀枝花市、河北承德市。攀枝花釩儲量為1295萬噸,占中國釩儲量的63%。

元素在海水中的含量 | 0.0016ppm |
元素在太陽中的含量 | 0.4ppm |
地殼中含量 | 160ppm |
物理性質
釩是一種銀灰色的金屬。熔點1890±10℃,屬於高熔點
稀有金屬之列。它的沸點3380℃,純釩質堅硬,無磁性,具有
延展性,但是若含有少量的雜質,尤其是氮,氧,氫等,能顯著降低其可塑性。
原子體積(立方厘米/摩爾) | 8.78 |
相對原子質量 | 50.94 |
莫氏硬度 | 7 |
聲音在其中的傳播速率(m/s) | 4560 |
密度(g/cm3) | 5.96 |
熔點 | 1890±10℃ |
沸點 | 3000℃ |
原子序數 | 23 |
質子數 | 23 |
中子數 | 37 |
電子數 | 23 |
晶體結構:晶胞為體心立方晶胞,每個晶胞含有2個金屬原子。
晶胞參數:
a = 303 pm | α = 90° |
b = 303 pm | β = 90° |
c = 303 pm | γ = 90° |
化學性質
基本性質
釩的性質和鉭以及鈮相似,英國化學家羅斯科研究了它的性質,確定它與鉭和鈮相似,這為它們三個在
元素周期表中共建一個分族建立了基礎。釩屬於中等活潑的金屬,
化合價+2、+3、+4和+5。其中以5價態為最穩定,其次是4價態,五價釩的化合物具有氧化性能,低價釩則具有還原性。釩的價態越低還原性越強。
電離能為6.74電子伏特,具有耐鹽酸和硫酸的本領,並且在耐氣、耐鹽、耐水腐蝕的性能要比大多數不鏽鋼好。釩空氣中不被氧化,可溶於氫氟酸、
硝酸和
王水。
所屬周期 | 4 |
所屬族數 | VB |
電子層分布 | 2-8-11-2 |
電子層 | 2-8-11-2 |
價電子排布 | K-L-M-N |
氧化態 | V+3, V+4, V+5 ,V-3, V-1, V0, V+1, V+2 |
外圍電子層排布 | 3d3 4s2 |
核電荷數 | 23 |
電離能(kJ /mol):
M - M+ 650 | 650 |
M+ - M2+ | 1414 |
M2+ - M3+ | 2828 |
M4+ - M5+ | 6294 |
M5+ - M6+ | 12362 |
M6+ - M7+ | 14489 |
M7+ - M8+ | 16760 |
M8+ - M9+ | 19860 |
M9+ - M10+ | 22240 |
化合物
釩能分別以二、三、四、五價於氧結合,形成四種氧化物,一氧化釩,三氧化二釩,二氧化釩,五氧化二釩。他們的性質如下:
氧化物 | 顏色 | 密度g/cm3 | 熔點℃ | 生成熱
千卡每克分子 |
VO | 灰色 | 5.23-5.76 | 1830 | 106 |
V2O3 | 黑色 | 4.85 | 1960 | 300 |
VO2 | 深藍色 | 4.26. | 1545 | 171 |
V2O5 | 紅黃 | 3.32 | 690 | 373 |
高溫下,金屬釩很容易與氧和氮作用。當金屬釩在空氣中加熱時,釩氧化成棕黑色的
三氧化二釩、深藍色的四氧化二釩,並最終成為桔黃色的
五氧化二釩:
釩在氮氣中加熱至900~1300℃會生成氮化釩。釩與碳在高溫下可生成碳化釩,但碳化反應必須在真空中進行。當釩在真空下或惰性氣氛中與矽、硼、磷、砷一同加熱時,可形成相應的矽化物、硼化物、磷化物和砷化物。不同價態的釩離子有不同的顏色:(VO2)+顏色為淺黃色或深綠色,(VO)2+顏色為藍色,V3+為綠色,V2+為紫色。
釩鹽
我們平常說的釩鹽是指這幾種:含有V4+的,含有(VO3)-的(偏釩酸鹽),含有(VO4)3-的(正釩酸鹽),他們包括:偏釩酸銨、偏釩酸鈉、偏釩酸鉀、正釩酸鈉、焦釩酸鈉;四價鹽:硫酸氧釩、草酸氧釩;四氯化釩等鹵化釩類;三氯氧釩等鹵氧化釩類。
釩的鹽類的顏色真是五光十色,有綠的、紅的、黑的、黃的,綠的碧如翡翠,黑的猶如濃墨。如二價釩鹽常呈紫色;三價釩鹽呈綠色,四價釩鹽呈淺藍色,四價釩的鹼性衍生物常是棕色或黑色,而五氧化二釩則是紅色的。這些色彩繽紛的釩的化合物,被製成鮮艷的顏料:把它們加到玻璃中,製成
彩色玻璃,也可以用來製造各種墨水。

同位素
釩共有31種同位素,其中天然存在的是釩50和釩51,其他的全部通過人工合成。性質如下表:
| 符號 | Z(p) | N(n) | 質量(u) | 半衰期 | 原子核自旋 | 相對豐度 | 相對豐度的變化率 |
|---|
V40 | 23 | 17 | 40.01109 | | 2- | | |
V41 | 23 | 18 | 40.99978 | | 7/2- | | |
V42 | 23 | 19 | 41.99123 | <55 ns | 2- | | |
V43 | 23 | 20 | 42.98065 | 80ms | 7/2- | | |
V44 | 23 | 21 | 43.97411 | 111 ms | (2+) | | |
V44m | 270keV | 150ms | (6+) | | |
V45 | 23 | 22 | 44.965776 | 547 ms | 7/2- | | |
V46 | 23 | 23 | 45.9602005 | 422.50ms | 0+ | | |
V46m | 801.46 keV | 1.02 ms | 3+ | | |
V47 | 23 | 24 | 46.9549089 | 32.6min | 3/2- | | |
V48 | 23 | 25 | 47.9522537 | 15.9735 d | 4+ | | |
V49 | 23 | 26 | 48.9485161 | 329d | 7/2- | | |
V50 | 23 | 27 | 49.9471585 | 1.4×10a | 6+ | 0.00250 | 0.002487-0.002502 |
V51 | 23 | 28 | 50.9439595 | 穩定 | 7/2- | 0.99750 | 0.997498-0.997513 |
V52 | 23 | 29 | 51.9447755 | 3.743min | 3+ | | |
V53 | 23 | 30 | 52.944338 | 1.60 min | 7/2- | | |
V54 | 23 | 31 | 53.946440 | 49.8 s | 3+ | | |
V54m | 108keV | 900 ns | (5+) | | |
V55 | 23 | 32 | 54.94723 | 6.54s | (7/2-) | | |
V56 | 23 | 33 | 55.95053 | 216ms | (1+) | | |
V57 | 23 | 34 | 56.95256 | 0.35s | (3/2-) | | |
V58 | 23 | 35 | 57.95683 | 191 ms | 3+ | | |
V59 | 23 | 36 | 58.96021 | 75ms | 7/2- | | |
V60 | 23 | 37 | 59.96503 | 122ms | 3+ | | |
V60m1 | 150keV | 40ms | 1+ | | |
V60m2 | 101keV | >400 ns | | | |
V61 | 23 | 38 | 60.96848 | 47.0ms | 7/2- | | |
V62 | 23 | 39 | 61.97378 | 33.5ms | 3+ | | |
V63 | 23 | 40 | 62.97755 | 17ms | (7/2-) | | |
V64 | 23 | 41 | 63.98347 | 10 ms [>300 ns] | | | |
V65 | 23 | 42 | 64.98792 | 10ms | 5/2- | | |
製備方法
純的金屬釩一般是用鉀在高壓下將五氧化二釩還原而得到的。大多數釩是其它礦物加工時的副產品。工業上也可以以鋁,焦炭還原五氧化二釩生產純釩。
焦炭還原五氧化二釩生產純釩是將V2O5粉與高純碳粉混合均勻,加10%樟腦乙醚溶液或酒精,壓塊後放入真空碳阻爐或感應爐內。爐內真空壓力到6.66×10-1Pa後,升溫至1573K,保溫2h。冷卻後將反應產物破碎。根據第一次還原產物的組分再配入適量碳化釩或氧化釩進行二次還原。二次還原爐內的真空壓力為2.66×10-2Pa,溫度控制在1973~2023K之間,並保溫一段時間。真空碳還原法所得金屬釩的成分(質量分數m/%)為:釩99.5,氧0.05,氮0.01,碳0.1。釩收率可達98%~99%。
鋁熱還原法是將五氧化二釩和純鋁放在反應彈進行反應,生成釩鋁合金。釩合金在2063K的高溫和真空中脫鋁,可製得含釩94%~97%的粗金屬釩。
套用領域
工業用途
在鋼中加入百分之幾的釩,就能使鋼的彈性、強度大增 ,抗磨損和抗爆裂性極好,既耐高溫又抗奇寒,難怪在汽車、航空、鐵路、電子技術、國防工業等部門,到處可見到釩的蹤跡。此外,釩的氧化物已成為化學工業中最佳催化劑之一,有“化學麵包”之稱。主要用於製造高速切削鋼及其他
合金鋼和催化劑。把釩摻進鋼里,可以製成
釩鋼。釩鋼比普通鋼結構更緊密,韌性、彈性與機械強度更高。釩鋼製的穿甲彈,能夠射穿40厘米厚的
鋼板。但是,在
鋼鐵工業上,並不是把純的金屬釩加到鋼鐵中製成釩鋼,而是直接採用含釩的鐵礦煉成釩鋼。
 釩
釩釩具有眾多優異的物理性能和化學性能,因而釩的用途十分廣泛,有金屬“維生素”之稱。最初的釩大多套用於鋼鐵,通過細化鋼的組織和晶粒,提高晶粒粗化溫度,從而起到增加鋼的強度、
韌性和耐磨性。後來,人們逐漸又發現了釩在
鈦合金中的優異改良作用,並套用到航空航天領域,從而使得航空航天工業取得了突破性的進展。隨著科學技術水平的飛躍發展,人類對
新材料的要求日益提高。釩在非鋼鐵領域的套用越來越廣泛,其範圍涵蓋了航空航天、化學、電池、顏料、玻璃、光學、醫藥等眾多領域。
釩“現代工業的味素”,是發展現代工業、現代國防和現代科學技術不可缺少的重要材料。釩在冶金業中用量最大。從世界範圍來看,釩在鋼鐵工業中的消耗量占其生產總量的85%。與此同時,釩在化工、釩電池、航空航天等其它領域的套用也在不斷擴展,且具有良好發展前景。
釩在鋼鐵工業中主要用作合金添加劑,鋼鐵工業的發展變化對預測釩的需求至關重要。也就是說,鋼鐵對釩的需求趨勢決定了釩工業的命運。
中國鋼產量大約6億噸,平均每噸釩的消費強度增加10g,折合五氧化二釩約為1.1萬噸。而在美國,碳素鋼和高強度低合金鋼是鋼鐵工業中釩用量最大的鋼種,占鋼鐵工業釩用量的60%以上,其次是高合金鋼。
釩電池
釩電池是目前發展勢頭強勁的優秀綠色環保蓄電池之一(它的製造、使用及廢棄過程均不產生有害物質),它具有特殊的電池結構,可深度大電流密度放電;充電迅速;比能量高;價格低廉;套用領域十分廣闊:如可作為大廈、機場、程控交換站備用電源;可作為太陽能等清潔發電系統的配套儲能裝置;為潛艇、遠洋輪船提供電力以及用於電網調峰等。
釩電池成本與鉛酸電池相近,它還可製備兆瓦級電池組,大功率長時間提供
電能,因此釩電池在大規模儲能領域具有鋰離子電池、鎳氫電池不可比擬的性價比優勢。釩
電池生產工藝簡單,價格經濟,電性能優異,與製造複雜、價格昂貴的
燃料電池相比,無論是在大規模儲能還是電動汽車動力電源的套用前景方面,都更具競爭實力。
與其它化學電源相比,釩電池具有明顯的優越性,主要優點如下:1、功率大:通過增加單片電池的數量和電極面積,即可增加釩電池的功率,目前美國商業化示範運行的釩電池的功率已達6兆瓦。2、容量大:通過任意增加電解液的體積,即可任意增加釩電池的電量,可達吉瓦時以上;通過提高電解液的濃度,即可成倍增加釩電池的電量。3、效率高:由於釩電池的電極催化活性高,且正、負極活性物質分別存儲在正、負極電解液儲槽中,避免了正、負極活性物質的自放電消耗,釩電池的充放電能量轉換效率高達75%以上,遠高於鉛酸電池的45%。4、壽命長:由於釩電池的正、負極活性物質只分別存在於正、負極電解液中,充放電時無其它電池常有的物相變化,可深度放電而不損傷電池,電池使用壽命長。目前商業化示範運行時間最長的釩電池模組已正常運行超過9年,充放循環壽命超過18000次,遠遠高於固定型鉛酸電池的1000次。5、回響速度快:釩電池堆里充滿電解液可在瞬間啟動,在運行過程中充放電狀態切換隻需要0.02秒,回響速度1毫秒。6、可瞬間充電:通過更換電解液可實現釩電池瞬間充電。7、安全性高:釩電池無潛在的爆炸或著火危險,即使將正、負極電解液混合也無危險,只是電解液溫度略有升高。8、成本低:除離子膜外,釩電池部件多為廉價的碳材料、工程塑膠,材料來源豐富,易回收,不需要貴金屬作電極催化劑,成本低。9、釩電池選址自由度大,可全自動封閉運行,無污染,維護簡單,運營成本低。
醫療用途
釩是人體必需的微量元素在人體內含量大約為25mg,在體液pH4~8條件下 釩的主要形式為VO
-3,即亞
釩酸離子(metavandate);另一為+5價氧化形式VO
4- 3即正釩酸離子(orthovanadate)。由於生物效應相似,一般釩酸鹽(Va)統指這兩種+5價氧化離子。VO
-3經離子轉運系統或自由進入細胞,在胞內被
還原型谷胱甘肽還原成VO
2+(+4價
氧化態),即氧釩根離子(vanadyl)。由於磷酸和Mg
2+離子在細胞內廣泛存在VO
-3與磷酸結構相似,VO
2+與Mg
2+大小相當(
離子半徑分別為160pm和165pm),因而二者就有可能通過與磷酸和Mg
2+競爭結合配體干擾細胞的生化反應過程。例如,抑制ATP磷酸
水解酶、核糖
核酶磷酸果糖激酶、磷酸甘油醛激酶、6-磷酸葡萄糖酶、磷酸
酪氨酸蛋白激酶。所以,釩進入細胞後具有廣泛的生物學效應。釩化合物又具有合成相對容易、價格較低廉的優勢,因此研究釩化合物的降壓機制有利於對釩的開發和利用。
國內外對釩化合物的研究已有 20 多年的歷史,早期多集中在釩化合物降糖作用的研究,也有報導釩能舒張豬的離體冠狀動脈。近期國外有些研究開始用釩化合物治療
原發性高血壓大鼠,已經取到肯定的實驗結果。有報導認為 BMOV 可以降低 SHR 的
高胰島素血症和高血壓。另有學者採用 SHR 和WKY 大鼠對比探討釩化合物對血壓的藥物療效,結果可見釩化合物使收縮壓降低(149±3/mmHg,非治療組184±3mmHgP<0.0001)。
釩是正常生長可能必需的礦物質,釩有多種價態,有生物學意義的是四價和五價態。四價態釩為氧釩基陽離子,易與蛋白質結合結合形成複合物,而防止被氧化。五價態釩為氧釩基陽離子,易與其他生物物質結合形成複合物,在許多生化過程中,釩酸根能與
磷酸根競爭,或取代磷酸根。釩酸鹽以被維生素C、谷胱甘肽或NADH還原。其在人體健康方面的作用,營養學界,醫學界至今仍不是很清楚,仍處在進一步發掘的過程中,但可以確定,釩有重要作用。一般認為,它可能有助於防止膽固醇蓄積、降低過高的血糖、防止
齲齒、幫助製造紅血球等。每天會經
尿液流失部分釩。
釩在人體內含量極低,體內總量不足1mg。主要分布於內臟,尤其是肝、腎、甲狀腺等部位,骨組織中含量也較高。人體對釩的正常需要量為100μg/d。
釩在胃腸吸收率僅5%,其吸收部位主要在上消化道。此外環境中的釩可經皮膚和肺吸收入體中。血液中約95%的釩以離子狀態(VO2+)與轉鐵蛋白結合而送輸,因此釩與鐵在體內可相互影響。
釩對骨和牙齒正常發育及鈣化有關,能增強牙對齲牙的抵抗力。釩還可以促進糖代謝,刺激釩酸鹽依賴性NADPH
氧化反應,增強
脂蛋白脂酶活性,加快腺苷酸環化酶活化和胺基酸轉化及促進
紅細胞生長等作用。因此釩缺乏時可出現牙齒、骨和軟骨發育受阻。肝內磷脂含量少、
營養不良性水腫及甲狀腺代謝異常等。
人類攝入的釩只有少部分被吸收,估計吸收的釩不足攝入量的5%,大部分由糞便排出。攝入的釩於小腸與低
分子量物質形成複合物,然後在血中與血漿運
鐵蛋白結合,血中釩很快就運到各組織,通常大多組織每克濕重含釩量低於10ng。吸收入體內的80%-90%由尿排出,也可以通過膽汁排出,每克膽汁含釩為0.55-1.85ng。
有實驗顯示,釩調節(Nak)-ATP酶、調節磷醯
轉移酶、
腺苷酸環化酶、
蛋白激酶類的
輔因子,與體內激素,蛋白質,脂類代謝關係密切。可抑制年幼大鼠肝臟合成膽固醇。可能存在以下作用:1.防止因過熱而疲勞和中暑。2.促進骨骼及牙齒生長。3.協助
脂肪代謝的正常化。4.預防
心臟病突發。5.協助神經和肌肉的正常運作。
人的膳食中每天可提供不足30μg的釩,多為15μg,因此考慮每天從膳食中攝取10μg釩就可以滿足需要。一般不需要特別補充;需要提醒的是,攝取合成的釩容易引起中毒;另外吸菸會降低釩的吸收。
釩在體內不易蓄積,因而由食物攝入引起的中毒十分罕見,但每天攝入10mg以上或每克食物中含釩10 -20微克,可發生中毒。通常可出現生長緩慢、腹瀉、攝入量減少和死亡。
最被認可的釩缺乏表現來自於1987年報導的對山羊和大鼠的研究,釩缺乏的山羊表現出流產率增加和產奶量降低。大鼠實驗中,釩缺乏引起生長抑制,甲狀腺重量與體重的比率增加以及血漿
甲狀腺激素濃度的變化。對於人體缺乏症研究尚不明確,有的研究認為它的缺乏可能會導致心血管及腎臟疾病、傷口再生修復能力減退和新生兒死亡。
危害與防護
環境危害
釩在天然水中的濃度很低,一般河水中為0.01~20ppb,平均為1ppb。海水含釩量為0.9~2.5ppb。儘管水體中可溶性的釩含量很低,但是水中懸浮物含釩量是很高的。懸浮物的沉積導致水中釩向底質遷移,並使水體得到淨化。土壤中的釩主要以VO3-陰離子狀態存在。土壤的氧化性越高、鹼性越大,釩越易形成VO3-離子。當土壤的酸度增大時,VO3-離子易轉變成多釩酸根複合陰離子。它們都容易被粘土和土壤膠體及腐殖質固定而失去活性,釩在土壤中的遷移性較弱。
對人體危害
金屬釩的毒性很低。釩化合物(釩鹽)對人和動物具有毒性,其毒性隨化合物的原子價增加和溶解度的增大而增加,如五氧化二釩為高毒,可引起呼吸系統、神經系統、胃腸和皮膚的改變。
危害防治
皮膚接觸:脫去污染的衣著,用肥皂水及清水徹底沖洗。眼睛接觸:立即翻開上下眼瞼,用流動清水沖洗15分鐘。就醫。吸入:脫離現場至空氣新鮮處,用水漱洗鼻咽部的粉塵。就醫。食入:誤服者就醫。對症治療。
儲存運輸
儲存於陰涼、通風的庫房。遠離火種、熱源。應與氧化劑、酸類、食用化學品分開存放,切忌混儲。配備相應品種和數量的消防器材。儲區應備有合適的材料收容泄漏物。
行業發展建議
1、拓展釩的套用領域,發展高技術釩產品,加快釩在電池、超導等高技術行業的套用研發。
2、引導企業發展釩產品深加工。從政策上或相關行業(如建築行業)標準上,加大力度鼓勵高釩鋼的使用,推動高釩鋼技術的升級,向國際水平靠攏。
3、加強國內釩產業的監管與整合力度,從規模與環保上設定行業準入門檻。對那些不合法的投機者,進行嚴厲打擊,以保護礦脈的完整性與可開採性,確保市場秩序。
第85屆國際釩技術委員會會員大會在京召開(2013年9月25日),大會分析認為,未來五年,全球釩產品的市場消費結構不會有較大的改變,仍然是鋼鐵(90-93%)、有色合金(4-5%)、化學與功能材料(3-4%)三大套用領域,但產品品種將在延伸的基礎上更加系列化、多樣化、功能化, 釩產品的製造、消費與研發中心將轉移至中國,中國高端釩產品將會基本實現國產化,釩氮合金與釩功能材料的消費比例將會進一步增加,中國國內釩產品的市場消費總量將會由目前的5~6萬噸/年,增長到2015年的8~9萬噸/年;全球釩產品的市場消費總量將會由目前的12-13萬噸/年,提高到16-18萬噸/年(2015年);釩電池儲能技術預計在2018年左右開始形成產業化套用,屆時釩產品市場又將增加一大消費領域,世界釩產業的前景將更加光明。
 節烈里瓦
節烈里瓦 塞夫斯特倫
塞夫斯特倫
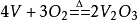



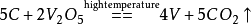

 釩
釩
