定義
電子在原子中處於不同的能級狀態,粗略說是分層分布的,故電子層又叫能層。電子層可用n(n=1、2、3…)表示,n=1表明第一層電子層(K層),n=2表明第二電子層(L層),依次n=3、4、5時表明第三(M層)、第四(N層)、第五(O層)。一般隨著n值的增加,即按K、L、M、N、O…的順序,電子的
能量逐漸升高、電子離
原子核的平均距離也越來越大。電子層可容納最多電子的數量為2n
2。
 電子層
電子層電子層不能理解為電子在核外一薄層空間內運動,而是按電子出現幾率最大的區域,離核遠近來劃分的。
亨利·莫斯萊和
巴克拉首次於X-射線吸收研究的實驗中發現電子層。巴克拉把它們稱為K、L和、M(以英文字母排列)等電子層(最初 K 和 L 電子層名為 B 和 A,改為 K 和 L 的原因是預留空位給未發現的電子層)。這些字母后來被n值1、2、3等取代。
名字起源
電子層(atomic orbital)的名字起源於
玻爾模式中,電子被認為一組一組地圍繞著
核心以特定的距離旋轉,所以軌跡就形成了一個殼。
電子在
原子核外排布時,要儘可能使電子的
能量最低。一般來說,離核較近的電子具有較低的
能量,隨著電子層數的增加,電子的能量越來越大;同一層中,各亞層的能量是按s、p、d、f的次序增高的。這兩種作用的總結果可以得出電子在
原子核外排布時遵守下列次序:1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d.......
排布原理
泡利不相容原理
我們已經知道,一個電子的運動狀態要從4個方面來進行描述,即它所處的電子層、
電子亞層、電子云的伸展方向以及電子的自旋方向。在同一個原子中沒有也不可能有運動狀態完全相同的兩個電子存在,這就是泡利不相容原理所告訴大家的。根據這個規則,如果兩個電子處於同一軌道,那么,這兩個電子的
自旋方向必定相反。也就是說,每一個軌道中只能容納兩個
自旋方向相反的電子。根據泡利不相容原理,我們得知:s亞層只有1個軌道,可以容納兩個自旋相反的電子;p亞層有3個軌道,總共可以容納6個電子;d亞層有5個軌道,總共可以容納10個電子。我們還得知:第一電子層(K層)中只有1s亞層,最多容納兩個電子;
 電子層
電子層注意: 第二電子層(L層)中包括2s和2p兩個亞層,總共可以容納8個電子(所以8個電子時為穩定狀態);
第3電子層(M層)中包括3s、3p、3d三個亞層,總共可以容納18個電子……第n層總共可以容納2n2個電子。
能量最低原理
在滿足
泡利原理前提下,電子將按照使體系總能量最低的原則填充。量子化學計算結果表明,當有d電子填充時(例如第四周期Ni,3d軌道能E3d=-18.7eV,而E4s=-7.53eV),E3d<E4s;當沒有d電子填充時(例如第四周期K,有E3d=-0.64eV,而E4s=-4.00eV)E3d>E4s,發生了
能級“倒置”現象,其他第五、六、七周期也有類似情況。所以不能簡單地說電子是按軌道能由低到高的次序填入,但總可以說是按n+0.7l 值由小到大的次序填充。其中n是主量子數,l是
角量子數。
洪特規則
從
光譜實驗結果總結出來的洪特規則有兩方面的含義:一是電子在
原子核外排布時,將儘可能分占不同的軌道,且
自旋平行;洪特規則的第二個含義是對於同一個電子亞層,當
電子排布處於
全滿(s2、p6、d10、f14)
半滿(s1、p3、d5、f7)
全空(s0、p0、d0、f0)時比較穩定。
如果仔細觀察元素周期表,可以發現每個元素下面都有電子亞層的電子排布數量,之所以會有"奇怪的現象",是因為3d層能量比4s層高,稱為"
能級交錯現象"
電子亞層
通過對許多元素的
電離能的進一步分析,人們發現,在同一電子層中,電子的能量還稍有差異,
電子云的形狀也不相同。因此電子層仍可進一步分成一個或n個電子亞層。這一點在研究元素的
原子光譜中得到了證實。
電子亞層分別用s、p、d、f等符號表示。不同亞層的電子云形狀不同。s亞層的電子云是以
原子核為中心的球形,p亞層的電子云是紡錘形,d亞層為花瓣形,f亞層的電子云形狀比較複雜。
同一電子層不同亞層的
能量按s、p、d、f序能量逐漸升高。
K層只包含一個s亞層;L層包含s和p兩個亞層;M層包含s、p、d三個亞層;N層包含s、p、d、f四個亞層。
磁量子數m
磁量子數m決定原子軌道(或電子云)在空間的伸展方向。當l給定時,m的取值為從-l到+l之間的一切整數(包括0在內),即0,±1,±2,±3,…± l,共有2l+1個取值。即原子軌道(或電子云)在空間有2l+1個伸展方向。原子軌道(或電子云)在空間的每一個伸展方向稱做一個軌道。例如,l=0 時,s電子云呈球形對稱分布,沒有方向性。m只能有一個值,即m=0,說明s亞層只有一個軌道為s軌道。當l=1時,m可有-1,0,+1三個取值,說明 p電子云在空間有三種取向,即p亞層中有三個以x,y,z軸為對稱軸的px,py,pz軌道。當l=2時,m可有五個取值,即d電子云在空間有五種取向, d亞層中有五個不同伸展方向的d軌道.
 電子層
電子層原子中的電子除繞核作高速運動外,還繞自己的軸作自旋運動。電子的自旋運動用
自旋量子數ms表示。ms 的取值有兩個,+1/2和-1/2。說明電子的自旋只有兩個方向,即順時針方向和逆時針方向。通常用“↑”和“↓”表示。
綜上所述,原子中每個電子的
運動狀態可以用n,l,m,ms四個量子數來描述。主量子數n決定電子出現幾率最大的區域離核的遠近(或電子層),並且是決定電子
能量的主要因素;角
量子數l決定原子軌道(或電子云)的形狀,同時也影響電子的能量;磁
量子數m決定原子軌道(或電子云)在空間的伸展方向;
自旋量子數ms決定
電子自旋的方向。因此四個
量子數確定之後,電子在核外空間的運動狀態也就確定了。
主量子數n 1 2 3 4
電子層 K L M N
角量子數l 0 1 2 3
電子亞層 s p d f
每個亞層中軌道數目 1 3 5 7
每個亞層最多容納電子數 2 6 10 14
相關關係
元素周期表特徵
在
元素周期表上每一橫行叫做周期元素在那個周期是元素的電子層數決定的!所以元素周期表只有7個周期。
在元素周期表上每一縱行叫做族元素在那個族是元素的電子層的
最外層電子數決定的!但上述規律也並不是完全適用於所有元素,
副族元素中就有原子不符合此規律,如第46號元素鈀位於第五周期卻只有4個電子層
 電子層
電子層(化學元素表是
門捷列夫的重要成就,我也順便介紹一下他。
俄羅斯化學家門捷列夫(1834.2.8~1907.2.2),生在
西伯利亞。他從小熱愛勞動,喜愛大自然,學習勤奮。
元素周期表產生
1860年門捷列夫在為著作《化學原理》一書考慮寫作計畫時,深為無機化學的缺乏系統性所困擾。於是,他開始蒐集每一個已知元素的性質資料和有關數據,把前人在實踐中所得成果,凡能找到的都收集在一起。人類關於元素問題的長期實踐和認識活動,為他提供了豐富的材料。他在研究前人所得成果的基礎上,發現一些元素除有特性之外還有共性。例如,已知鹵素元素的氟、氯、溴、碘,都具有相似的性質;
鹼金屬元素鋰、鈉、鉀暴露在空氣中時,都很快就被氧化,因此都是只能以化合物形式存在於
自然界中;有的金屬例銅、銀、金都能長久保持在空氣中而不被腐蝕,正因為如此它們被稱為
貴金屬。
 電子層
電子層於是,門捷列夫開始試著排列這些元素。他把每個元素都建立了一張長方形紙板卡片。在每一塊長方形紙板上寫上了元素符號、原子量、元素性質及其化合物。然後把它們釘在實驗室的牆上排了又排。經過了一系列的排隊以後,他發現了元素化學性質的規律性。
因此,當有人將門捷列夫對
元素周期律的發現看得很簡單,輕鬆地說他是用玩撲克牌的方法得到這一偉大發現的,門捷列夫卻認真地回答說,從他立志從事這項探索工作起,一直花了大約20年的功夫,才終於在1869年發表了元素周期律。他把
化學元素從雜亂無章的迷宮中分門別類地理出了一個頭緒。此外,因為他具有很大的勇氣和信心,不怕名家指責,不怕嘲諷,勇於實踐,敢於宣傳自己的觀點,終於得到了廣泛的承認。為了紀念他的成就,人們將美國化學家希伯格在1955年發現的第101號新元素命名為Mendelevium,即“鍆”。)
其它
介紹
原子核外的電子總是有規律的排布在各自的軌道上。原子軌道的種類主頁面:原子軌道作為
薛丁格方程的解,原子軌道的種類取決於主量子數(n)、角量子數(l)和
磁量子數(ml)。其中,主量子數就相當於電子層,角量子數相當於亞層,而磁量子數決定了原子軌道的伸展方向。另外,每個原子軌道里都可以填充兩個電子,所以對於電子,需要再加一個
自旋量子數 (ms),一共四個量子數。n可以取任意正整數。在n取一定值時,l可以取小於n的
自然數,ml可以取±l。不論什麼軌道,ms都只能取±1/2,兩個
電子自旋相反。因此,s軌道(l=0)上只能填充2個電子,p軌道(l=1)上能填充6個,一個亞層填充的
電子數為4l+2。具有角量子數0、1、2、3的軌道分別叫做s軌道、p軌道、d軌道、f軌道。之後的軌道名稱,按字母順序排列,如l=4時叫g軌道。排布的規則電子的排布遵循以下三個規則:
能量最低原理整個體系的能量越低越好。一般來說,新填入的電子都是填在
能量最低的空軌道上的。Hund規則電子儘可能的占據不同軌道,
自旋方向相同。
Pauli不相容原理:在同一體系中,沒有兩個電子的四個量子數是完全相同的。同一亞層中的各個軌道是簡併的,所以電子一般都是先填滿能量較低的亞層,再填能量稍高一點的亞層。各亞層之間有能級交錯現象:1s、2s2p、3s3p、4s3d4p、5s4d5p、6s4f5d6p、7s5f6d7p、8s5g6f7d8p;有幾個原子的排布不完全遵守上面的規則,如:Cr:[Ar]3d54s1;這是因為同一亞層中,全充滿、半充滿、全空的狀態是最穩定的。這種方式的整體能量比3d44s2要低,因為所有亞層均處於穩定狀態。排布示例以鉻為例:鉻原子核外有24個電子,可以填滿1s至4s所有的軌道,還剩餘4個填入3d軌道:1s22s22p63s23p64s23d4;由於半充滿更穩定,排布發生變化:1s22s22p63s23p64s13d5;除了6個價電子之外,其餘的電子一般不發生化學反應,於是簡寫為: [Ar]4s13d5;這裡,具有氬的電子構型的那18個電子稱為“原子實”。一般把主量子數小的寫在前面:[Ar]3d54s1電子構型對性質的影響:主頁面:元素周期律;電子的排布情況,即電子構型,是元素性質的決定性因素。為了達到全充滿、半充滿、全空的穩定狀態,不同的原子選擇不同的方式。具有同樣價電子構型的原子,理論上得或失電子的趨勢是相同的,這就是同一族元素性質相近的原因;同一族元素中,由於周期越高,價電子的能量就越高,就越容易失去。元素周期表中的區塊是根據價電子構型的顯著區別劃分的。不同區的元素性質差別同樣顯著:如s區元素只能形成簡單的離子,而d區的過渡金屬可以形成配合物。
 電子層
電子層排布規律
E1s<E2s<E2p<E3s<E3p<E4s<E3d<E4p<E5s<E4d<E5p<E6s<E4f<E5d;規則E:np>(n-1)d>(n-2)f>ns根據這個排電子所在的原子軌道離核越近,電子受原子核吸收力越大,電子的能量越低。反之,離核越遠的軌道,電子的能量越高,這說明電子在不同的原子軌道上運動時其能量可能有所不同。原子中電子所處的不同能量狀態稱原子軌道的能級。根據原子軌道能級的相對高低,可劃分為若干個電子層,K、L、M、N、O、P、Q…. 同一電子層又可以劃分為若干個電子亞層,如s、p、d、f等。每個電子亞層包含若干個原子軌道。原子軌道的能級可以通過光譜實驗確定,也可以套用薛丁格方程求得。原子軌道的能級與其所在電子的電子層及電子亞層有關,還與原子序數有關。
 電子層
電子層1、不同電子層能級相對高低K<L<M<N…2、同一電子層不同亞層:ns<np<nd<nf…3、同一亞層內各原子軌道能級相同,稱為簡併軌道。4、原子軌道能級隨原子序數增大而降低。電子軌道亞層在周期表上也有,就是那個S、P、D、F、G等就是亞層排布。S亞層最多容納兩個電子,P層最多6個,依次為10個、14個。另外在分析時候還要考慮能級交錯。給你舉個例子,鐵的亞層在書上標的是3D64S2,這就是說,鐵的第四層只用到S層,有兩個電子,而第三層用到D層,D層有六個,這說明第三層的S、P層都飽和,所以S層有2個,P層有6個,D層有6個(上面分析的)所以鐵的第三層有2+6+6=14個電子。先說說金屬。元素周期表的前兩個族除了氫之外都是金屬元素。由於它們是主族元素,它們的原子核外的電子層里電子都是飽和的,除了最外層。這樣看,它們最外層的電子很容易全部失去,因此它們的正價很穩定,而且只有一個,等於最外層的電子數。除了前兩個族的元素大部分為金屬元素外,還有過渡元素。
排列特徵
,比如鐵
酸根,
錳酸根和
高錳酸根等。在這種高價態
過渡元素形成的酸中,由於
過渡金屬最外層和次外層的電子全部失去,這些酸大部分都有強
氧化性,比如
重鉻酸高錳酸等。在化學推斷題中,經常使用這些課本中不常見的氧化劑,多了解它們的性質對今後做題很有幫助。在第三
主族到第六主族裡都有
金屬元素存在,它們是因為隨著
質子數增多,都顯示了或多或少的
金屬性。在元素周期表中
非金屬元素都是寫在綠框裡的,很醒目。非
金屬元素都一得電子,一般在與金屬元素形成的化合物中顯負價。但這不代表它們不顯正價。在遇到極強的氧化劑時,也會顯正價,比如
七氧化二氯。這些正價的
氧化物溶於水也會形成相應的酸。這些以高價非金屬元素為主元素的酸一般也都有強
氧化性,象
氯酸,
濃硫酸。但是,由於氟的
非金屬性最強,沒有氧化劑可以把它氧化,所以氟沒有正價。請注意在金屬與非金屬交界的地方,有一些元素,它們呈梯形排列,有鋁鍺銻和硼矽砷碲。它們兼有
金屬性和
非金屬性。這是由它們所在的特殊位置決定的。它們正處在金屬與非金屬交界處,是元素由金屬向非金屬過渡的中間元素。仔細觀察鑭系和
錒系元素。這些元素之所以被排在周期表的同一個格里,是因為它們的性質很相似。它們最外層電子層
電子數相同,電子的變化都發生在次外層或倒數第三層。科學家們為了
周期。
能量
如果沒有外界能量輸入的話,電子會儘可能降低自身能量。能量低的電子在離核較近的區域運動,能量高的電子在離核較遠的區域運動。而電子總是儘先排布在能量最低的電子層里。也就是說,在通常情況下,低層有了空位,高層的電子會釋放光子降低能量填補到低層去(在外面跑大圈是很累的),
主量子數n
n相同的電子為一個電子層,電子近乎在同樣的空間範圍內運動,故稱主量子數。
原子核外電子的排布
原子核外電子的運動特徵
①速度:速度非常快,接近光速;
②沒有固定的軌跡
意義:用來表示電子在一定時間內在核外空間各處出現機會的模型。
電子云密度大的地方表示電子出現的幾率大。
核外電子的排布規律
電子層的劃分
電子層(用n表示):1、2、3、4、5、6……
電子層的符號:K、L、M、N、O、P ……
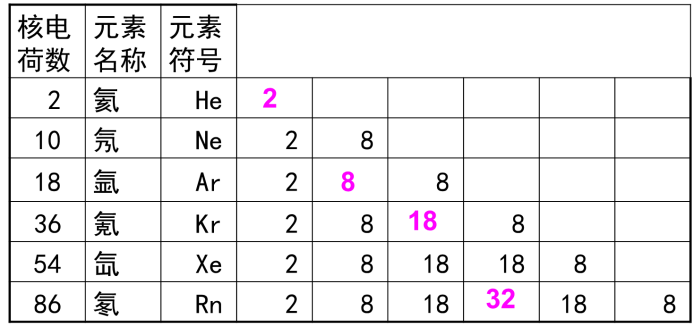 元素核外電子排布
元素核外電子排布各電子層最多容納的電子數是2n2個(表示電子層)。最外層電子數不超過8個(K 層是最外層時,最多不超過2個),次外層電子數目不超過18個 ,倒數第三層不超過32個。
核外電子總是先排布在能量最低的電子層,然後由里向外從能量低的電子層逐步向能量高的電子層排布。
 電子層
電子層 電子層
電子層 電子層
電子層 電子層
電子層 電子層
電子層 電子層
電子層 元素核外電子排布
元素核外電子排布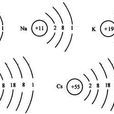
 電子層
電子層 電子層
電子層 電子層
電子層 電子層
電子層 電子層
電子層 電子層
電子層 元素核外電子排布
元素核外電子排布