簡介
電子排序,即
電子組態,亦即
電子構型,指
電子在
原子、
分子或其他物理結構中的每一層
電子層上的排序及排列形態。
電子能夠由發射或吸收一個
量子的能量從一個
能級躍遷到另一個能級,其形式是一個
光子。由於
泡利不相容原理,沒有兩個以上的電子可以存在於某個原子軌道(軌道不等於電子層);因此,一個電子只可跨越到另有空缺位置的軌道。
知道不同的原子的電子構型有助了解
元素周期表中的元素的結構。這個概念也有用於描述約束原子的多個
化學鍵。在散裝物料的研究中這一理念可以說明
雷射器和
半導體的奇特性能。
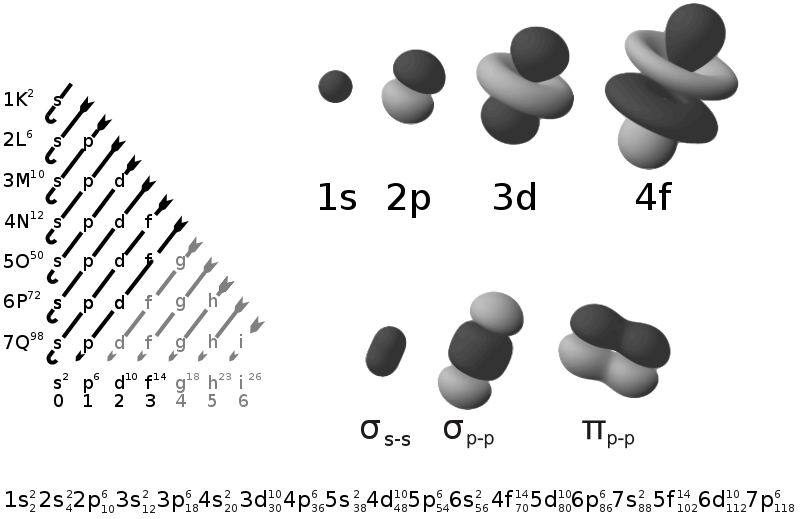
原子軌道的種類
作為
薛丁格方程的解,原子軌道的種類取決於
主量子數(n)、
角量子數(l)和
磁量子數(m
l)。其中,主量子數就相當於電子層,角量子數相當於亞層,而磁量子數決定了原子軌道的伸展方向。另外,每個原子軌道里都可以填充兩個電子,所以對於電子,需要再加一個
自旋量子數(m
s),一共
四個量子數。
n可以取任意
正整數。在n取一定值時,l可以取小於n的
自然數,m
l可以取 -l到 +l。不論什麼軌道,m
s都只能取±1/2,兩個電子自旋相反。因此,s軌道(l=0)上只能填充2個電子,
p軌道(l=1)上能填充6個,一個軌道填充的電子數為4l+2。
具有角量子數0、1、2、3的軌道分別叫做s軌道、
p軌道、d軌道、f軌道。之後的軌道名稱,按字母順序排列,如角量子數l=4時叫g軌道。
排布的規則
電子的排布遵循以下規則:
1s | | | | |
2s | | | | 2p |
3s | | | | 3p |
4s | | | 3d | 4p |
5s | | | 4d | 5p |
6s | | 4f | 5d | 6p |
7s | | 5f | 6d | 7p |
8s | 5g | 6f | 7d | 8p |
電子構型對性質的影響
電子的排布情況,即“
電子構型”,是元素性質的決定性因素。為了達到全充滿、半充滿、全空的穩定狀態,不同的原子選擇不同的方式。具有同樣
價電子構型的原子,理論上得或失電子的趨勢是相同的,這就是同一族元素性質相近的原因;同一族元素中,由於周期越高,價電子的能量就越高,就越容易失去。