基本性質
相對質量1.007
電荷+1 元電荷(+ 1.60217733 × 10
-19庫侖)
質子數=原子序數(就是元素序號)=核外電子數,中子數=質量數-質子數
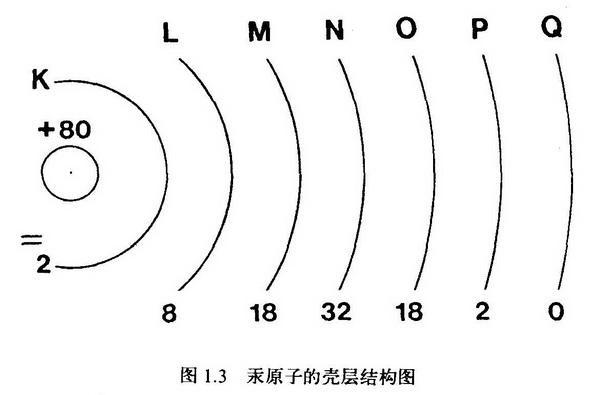
1.氧元素是第二周期的元素,所以氧原子只有2個電子層內從層2個,外層6個,共8個電子;而氧原子的質子數也是8個。符合核外電子數=質子數,所以氧原子本身是電中性的,不帶電荷。
事實上所有的原子都是電中性的,都符合【質子數】=【原子序數】=【核電荷數】=【核外電子數】
2.每種物質中的原子的核外電子數一定是等於該原子的質子數,但是這並不是說這種結構是穩定的結構,這只是元素原子的一個特性。比如Na原子就非常不穩定,很容易失去一個電子變成Na+,帶一個正電荷,達到穩定結構。注意此時帶電荷是因為變成了離子。對於未失去電子的Na原子來說,還是符合核外電子數=質子數
1歷史
英國物理學家
歐內斯特·盧瑟福被公認為
質子的發現人。1918年他任
卡文迪許實驗室主任時,用
α粒子轟擊氮
原子核,注意到在使用
α粒子轟擊
氮氣時他的閃光探測器紀錄到氫核的跡象。質子命名為proton,這個單詞是由
希臘文中的“第一”演化而來的。盧瑟福認識到這些氫核唯一可能的來源是氮原子,因此氮原子必須含有氫核。他因此建議
原子序數為1的氫原子核是一個
基本粒子。在此之前尤金·戈爾德斯坦(Eugene Goldstein)就已經注意到陽極射線是由
正離子組成的。但他沒有能夠分析這些
離子的成分。盧瑟福發現質子以後,又預言了不帶電的中子存在。
 質子直線加速器
質子直線加速器 發現
1919年,盧瑟福做了用α粒子轟擊氮原子核的實驗,實驗裝置如圖所示,容器C里放有放射性物質A,從A射出的α粒子射到鋁箔F上,適當選取鋁箔的厚度,使容器C抽成真空後,α粒子恰好被F吸收而不能透過,在F後面放一螢光屏S,用顯微鏡冊來觀察螢光屏上是否出現閃光.通過閥門T往C里通進氮氣後,盧瑟福從螢光屏S上觀察到了閃光,把氮氣換成氧氣或二氧化碳,又觀察不到閃光,這表明閃光一定是α粒子擊中氮核後產生的新粒子透過鋁箔引起的.
盧瑟福把這種粒子引進電場和磁場中,根據它在電場和磁場中的偏轉,測出了它的質量和電量,確定它就是氫原子核,又叫做質子,通常用符號盧瑟福把這種粒子引進電場和磁場中,根據它在電場和磁場中的偏轉,測出了它的質量和電量,確定它就是氫原子核,又叫做質子,通常用符號表示.
這個質子是α粒子直接從氮核中打出的,還是α粒子打進覆核後形成的覆核發生衰變 時放出的呢?為了弄清這個問題,英國物理學家布拉凱特又在充氮的雲室里做了這個實驗.如果質子是α粒子直接從氮核中打出的,那么在雲室里就會看到四條徑跡:放射α粒子的徑 跡、碰撞後散射的.粒子的徑跡、質子的徑跡及拋出質子後的核的反衝徑跡.如果 粒子打進氮核後形成一個覆核,這覆核立即發生衰變放出一個質子,那么在雲室里就能看到三條徑跡:入射α粒子的徑跡、質子的徑跡及反衝核的徑跡.布拉凱特拍攝了兩萬多張雲室照片,終於從四十多萬條“粒子徑跡的照片中,發現有八條產生了分叉.分叉的情況表明,這第二種構想是正確的.從質量數守恆和電荷數守恆可以知道產生的新核是氧17。
在雲室的照片中,分叉後細而長的是質子的徑跡,短而粗的是反衝氧核的徑跡.
後來,人們用同樣的方法使氟、鈉、鋁等核發生了類似的轉變,並且都產生了質子.由於各種核里都能轟擊出質子,可見質子是原子核的組成部分.
套用
物理中質子常被用來在
加速器中加速到近光速後用來與其它粒子碰撞。這樣的試驗為研究
原子核結構提供了極其重要的數據。慢速的質子也可能被原子核吸收用來製造人造
同位素或
人造元素。
核磁穩態
至今為止質子被認為是一種穩定的、不
衰變的
粒子。但也有
理論認為質子可能
衰變,只不過其壽命非常長。到今天為止
物理學家沒有能夠獲得任何可能理解為
質子衰變的
實驗數據。實驗已測得的質子壽命大於10
35年。
水中的氫離子絕大多數都是水合質子。質子在化學和生物化學中起非常大的作用,根據
酸鹼質子理論,可以在
水溶液中提供質子的物質一般被稱為酸,可以在
水溶液中吸收質子的物質一般被稱為鹼。
然而,質子是通過中子的過程中
電子捕獲。這一過程不會自發發生,但只有當
能源供應。其計算公式:
於此
這個過程是可逆的:中子可轉換回質子通過
β-衰變,共同形成
放射性衰變。事實上,在一個自由中子衰變這樣一個平均壽命約15分鐘。
反質子
質子的反
粒子是
反質子,反質子是1955年埃米利奧·塞格雷(Emilio Gino Segrè)和
歐文·張伯倫(Owen Chamberlain)發現的,兩人為此獲得了1959年的
諾貝爾物理學獎。
反質子的發現:
正電子的發現證實了
狄拉克反粒子理論,一些
理論物理學家開始認真對待這一理論。1934年泡利與克拉夫證明,即使不能形成穩定的負能粒子海,也會有相應的反粒子存在。於是人們就開始尋找其他粒子的反粒子。早在1928年,狄拉克便預言了反質子的存在,但證實它的存在卻花了20多年的時間。根據狄拉克的理論,反質子的質量與質子相同,所帶
電荷相反,質子與反質子成對出現或湮沒,用兩個普通的質子碰撞便可獲得反質子,但反質子的產生閾能為6.8GeV。1954年,在
加利福尼亞大學的
勞倫斯輻射實驗室,建成了64億電子伏的質子同步穩相加速器,這為尋找反粒子提供了條件。1955年,
張伯倫和塞格雷用上述加速器證實了前一
 質子磁力儀
質子磁力儀年人們所觀測的反質子的存在。由於反質子出現的機會極少,大約每1000億高能質子的碰撞,才能產生數量很少的反質子,因而證實反質子的存在極為困難。1955年他們這個實驗小組測到60個反質子。由於偶然符合本底不大,記數系統雖不算好,但較為可信。不久他們又發現
反中子。儘管
高能粒子打靶時也能產生反中子,但是由於反中子不帶電,更難從其他粒子中鑑別出來。他們是利用反質子與原子核碰撞,反質子把自己的
負電荷交給質子,或由質子處取得正電荷,這樣,質子變成了中子,而反質子則變成了反中子。魯比亞,C.在正反
質子對撞機上進行幾百吉電子伏的對撞實驗,發現了現代
弱電統一理論所預言的傳力子,因而獲得1984年度諾貝爾物理學獎。
 核武器核子彈
核武器核子彈符號p,H+
發現時間1919年
中子態的形成
在巨大的壓力下,處於超固態的物質,使原來已經擁擠得緊緊的原子核和電子不能再緊了,這時候原子核只好被迫解散,從裡面釋放出質子與中子。從原子核里放出的質子,在極大壓力下會與電子結合為中子。這樣,物質的構造就發生了根本性的變化,原來由原子核和電子構造的物質,如今都變成了中子。這樣的狀態,就叫做“
中子態”。
酸鹼質子理論
酸鹼
離子理論是阿累尼烏其斯(Arrhenius)根據他的
電離學說提出來的。他認為在
水中能電離出氫
離子並且不產生其它陽離子的物質叫
酸。在水中能電離出
氫氧根離子並且不產生其它陰離子的物質叫
鹼。
酸鹼中和反應的實質是
氫離子和
氫氧根離子結合成水。這個理論取得了很大成功,但它的局限性也早就暴露出來,例如,氣態氨與氯脂氫反應迅速生成氯化銨,這個酸鹼中和反應並有水的生成;又如氨的水溶液顯鹼性,曾錯誤地認為NH
3和H
2O形成
弱電解質NH
4OH分子,然後離解出OH
-、NH
4+等。
由於
阿累尼烏斯的酸鹼離子理論不能解一些非水溶液中進行地酸鹼反應等問題,1923年布朗特(Bronsted)提出了
酸鹼質子理論,把酸鹼概念加以推廣。酸鹼質子理論認為凡是能給出
質子的物質都是酸,凡是能與質子結合的物質都是鹼。即酸是質子的給予體,鹼是質子的接受體。這樣,一個酸給出質子後餘下的部分自然就是鹼,因為它本身就是與質子結合的。
這種關係叫做酸鹼的共軛關係,式中略去了HB和B可能出現的電荷。右邊的鹼是左邊酸的共軛鹼,左邊的酸是右邊鹼的
共軛酸,兩者組成一個
共軛酸鹼對,它們只直差一個質子。從以上例子可以看出,酸和鹼可以是分子,也可以是
陽離子和
陰離子。還可以看出,像HPO
2-4這樣的物質,既表現酸,也
表現為鹼,所以它是兩性物質。同理,H
2O,HCO
3-等也是兩性物質。二、
共軛酸鹼的強弱
共軛酸鹼對的離解常數Ka和Kb之間有確定的關係。以HOAc為例推導如下:由於溶劑水的濃度不常數,所以它不出現在
平衡常數式中。用KW表示[H
3O
+][OH
-],KW稱為
水的離子積。這說明在一定溫度下,水中的[H
3O
+]與[OH
-]的乘積為一常數。所以 K
a·K
b=K
W (2-7)24℃時K
W值為1.0×10-14.這個關係說明,只知道了酸的離解常數Ka,就可以計算出它的共軛鹼的Kb,反之亦然。Ka和Kb是成反比的,而Ka 和Kb正是反映酸和鹼的強度,所以,在
共軛酸鹼對中,酸的強度愈大,其共軛鹼的強度愈小;鹼的強度愈大,其共軛酸的強度愈小。表2-6列出了一些共軛厔鹼對的強度次序。共軛酸鹼的強度次序酸性增強 共軛酸(HB) Ka(在水中) pKa(在水中) 共軛鹼(B)
鹼性增強H3O+ H2O H2C2O4 5.4×10-2 1.27 HC2O-4 H2SO3 1.54×10 1.81 HSO-3 HSO-4 1.20×10-2 1.92 SO2-4 H3PO4 7.51×10-3 2.12 H2PO-4 HNO2 4.6×10-4 3.37 NO-2 HF 3.53×10-4 3.45 F- HCOOH 1.77×10-4 3.75 HCOO- HC2O-4 5.4×10-5 4.27 C2O2-4 CH3COOH 1.76×10-5 4.75 CH3COO- H2CO3 4.30×10-7 6.37 HCO-3 HSO-3 1.02×10-7 6.91 SO2-3 H2S 9.1×10-8 7.04 HS- H2PO-4 6.23×10-8 7.21 HPO2-4 NH+4 5.68×10-10 9.25 NH3 HCN 4.93×10-10 9.31 CH- HCO-3 5.61×1011 10.25 CO2-3 H2O2 2.4×10-12 11.62 HO-2 HS- 1.1×10-12 11.96 S2- HPO2-4 2.2×10-13 12.67 PO3-4 H2O OH-
 質子磁力儀
質子磁力儀根據酸鹼
質子理論,酸鹼在溶液中所表現出來的強度,不僅與酸鹼的本性有關,也與溶劑的本性有關。我們所能測定的是酸鹼在一定溶劑中表現出來的相對強度。同一種酸或鹼,如果溶於不同的溶劑,它們所表現的相對強度就不同。例如HOAc在水中表現為弱酸,但在
液氨中表現為強酸,這是因為液氨奪取質子的能力(即鹼性)比水要強得多。這種現象進一步說明了酸鹼強度的相對性。
三、酸鹼反應酸鹼質子理論中的酸鹼反應是酸鹼之間的
質子傳遞。例如:這個反應無論在
水溶液中、苯或氣相中,它的實質都是一樣的。HCL是酸,放出質子給NH3,然後轉變成共軛鹼CL-,NH3是鹼,接受質子後轉變成
共軛酸NH4+。強鹼奪取了強酸放出的質子,轉化為較弱的
共軛酸和共軛鹼。酸鹼質子理論不僅擴大了酸鹼的範圍,還可以把酸鹼離解作用、
中和反應、
水解反應等,都看作是質子傳遞的酸鹼反應。由此可見,
酸鹼質子理論更好地解釋了酸鹼反應,擺脫了酸鹼必須在水中才能發生反應的局限性,解決了一些
非水溶劑或氣體間的酸鹼反應,並把
水溶液中進行的某些離子反應系統地歸納為質子傳遞的酸鹼反應,加深了人們對酸鹼和酸鹼反應的認識。但是酸鹼質子理論不能解釋那些不交換質子而又具有
酸鹼性的
物質,因此它還存在著一定的局限性。
路易斯提出的酸鹼
電子理論是目前概括最廣的酸鹼理論。該理論認為,凡是能給出
電子對的
物質叫做鹼;凡是能接受電子對的物質叫做酸。即酸是
電子對的接受體,鹼是電子對的給予體。因此,鹼中給出電子的原子至少有一對
孤對電子(未成鍵的
電子對),而酸中接受電子的原子至少有一個空軌道(外層未填充電子的軌道),以便接受鹼給予的電子對,這種由路易斯定義的酸和鹼叫做
路易斯酸和
路易斯鹼。例如,
三氟化硼(BF3)是
路易斯酸,因為BF3中的B
原子有一個空軌道是
電子的接受體。NH3中N原子有一對
孤對電子,是電子對的給予體,為路易斯鹼。但是,由於酸鹼電子
理論概括的酸鹼範圍太寬,使其實用價值受到一定的限制。
質子守恆
質子守恆就是酸失去的質子和鹼得到的質子數目相同,質子守恆和物料守恆,
電荷守恆一樣同為溶液中的三大守恆關係,質子守恆也可以由電荷守恆和物料守恆關係聯立得到NaHCO3 溶液中,存在下列等式 C(H+)+C(Na+)=C(HCO3-)+2C(CO32-)+C(OH-) 這個式子叫電荷守恆C(Na+)=C(HCO3-)+ C(CO32-)+C(H2CO3) 這個式子叫物料守恆
方法一:兩式相減得 C(H+)+C(H2CO3)=C(CO32-)+C(OH-) 這個式子叫質子守恆。方法二:由
酸鹼質子理論原始物種:HCO3-,H2O消耗質子產物H2CO3,產生質子產物CO32-,OH-C(H+)=C(CO32-)+C(OH-) -C(H2CO3)即C(H+)+C(H2CO3)=C(CO32-)+C(OH-) 關係:剩餘的質子數目等於產生質子的產物數目-消耗質子的產物數目直接用酸鹼質子理論求
質子平衡關係比較簡單,但要細心;如果用電荷守恆和物料守恆關係聯立得到則比較麻煩,但比較保險,又如NaH2PO4溶液,原始物種:H2PO4-,H2O,消耗質子產物:H3PO4,產生質子產物:HPO42-(產生一個質子),PO43-(產生二個質子),OH-,所以:c(H+)=c(HPO42-)+2c(PO43-)+c(OH-)-c(H3PO4) 可以用電荷守恆和物料守恆聯立驗證下。
 質子磁力儀
質子磁力儀 核武器核子彈
核武器核子彈 質子磁力儀
質子磁力儀

 質子磁力儀
質子磁力儀 核武器核子彈
核武器核子彈 質子磁力儀
質子磁力儀