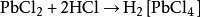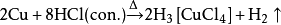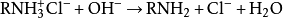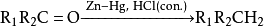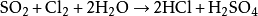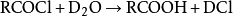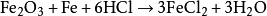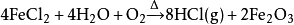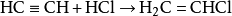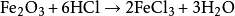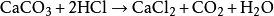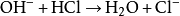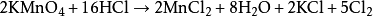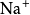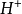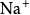研究簡史
王水是一種由鹽酸與
硝酸組成的混合物。13世紀歐洲
鍊金術士偽賈比爾的作品中提到,可以通過將
鹵砂(主要成分為
氯化銨)溶於硝酸來製備王水。也有說法稱最先在手稿中提到王水的是13世紀末的
拜占庭。
16世紀,利巴菲烏斯第一次正式
記載了分離出的純淨鹽酸,他是在粘土
坩堝中加熱鹽與
濃硫酸的混合物來製備它的。也有一些作者認為純的鹽酸是由15世紀德國
本篤會的巴希爾·瓦倫丁製備的,他的方法是將
食鹽與
硫酸亞鐵混合加熱後酸化。不過,其他一些作者認為直到16世紀末都沒有文獻明確表明有人製備過純的鹽酸。
工業革命期間,歐洲對
鹼的需求有所增加。法國伊蘇丹的尼古拉斯·勒布朗新發現了一種
碳酸鈉(蘇打)工業製法,使碳酸鈉得以大規模廉價生產。勒布朗制鹼法用
硫酸、
石灰石、
煤將食鹽轉變為蘇打,同時生成副產物氯化氫氣體。這些氯化氫大多排放到空氣中,直到各國出台相關法規(例如英國《1863年鹼類法令》)後,蘇打生產商們才用水吸收氯化氫,使得鹽酸在工業上大量生產。
20世紀,無鹽酸副產物的
氨鹼法已經完全取代勒布朗法。這時鹽酸已成為許多化工套用中很重要的一種化學品,因而人們開發了許多其他的製備方法,其中一些仍在使用。2000年後,絕大部分鹽酸都是由工業生產有機物得到的副產品氯化氫溶於水而得到的。
理化性質
物理性質
鹽酸是無色液體(工業用鹽酸會因有雜質三價鐵鹽而略顯黃色),為
氯化氫的水溶液,具有刺激性氣味,一般實驗室使用的鹽酸為0.1mol/L,pH=1。由於濃鹽酸具有揮發性,揮發出的氯化氫氣體與空氣中的
水蒸氣作用形成鹽酸小液滴,所以會看到白
霧。
鹽酸與水、乙醇任意混溶,濃鹽酸稀釋有熱量放出,氯化氫能溶於
苯。
| 質量分數 | 濃度
(g/L) | 密度(kg/L) | 物質的量濃度
(mol/L) | 哈米特酸度函式 | 粘性
(m·Pa·s) | 比熱容
[KJ/(Kg·℃)] | 蒸汽壓
(Pa) | 沸點
(℃) | 熔點
(℃) |
|---|
10% | 104.80 | 1.048 | 2.87 | -0.5 | 1.16 | 3.47 | 0.527 | 103 | -18 |
20% | 219.60 | 1.098 | 6.02 | -0.8 | 1.37 | 2.99 | 27.3 | 108 | -59 |
30% | 344.70 | 1.149 | 9.45 | -1.0 | 1.70 | 2.60 | 1410 | 90 | -52 |
32% | 370.88 | 1.159 | 10.17 | -1.0 | 1.80 | 2.55 | 3130 | 84 | -43 |
34% | 397.46 | 1.169 | 10.90 | -1.0 | 1.90 | 2.50 | 6733 | 71 | -36 |
36% | 424.44 | 1.179 | 11.64 | -1.1 | 1.99 | 2.46 | 14100 | 61 | -30 |
38% | 451.82 | 1.189 | 12.39 | -1.1 | 2.10 | 2.43 | 28000 | 48 | -26 |
參考文獻: |
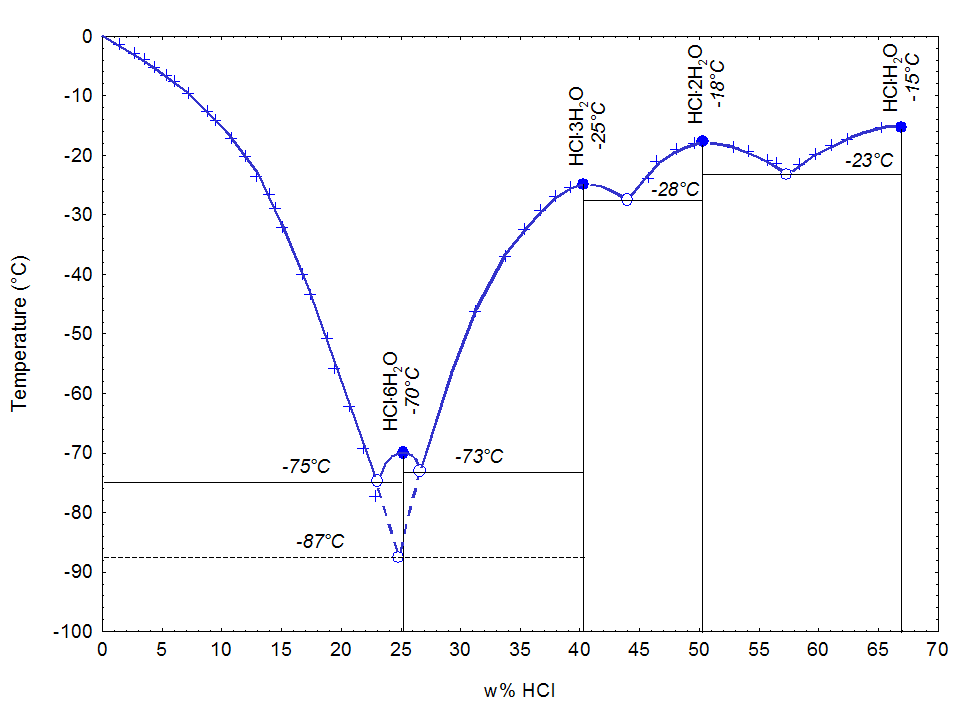
如下圖所示,鹽酸共有四個
結晶的
共熔點,分別對應四種
晶體:68%(HCl的質量分數,下同)時的HCl·H
2O、51%時的HCl·2H
2O、41%時的HCl·3H
2O和25%時的HCl·6H
2O。另外在24.8%時還有一種亞穩的HCl·3H
2O生成。
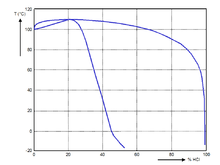
鹽酸在一定壓力下能形成共沸溶液。下圖為一個大氣壓下不同濃度鹽酸的沸點,其中下方的線與上方的線分別表示相應溫度下,液體及與液體處於平衡狀態的蒸氣的組分。氯化氫的質量分數20.24%對應最高沸點108.6℃。
化學性質
酸性
鹽酸溶於鹼液時與鹼液發生中和反應。
鹽酸是一種
一元強酸,這意味著它只能
電離出一個
。在水溶液中氯化氫分子完全電離,
與一個水分子絡合,成為H
3O
+,使得水溶液顯酸性:
可以看出,電離後生成的陰離子是Cl
-,所以鹽酸可以用於製備
氯化物,例如
氯化鈉。
鹽酸可以與氫氧化鈉酸鹼中和,產生食鹽:
銅、
銀、
金等活動性在氫之後的金屬不能與稀鹽酸反應,但銅在有空氣存在時,可以緩慢溶解,例如:
一元酸只有一個酸離解常數,符號為
Ka。它能夠度量水溶液中酸的強度。於鹽酸等強酸而言,
Ka很大,只能通過理論計算來求得。向鹽酸溶液中加入氯化物(比如NaCl)時
pH基本不變,這是因為Cl
-是鹽酸的
共軛鹼,強度極弱。所以在計算時,若不考慮極稀的溶液,可以假設氫離子的
物質的量濃度與原氯化氫濃度相同。如此做即使精確到四位
有效數字都不會有誤差。
還原性
鹽酸具有
還原性,可以和一些強氧化劑反應,放出氯氣:
配位性
部分金屬化合物溶於鹽酸後,金屬離子會與氯離子
絡合。例如難溶於冷水的
二氯化鉛可溶於鹽酸:
銅在無空氣時難溶於稀鹽酸,但其能溶於熱濃鹽酸中,放出氫氣:
有機化學
酸性環境下可對醇類進行親核取代生成鹵代烴:
氯化氫也可以加成烯雙鍵得到氯代烴,例如:
胺類化合物通常在水中溶解度不大。欲增大其溶解度,可以用稀鹽酸處理為
銨鹽:
利用這樣的性質,可以將胺與其他有機化合物分離。
此外,胺的鹽酸鹽的
熔點或分解點可以用來測定胺的種類。
但應注意,此法只適用於對酸穩定的化合物,如果有α、β-碳碳雙鍵等也會被還原:
製備方法
工業製法
電解法
2、在反應器中將氫氣和氯氣通至
石英制的燒嘴點火燃燒,生成
氯化氫氣體,並發出大量熱:
3、氯化氫氣體冷卻後被水吸收成為鹽酸。
在氯氣和氫氣的反應過程中,有毒的氯氣被過量的氫氣所包圍,使氯氣得到充分反應,防止了對空氣的污染。在生產上,往往採取使另一種原料過量的方法使有害的、價格較昂貴的原料充分反應。
有機反應副產物
實驗室製法
鹽酸主要由
氯化氫溶於水來製備。而氯化氫又有多種製備的方式,所以有許多
前體。另外,也可以通過
氯氣與
二氧化硫在水溶液中作用來製備:
套用領域
生活用途
人類和其他動物的
胃壁上有一種特殊的
腺體,能把吃下去的食鹽變成鹽酸。鹽酸是胃液的一種成分(濃度約為0.5%),它能使胃液保持激活胃
蛋白酶所需要的最適合的
pH值,它還能使食鹽中的蛋白質變性而易於
水解,以及殺死隨食物進入胃裡的細菌的作用。此外,鹽酸進入小腸後,可促進胰液、腸液的分泌以及膽汁的分泌和排放,酸性環境還有助於小腸內鐵和鈣的吸收。
利用鹽酸可以與難溶性鹼反應的性質,製取
潔廁靈、
除銹劑等日用品。
工業用途
鹽酸是一種無機強酸,在工業加工中有著廣泛的套用,例如金屬的精煉。鹽酸往往能夠決定產品的質量。
分析化學
在
分析化學中,用酸來測定
鹼的濃度時,一般都用鹽酸來
滴定。用強酸滴定可使終點更明顯,從而得到的結果更精確。在1
標準大氣壓下,20.2%的鹽酸可組成恆沸溶液,常用作一定
氣壓下
定量分析中的
基準物。其恆沸時的濃度會隨著氣壓的改變而改變。
鹽酸常用於溶解固體樣品以便進一步分析,包括溶解部分金屬與
碳酸鈣或
氧化銅等生成易溶的物質來方便分析。
酸洗鋼材
鹽酸一個最重要的用途是
酸洗鋼材。在後續處理鐵或鋼材(
擠壓、
軋制、
鍍鋅等)之前,可用鹽酸反應掉表面的銹或
鐵氧化物。通常使用濃度為18%的鹽酸溶液作為酸洗劑來清洗
碳鋼:
剩餘的廢酸常再用作
氯化亞鐵溶液,但其中
重金屬含量較高,故這種做法已經逐漸變少。
酸洗鋼材工業發展了鹽酸再生工藝,如噴霧焙燒爐或流化床鹽酸再生工藝等。這些工藝能讓氯化氫氣體從酸洗液中再生。其中最常見的是高溫水解工藝,其反應方程式如下:
將製得的氯化氫氣體溶於水即又得到鹽酸。通過對廢酸的回收,人們建立了一個封閉的酸循環。副產品
氧化鐵在各種工業加工流程中也有較多套用。
製備有機化合物
製備無機化合物
控制pH及中和鹼液
在工業中對純度的要求極高時(如用於食品、製藥及飲用水等),常用高純的鹽酸來調節水流的pH;要求相對不高時,工業純的鹽酸已足以
中和廢水,或處理游泳池中的水。
用於焰色反應
用於檢驗金屬或它們的化合物時常使用焰色反應,用於檢驗的鉑絲需用稀鹽酸洗淨以除去雜質元素的影響。
檢驗物質前,應將鉑絲用鹽酸清洗,再放到火焰上灼燒,直到火焰呈原來顏色方可實驗。
陽離子交換樹脂的再生
離子交換樹脂和
軟化水在幾乎所有的化學工業中都有套用,尤其是飲用水生產和食品工業。
其他套用
鹽酸還有許多小規模的用途,比如
皮革加工、食鹽生產,以及用於建築業。
石油工業也常用鹽酸:將鹽酸注入
油井中以溶解岩石,形成一個巨大的空洞。此法在
北海油田的石油開採工業中經常用到。
鹽酸可以溶解碳酸鈣,其套用包括除
水垢或砌磚使用的
石灰砂漿,但鹽酸較為危險,使用時需謹慎。它與石灰砂漿中的碳酸鈣反應生成
氯化鈣、
二氧化碳和水:
安全措施
健康危害
濃鹽酸(發煙鹽酸)會揮發出酸霧。鹽酸本身和酸霧都會腐蝕人體組織,可能會不可逆地損傷呼吸器官、眼部、皮膚和胃腸等。在將鹽酸與
氧化劑(例如漂白劑
次氯酸鈉或
高錳酸鉀等)混合時,會產生有毒氣體
氯氣。
氯化氫的危險性取決於其濃度。下表中列出歐盟對鹽酸溶液的分類。
| 濃度 | 分類 | 警示術語 |
|---|
10-25% | 刺激性 (Xi) | R36/37/38 |
> 25% | 腐蝕性 (C) | |
危害防治
操作事項
使用鹽酸時,應配合個人防護裝備。如橡膠手套或
聚氯乙烯手套、護目鏡、耐化學品的衣物和鞋子等,以降低直接接觸鹽酸所帶來的危險。密閉操作,注意通風。操作儘可能機械化、自動化。操作人員必須經過專門培訓,嚴格遵守操作規程。
建議操作人員佩戴自吸過濾式防毒面具(全面罩),穿
橡膠耐酸鹼服,戴橡膠
耐酸鹼手套。遠離易燃、可燃物。防止蒸氣泄漏到工作場所空氣中。避免與鹼類、
胺類、
鹼金屬接觸。搬運時要輕裝輕卸,防止
包裝及容器損壞。配備
泄漏應急處理設備。倒空的容器可能殘留有害物。
酸霧處理
在鹽酸使用過程中,有大量氯化氫氣體產生,可將吸風裝置安裝在容器邊,再配合風機、
酸霧淨化器、風道等設備設施,將鹽酸霧排出室外處理。也可在鹽酸中加入酸霧
抑制劑,以抑制鹽酸酸霧的揮發產生。
泄漏應急處理
應急處理:迅速撤離泄漏污染區人員至
安全區,並進行隔離,嚴格限制出入。建議應急處理人員戴自給
正壓式呼吸器,穿防酸鹼工作服。不要直接接觸泄漏物。儘可能切斷泄漏源。
小量泄漏:用砂土、乾燥
石灰或蘇打灰混合。也可以用大量水沖洗,清水稀釋後放入
廢水系統。
大量泄漏:構築圍堤或挖坑收容。用泵轉移至
槽車或專用收集器內,回收或運至廢物處理場所處置。
消防措施
危險特性:能與一些活性金屬粉末發生反應, 放出氫氣。遇氰化物能產生劇毒的氰化氫氣體。與鹼發生
中和反應,並放出大量的熱。具有較強的腐蝕性。
有鹽酸存在時的滅火方法:用鹼性物質如
碳酸氫鈉、碳酸鈉、
消石灰等中和。也可用大量水撲救。
急救措施
皮膚接觸:立即脫去污染的衣著,用大量流動清水沖洗至少15分鐘,可塗抹
弱鹼性物質(如鹼水、肥皂水等),就醫。
眼睛接觸: 立即提起
眼瞼,用大量流動清水或
生理鹽水徹底沖洗至少15分鐘。就醫。
食入:用大量水漱口,吞服大量生雞蛋清或牛奶(禁止服用小蘇打等藥品),就醫。
安全標誌
鹽酸具有強腐蝕性,容器上需要標註腐蝕品的標誌。

檢測方法
方法名稱
套用範圍
本方法採用
滴定法測定鹽酸中氯化氫的含量。本方法適用於鹽酸。
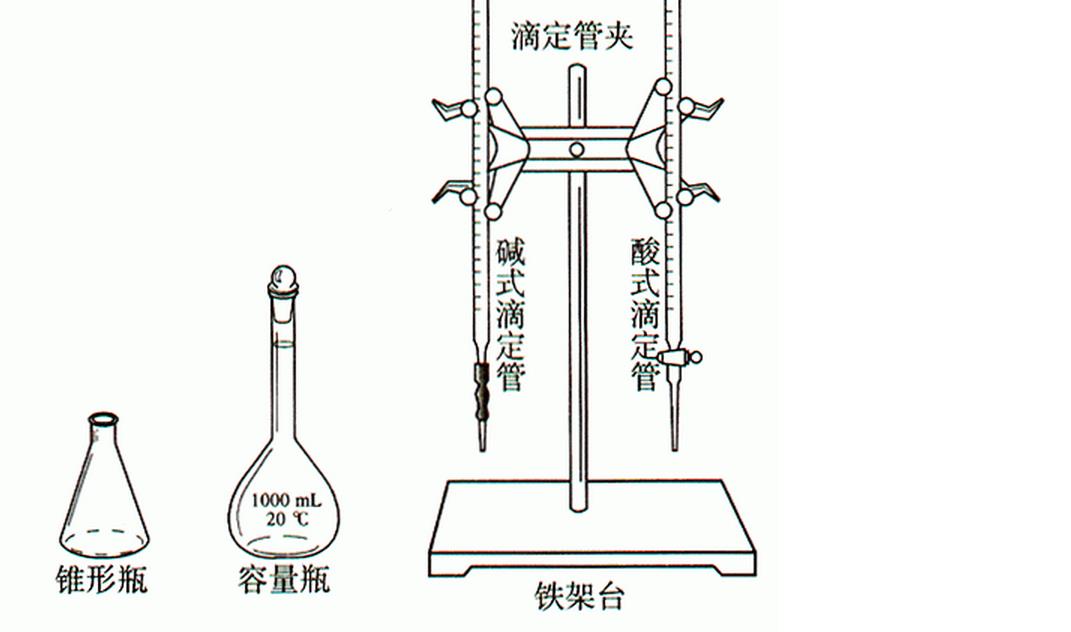
方法原理
供試品用水稀釋,加甲基紅指示液,用氫氧化鈉滴定液滴定。甲基紅指示液變紅時停止滴定,讀出氫氧化鈉滴定液使用量,計算鹽酸含量。
試劑
1、蒸餾水(新沸放冷)
試樣製備
1. 氫氧化鈉滴定液(1mol/L)
配製:取澄清的氫氧化鈉飽和溶液56mL,加新沸過的冷水使成1000mL。
標定:取在105℃乾燥至恆重的基準鄰苯二甲酸氫鉀約6g,精密稱定,加新沸過的冷水50mL,振搖,使其儘量溶解;加酚酞指示液2滴,用本液滴定,在接近終點時,應使鄰苯二甲酸氫鉀完全溶解,滴定至溶液顯粉紅色。每1mL氫氧化鈉滴定液(1mol/L)相當於204.2mg的鄰苯二甲酸氫鉀。根據本液的消耗量與鄰苯二甲酸氫鉀的取用量,算出本液的濃度。
貯藏:置
聚乙烯塑膠瓶中,密封保存;塞中有2孔,孔內各插入玻璃管1支,1管與鈉石灰管相連,1管供吸出本液使用。
2. 甲基紅指示液
取甲基紅0.1g,加0.05mol/L氫氧化鈉溶液7.4mL使溶解,再加水稀釋至200mL,即得。
操作步驟
取該品約3mL,置貯有水20mL並稱定重量的具塞錐形瓶中,精密稱定,加甲基紅指示液2滴,用氫氧化鈉滴定液(1mol/L)滴定,每1mL氫氧化鈉滴定液(1mol/L)相當於36.46mg的HCl。
注:“精密稱取”系指稱取重量應準確至所稱取重量的千分之一,“精密量取”系指量取體積的準確度應符合國家標準中對該體積移液管的精度要求。
儲存運輸
儲存方法
儲存於陰涼、通風的庫房。庫溫不超過30℃,相對濕度不超過85%。保持容器密封。應與鹼類、胺類、鹼金屬、易(可)燃物分開存放,切忌混儲。儲區應備有泄漏應急處理設備和合適的收容材料。
廢棄處置方法: 用鹼液-
石灰水中和,生成氯化鈉和氯化鈣,用水稀釋後排入廢水系統。
運輸方法
危險貨物編號: 81013
UN編號: 1789
包裝類別: O52
包裝方法:耐酸壇或陶瓷瓶外普通木箱或半花格木箱;玻璃瓶或塑膠桶(罐)外普通木箱或半花格木箱;磨砂口玻璃瓶或螺紋口玻璃瓶外普通木箱;螺紋口玻璃瓶、鐵蓋壓口玻璃瓶、塑膠瓶或金屬桶(罐)外普通木箱。
運輸注意事項: 本品鐵路運輸時限使用有像膠襯裡鋼製罐車或特製塑膠企業自備罐車裝運,裝運前需報有關部門批准。鐵路運輸時應嚴格按照鐵道部《危險貨物運輸規則》中的危險貨物配裝表進行配裝。起運時包裝要完整,裝載應穩妥。運輸過程中要確保容器不泄漏、不倒塌、不墜落、不損壞。嚴禁與鹼類、胺類、鹼金屬、易燃物或可燃物、食用化學品等混裝混運。運輸時運輸車輛應配備泄漏應急處理設備。運輸途中應防曝曬、雨淋,防高溫。公路運輸時要按規定路線行駛,勿在居民區和人口稠密區停留。