分類
自然界絕大多數的無機物可以歸入氧化物、酸、鹼和鹽4大類。生物體中的
無機物主要有水及一些
無機離子,如Na
+、K
+、Ca
2+、Mg
2+、Cl
-、SO
42-、等。人體組織中幾乎含有自然界存在的各種元素,其中除碳、氫、氧和氮主要以
有機化合物形式存在外,其餘的統稱為
無機物(礦物質或灰分).所以,無機物主要是由:水和無機鹽組成的,其中水又可以分類為:
結合水和
自由水,結合水是
細胞結構的重要組成成分,自由水是良好的
溶劑,
運輸物質,參與化學反應。無機鹽可分為:離子和化合物,離子是維護細胞正常的生命活動,化合物是細胞內化合物的重要
組成物分。
 氧化鉻
氧化鉻氧化物
鹼性氧化物:能跟酸起反應生成鹽和水的氧化物,且生成物只能有鹽和水,不可以有任何其它物質生成。鹼性氧化物包括活潑
金屬氧化物和其他金屬的低價氧化物,如CaO、BaO和CrO、MnO。
無機酸
一類在
水溶液中能電離產生H 的化合物的總稱,與鹼相對。鹽酸、硫酸、
硝酸在水溶液中
電離時,產生的
陰離子(
酸根)雖各不相同,但產生的
陽離子(H )卻是相同的 , 因此它們在性質上有共同的地方,例如具有酸味;能溶解許多金屬;能使
藍色石蕊試紙變紅等。狹義的定義:在水溶液中電離出的陽離子全部都是
氫離子的化合物(比如硫酸)。這類物質大部分易溶於水中,少部分,如:矽酸,難溶於水。酸的水溶液一般可導電,部分酸在水中以分子的形式存在,不導電;部分酸在水中離解為正負離子,可導電。
較廣義的定義:反應中能提供質子的是酸,定義酸為電子對的接受者,範圍更為廣泛。酸可以和鹼進行中和作用,生成水和鹽。
鹼
味苦的、溶液能使特定指示劑變色的物質(如使石蕊變藍,使酚酞變紅等),PH值大於7。在水溶液中電離出的
陰離子全部是
氫氧根離子,與酸反應形成鹽和水。典型的鹼如胺類物質(包括氨水),燒鹼(氫氧化鈉),熟石灰(氫氧化鈣)等。鹼的更廣義的概念是指提供電子的物質,或是接受
質子的物質。
 氫氧化鈣
氫氧化鈣鹽
 氯化鈉
氯化鈉酸與鹼中和的產物,由金屬離子(包括銨根離子)與酸根離子構成。化學中鹽分為三類,
正鹽:單由金屬離子(包括
銨根離子)和非金屬離子構成;
酸式鹽:由金屬離子(包括銨根離子)、
氫離子和非金屬離子構成;
鹼式鹽:由金屬離子(包括銨根離子)、氫氧根離子和非金屬離子構成。鹽是化學工業的重要源料,它可製成
氯氣、
金屬鈉、
純鹼(
碳酸鈉)、
重鹼(碳酸氫鈉、小蘇打)、燒鹼(苛性納、氫氧化鈉)和鹽酸。
命名規定
無機化合物的命名,應力求簡明而確切地表示出被命名物質的組成和結構。這就需要用元素、根或基的名稱來表達該物質中的各個組分;用“化學介詞”(起著連線名詞的作用)來表達該物質中各組分的連線情況。
命名須知
(1)化學介詞:化合物的系統名稱是由其基本構成部分名稱連綴而成的。化學介詞在文法上就是連綴基本構成部分名稱以形成化合物名稱的連綴詞。列舉如下。
①
化 表示簡單的化合。如氯
原子(Cl)與鉀原子(K)化合而成的KCl就叫氯化鉀;又如氫氧基(OH
-)與鈉原子(Na)化合而成的NaOH就叫氫氧化鈉。
②合 表示分子與分子或分子與離子相結合。如CaCl
2·H
2O叫水合氯化鈣,H
3O叫
水合氫離子。
③代 a.表示取代了母體化合物中的氫原子,如NH2Cl叫氯代氨;NHCl2叫二氯代氨;
ClCH
2COOH叫氯代乙酸。b.表示硫(或硒、碲)取代氧,如H
2S
2O
3硫代硫酸;HSeCN叫
硒代氰酸。
④聚 表示兩個以上同種的分子互相聚合,如(HF)2叫二聚氟化氫,(HOCN)3叫三聚氰酸,(KPO3)6叫六聚偏磷酸鉀。
(2)
基和根:基和根是指在化合物中存在的原子集團,若以共價鍵與其他組分結合者叫做
基,以電價鍵與其他組分結合者叫做根。基和根一般均從其
母體化合物命名,稱為某基或某根。基和根也可以用連綴其所包括的元素名稱來命名,價已滿的元素名放在前面,未滿的放在後面。
見表1。
表l 基和根
母體化合物 | 基 | 根 |
NH3氨 | -NH2氨基 | NH4銨根 |
HOH水 | -OH羥基 | OH氫氧根 |
HCN氰化氫 | -CN氰基 | CN氫氰酸根 |
H2S硫化氫 | -SH巰基(氫硫基) | SH氫硫酸氫根 |
含氧酸 | 醯基 | 酸根 |
H2CO3碳酸根 | =O羰基、碳二醯 | CO3碳酸根,H2CO3碳酸氫 |
HNO3硝酸 | -NO硝基、硝醯 | NO3硝酸根 |
HNO2亞硝酸 | -NO亞硝基、亞硝醯 | NO2亞硝酸根 |
H2SO4硫酸 | -SO2OH磺酸基 | SO4硫酸根 |
| =SO2硫醯 | H2SO4硫酸氫根 |
H2SO3亞硫酸 | -SO2H亞磺基、亞硫醯 | SO3亞硫酸根 |
| | HSO3亞硫酸氫根 |
H3PO4磷酸 | -H2PO3磷酸一醯 | H2PO4磷酸二氫 |
| =HPO2磷酸二醯 | HPO4磷酸氫根 |
| ≡PO磷醯 | PO4磷酸根 |
鈾氧基鹽 | =UO2鈾醯 | |
(3) 離子:元素的離子,根據元素名稱及其化合價來命名。例如:Cl氯離子、Na鈉離子帶電的原子團,如上所述稱為某根;若需指明其為離子時,則稱為某離子或某根離子。
 磷酸
磷酸例如:HSO4一價硫酸根離子或稱硫酸氫根離子;SiF6氟矽酸根離子;SO4硫酸根離子
(4)常用化學詞冠:常用化學詞冠(起修飾作用,以表達此物質的某一特點)見表2。
表2 化學詞冠
詞冠 | 含 義 | 舉 例 |
正 | 表示此元素(原子或離子)顯示著最常見的化合價態 | SnCl4氯化(正)錫,NiCl2氯化(正)鎳 |
高 | 表示某元素的價態高於最常見的價態。 | Ni2O3氧化高鎳,FeCl3氯化鐵 |
亞 | 表示某元素的價態低於最常見的價態 | SnCl2氯化亞錫,FeO氧化亞鐵 |
過 | 表示化合物里有過氧基或過硫基 | H2O2過氧化氫 |
多 | 表示化合物內某元素的原子數很多 | (NH4)2Sx多硫化銨 |
超 | 表示化合物中含有超氧基 | KO2超氧化鉀 |
註:1.命名酸時,有一套專用的化學詞冠,見“酸的命名法”。
2.過:-O-O-稱為過氧基,-S-S-稱為過硫基。如H-O-O-H稱為過氧化氫。
3.高:表示某元素的價態高於最常見的價態。有時也用於表示某元素具有兩種價態時,“高”顯示著其中較高的價態
4.正:表示此元素(原子或離子)顯示著最常見的化合價態(“正”字常省略)
二元化合物
(1)
二元化合物只含有兩種元素的化合物叫做二元化合物。二元化合物的名稱是在兩種元素的名稱中加化學介詞“化”字綴合而成的。在名稱中,陰性較強的元素名稱放在前面,陽性較強的元素名稱放在後面。化合物中兩種元素的比例可以有兩種方法表示:一種是標明陽電性組分的化合價;另一種是標明化學組成。為求每種二元化合物儘可能只用一種命名方法命名,特分別規定如下。
① 標明陽電性組分的化合價
a.極性二元化合物中,陽電性元素通常僅有一種化合價者,其陽電性元素的化合價不需另
加詞頭標明。例如:
NaCl 氯化鈉A12O3氧化鋁
CaCl2氯化鈣 K2O 氧化鉀
LiH MgS 硫化鎂
b.極性化合物中,陽電性元素通常僅有兩種化合價,而所形成的化合物其組成又與此兩項變價之一相符。例如:Fe的化合物,FeO及Fe2O3就用此法命名.而Fe3O4則不用此法命名。
陽電性元素最常見的化合價,在名稱中用詞頭“正”字表示,“正”字一般均予省略。低於常見化合價的價數用詞頭“亞”字表示,高於常見化合價的價數用詞頭“高”字表示。例如:
HgO 氧化汞 SnCl4氯化錫
Hg2O 氧化亞汞 SnCl2氯化亞錫
Fe2O3氧化鐵 Co2O3氧化高鈷
FeO 氧化亞鐵CoO 氧化鈷
CuCl2氯化銅 Ni2O3氧化高鎳
CuCl 氯化亞銅NiO 氧化鎳
② 標明化學組成
凡不屬①法命名的二元化合物,都用此項方法命名。本類名詞至少包括一個數字詞頭,當名稱中有兩個“一”字時就不能全部略去,而只可略去後一個“一”字。
例如一氧化一氮就只能簡化成一氧化氮,不宜簡化成氧化一氮,更不可簡化成氧化氮。
a.非極性二元化合物都用此法命名。例如:
NO 一氧化氮B4C 一碳化四硼
N2O4四氧化二氮 N2O3三氧化二氮
N2O 一氧化二氮 FeP 一磷化鐵
NO2二氧化氮 Fe2P 一磷化二鐵
b.極性二元化合物中,陽性元素雖然通常僅有一種或兩種化合價,但所形成的二元化合物其組成不符合常見的化合價時(如:AlCl,Fe3O4等),或其電價尚不清楚時(如:As2S2)也用此法命名。例如:
AlCl 一氯化鋁FeS
2二硫化鐵AlO 一氧化鋁Fe
3S
4四硫化三鐵KO
2二氧化鉀 Cs
2S
4四硫化二銫K
2O
3三氧化鉀 Cs
2S
5五硫化二銫Fe
3O
4四氧化三鐵 Fe
7S
8八硫化七鐵CaO
4四氧化鈣 Cs
2S
3三硫化二銫Sn
4O
9九氧化四釤 As
4S
4四硫化四砷

K2O4四氧化二鉀 Cs2S6六硫化二銫
BaO4四氧化鋇 As2S2二硫化二砷
c.化合價通常不止兩種的陽性元素,其二元化合物用此法命名。例如:
MnO 一氧化(一)錳Mn2O7七氧化二錳
Mn2O3三氧化二錳 RuCl2二氯化釕
(2) 水溶液呈酸性的二元氫化物 水溶液是酸性的二元氫化物,除按一般二元化合物命名外,在水溶液中還可以視作無氧酸(也叫:氫酸),命名為氫某酸,但是它們的鹽則僅能視作極性二元化合物命名,稱為某化某。呈My(SH)x式的酸式氫硫酸鹽宜稱為氫硫化某。見表3。
例如,無氧酸的鹽:
HgBr 溴化亞汞 HgS 硫化汞
KCl 氯化鉀 Na
2S 硫化鈉
 氯化鉀
氯化鉀HgBr2溴化汞 MnCl2二氯化錳
MnCl3三氯化錳
表3 二元氫化物
化學式 | 視作一般二元化合物 | 視作無氧酸 | 化學式 | 視作一般二元 化合物 | 視作無氧酸 |
H2F2 | 氟化氫 | 氫氟酸 | HN3 | 疊氮化氫 | (氫)疊氨酸 |
HCl | 氯化氫 | 氫氯酸,鹽酸 | HBr | 溴化氫 | 氫溴酸 |
H2S | 硫化氫 | 氫硫酸 | HI | 碘化氫 | 氫碘酸 |
HCN | 氰化氫 | 氫氰酸 | | | |
酸式氫硫酸鹽:
KSH 氫硫化鉀Ba(SH)2氫硫化鋇
(3) 過氧化物和過硫化物 僅含過氧基-O-O-和過硫基-S-S-的二元化合物可分別稱為過氧化某和過硫化某。
H2O2、H-O-O-H 過氧化氫
Na2O2、Na-O-O-—Na 過氧化鈉
Na2S2、Na-S-S-Na 過硫化鈉
(4) 特定名稱 十分重要的個別二元化合物,給予特定名稱如下:
(1) 用特定的根基名稱命名 三元、四元等化合物,若其組成的根基具有特定的名稱時,則應在儘可能的情況下,採用二元化合物的命名法。例如:
KCN 氰化鉀 Co(OH)3氫氧化高鈷
BaSO4硫酸鋇 SO2Cl2硫酸氯、氯化硫醯
SOCl2亞硫醯氯 SO2(NH2)2硫醯(二)胺、二氨基硫醯
SOClBr 亞硫醯溴氯、溴氯化亞硫醯NO2Cl 硝醯氯、氯化硝醯
Zn(NH2)2氨基(化)鋅
(2) 命名的次序 幾種陰電性組分同時與一種陽電性組分化合時,或幾種陽電性組分同時與一種陰電性組分化合時,也應在儘可能的情況下,採用二元化合物的命名法,只是在名稱中將陰性較強的組分名放在前面,陽性較強的組分名放在後面。這種名稱中的數字詞頭,在不致誤會時,可以略去。
混鹽:BaClF氟氯化鋇 CaClNO3氯化硝酸鈣
ZrBr2Cl3二氯二溴化鋯
復鹽:KAl(SO4)2硫酸鋁鉀(NH4)2Fe(SO4)2硫酸亞鐵銨
鹵硫化物:SiSBr2二溴一硫化矽
鹵氧化物:CrO2Cl2二氯二氧化鉻、鉻醯氯
VOCl
 一氯一氧化釩
一氯一氧化釩Mo2O3Cl5五氯三氧化二鉬
MoO2Cl2二氯二氧化鉬、鉬醯氯
金屬代銨化物:(NH2Hg2)Cl 氯代二亞汞銨
常見物質
二氧化碳
無色無臭氣體,有酸味,溶於水(體積比1:1),部分生成碳酸。氣體二氧化碳用於制鹼工業、製糖工業,並用於鋼鑄件的淬火和
鉛白的製造等。可由碳在過量的空氣中燃燒或使大理石、石灰石、白雲石煅燒或與酸作用而得,是石灰、發酵等工業的副產品。二氧化碳一般不燃燒也不支持燃燒,
常溫下
密度比空氣略大,受熱膨脹後則會聚集於上方,常被用作滅火劑。二氧化碳是綠色植物光合作用不可缺少的原料,溫室中常用二氧化碳作肥料。固態二氧化碳俗稱乾冰,升華時可吸收大量熱,因而用作製冷劑,如
人工降雨,也常在舞美中用於製造煙霧。
 二氧化碳滅火器
二氧化碳滅火器硫酸
純硫酸是一種無色無味油狀液體,溶解時放出大量的熱,是一種高沸點難揮發的強酸,易溶於水,能以任意比與水混溶。
化學性質為吸水性、
脫水性、強
氧化性、難揮發性、.酸性和穩定性。
 硫酸
硫酸稀硫酸,無色無嗅透明液體。化學性質為與多數金屬(比銅活潑)氧化物反應,生成相應的硫酸鹽和水; 與所含
酸根離子氧化性比硫酸根離子弱的鹽反應,生成相應的硫酸鹽和
弱酸; 與鹼反應生成相應的硫酸鹽和水; 與氫前金屬在一定條件下反應,生成相應的硫酸鹽和氫氣; 加熱條件下可催化蛋白質、
二糖和多糖的水解。
氫氧化鈉
純的無水氫氧化鈉為白色半透明,結晶狀固體。氫氧化鈉極易溶於水,溶解度隨溫度的升高而增大,溶解時能放出大量的熱。它的
水溶液有澀味和滑膩感,溶液呈強鹼性,具備鹼的一切通性。市售燒鹼有固態和液態兩種:純固體燒鹼呈白色,有塊狀、片狀、棒狀、粒狀,質脆;純液體燒鹼為無色透明液體。氫氧化鈉還
易溶於乙醇、甘油;但不溶於
乙醚、
丙酮、
液氨。對纖維、皮膚、玻璃、陶瓷等有
腐蝕作用,溶解或
濃溶液稀釋時會放出熱量;與
無機酸發生
中和反應也能產生大量熱,生成相應的
鹽類;與金屬鋁和鋅、
非金屬硼和矽等反應放出氫;與氯、溴、碘等鹵素髮生
歧化反應。能從水溶液中沉澱金屬離子成為
氫氧化物;能使油脂發生
皂化反應,生成相應的
有機酸的鈉鹽和醇,這是去除織物上的油污的原理。
 氫氧化鈉
氫氧化鈉氧化鈣
性狀:白色或帶灰色塊狀或顆粒。對濕敏感。易從空氣中吸收二氧化碳及水分。 溶於水成氫氧化鈣並產生大量熱,溶於酸類、甘油和蔗糖溶液,幾乎不溶於乙醇。
相對密度3.32~3.35。熔點2572℃。沸點2850℃。折光率1.838。有腐蝕性。
用途:1.可作填充劑,例如:用作環氧膠黏劑的填充劑;2.用作分析試劑,氣體分析時用作二氧化碳吸收劑,光譜分析試劑,高純試劑用於半導體生產中的外延、擴散工序,實驗室氨氣的乾燥及醇類脫l水等。3.用作原料,可製造電石、純鹼、漂白粉等,也用於製革、廢水淨化,氫氧化鈣及各種鈣化合物;4.可用作建築材料、冶金助熔劑,水泥速凝劑,螢光粉的助熔劑;5.用作植物油脫色劑,藥物載體,土壤改良劑和鈣肥;6.還可用於耐火材料、乾燥劑;7.可配製農機1、2號膠和水下環氧膠黏劑,還用作與2402樹脂預反應的反應劑;8.用於酸性廢水處理及污泥調質;9.還可用作鍋爐停用保護劑,利用石灰的吸濕能力,使鍋爐水汽系統的金屬表面保持乾燥,防止腐蝕,適用於低壓、中壓、小容量汽包鍋爐的長期停用保護;10、可以和水反應製備氫氧化鈣,反應方程式:CaO+H2O=Ca(OH)2,屬於化合反應。
包裝儲運:1.運輸注意事項:起運時包裝要完整,裝載應穩妥。運輸過程中要確保容器不泄漏、不倒塌、不墜落、不損壞。嚴禁與易燃物或可燃物、酸類、食用化學品等混裝混運。運輸時運輸車輛應配備泄漏應急處理設備。雨天不宜運輸;2.儲存注意事項:儲存於陰涼、通風的庫房。庫內濕度最好不大於85%。包裝必須完整密封,防止吸潮。應與易(可)燃物、酸類等分開存放,切忌混儲。儲區應備有合適的材料收容泄漏物。
硫酸鋁
化學性質:極易溶於水,硫酸鋁在純硫酸中不能溶解(只是共存),在硫酸溶液中與硫酸共同溶解於水,所以硫酸鋁在硫酸中溶解度就是硫酸鋁在水中的溶解度。 常溫析出含有18分子結晶水,為18水硫酸鋁,工業上生產多為18水硫酸鋁。含無水硫酸鋁51.3%,即使100℃也不會自溶(溶於自身結晶水)。
不易風化而失去結晶水,比較穩定,加熱會失水,高溫會分解為氧化鋁和硫的氧化物。加熱至770℃開始分解為氧化鋁、三氧化硫、二氧化硫和水蒸氣。溶於水、酸和鹼,不溶於乙醇。水溶液呈酸性。水解後生成氫氧化鋁。水溶液長時間沸騰可生成鹼式硫酸鋁。工業品為灰白色片狀、粒狀或塊狀,因含低鐵鹽而帶淡綠色,又因低價鐵鹽被氧化而使表面發黃。粗品為灰白色細晶結構多孔狀物。無毒,粉塵能刺激眼睛。

氯化銅
藍綠色斜方晶系晶體,有毒。在潮濕空氣中易潮解,在乾燥空氣中易風化。易溶於水,溶於醇和
氨水、
丙酮。其
水溶液呈弱酸性。用於顏料、木材防腐等工業,、並用作消毒劑、媒染劑、催化劑。由於,氯化銅對皮膚有刺激作用,粉塵刺激眼睛,並引起結膜潰瘍。所以,生產人員要穿工作服、戴口罩、手套等勞保用品,生產設備密閉,車間通風良好。
 氯化銅
氯化銅溴化物
可溶性的
溴化物進入人體內後,離解出的溴離子,可加強大腦皮質的抑制過程,如Na、Br、KBr、NH4Br三者製成三溴合劑、對病人起鎮靜催眠的作用。
 溴
溴KCl是可溶性鉀鹽,通過靜脈滴注或口服進入體內,離解出的
鉀離子( 細胞外) 能與強心甙競爭受體,降低強心甙與其受體的親和力,從而減輕或阻止強心甙毒性的發展,同時,鉀離子本身還能降低心肌自律性,口服KCl溶液或靜脈滴注,可以抗心律失常。
鈣鹽主要有葡萄糖酸鈣、氯化鈣、乳酸鈣等。
(1) 抗過敏作用,鈣離子能降低毛細血管通透性、減少滲出,有助於減輕或緩解過敏症。
(2) 維持神經肌肉的正常興奮性。正常人血清鈣離子含量約9-11mg%,當血鈣的濃度低於6-7mg%時,神經肌肉的興奮性增高,可產生手足抽搐。此時靜脈注射鈣鹽,可迅速緩解這種現象。
(3) 對心肌有興奮作用:與洋地黃等聯合用藥時,能增加洋地黃的毒性,聯合用藥時要減量,以免增加毒性。此外,鈣離子還參與血凝過程,高濃度的,與鎂
離子拮抗作用,可用於鎂鹽中毒的解救。
碳酸鹽
又稱小蘇打,能夠中和胃酸,從而解除胃酸的胃及
十二指腸潰瘍面的刺激和損傷,有利於潰瘍的修復。但服用NaHCO3會使胃內壓增高,對嚴重潰瘍病患者,可能會引起穿孔,還有繼發性胃酸增多的現象,故臨床上一般不單獨用NaHCO3治療胃酸過多或胃潰瘍。靜脈注射NaHCO3可以治療酸中毒,口服尚有鹼化尿液的作用,與磺胺類合用,可防止其在泌尿道析出結晶,與鏈黴素合用治療泌尿道感染時,以加強其抗菌作用,大量口服可引起鹼中毒。
包括MgSO4和NA2SO4。口服其鹽類後,因不易吸收,使腸內滲透壓升高,阻止腸道內水分的吸收,使腸內容物增多,刺激腸壁,使腸蠕動加強,引起排便,此類藥物又稱瀉藥,NA2SO4主要用於排除毒物,口服高濃度的MgSO4或用十二指腸導管直接注入十二指腸,因其對腸黏膜的刺激,反射性引起膽囊收縮,促進膽囊排空,有利膽作用。
鐵製劑
鐵製劑主要是用來治療缺鐵性血症,二價鐵離子可被人體吸收,胃酸有助於亞鐵離子的形成;維生素C,食物中的還原物質如果糖等有助於三價鐵離子變成二價鐵離子,促進鐵的吸收,各種鐵製劑中,以硫酸亞鐵最為常用,吸收率較高,不良反應也較少,價格最便宜。
又名
笑氣,病人吸入可引起欣快感和麻醉狀態,但必須和氧氣合用(O2含量不低於20%),否則會由於缺氧而造成嚴重後果。又由於其麻醉藥效不強,可作為其它麻醉藥的誘導藥或用於撥牙和分娩止痛。
 氧化亞氮
氧化亞氮含氧酸鹽
(1) 簡單含氧酸 每分子中僅含一個成酸元素的簡單含氧酸,可將其在自由狀態下較為常見者定名為(正)某酸,正字一般省略;其他各酸則視其中成酸元素的氧化值較正酸高、低多少,及其有無—O—O—結構,而採用一定詞頭來命名。
一個分子中成酸原子不止一個,而各成酸原子之間又系直接相連者,稱為“連若干某酸”,在某酸的前面冠以相當的詞頭,下同。
由兩個簡單的一價醯基取代H—O—O—H中的氫而成的過酸,為含氧酸中常見的一種過酸,稱為“過二某酸”。
由兩個簡單含氧酸縮去一分子水的同多酸甚為常見,除可按5命名為“一縮二某酸”外,一般均習用“焦”字作詞頭來命名,也有用“重(音chóng)”字作為詞頭命名的,如H2Cr2O7就命名為重鉻酸。
設某元素最常見的含氧酸(即正酸)的化學式為HmXOn,,其中x的氧化值等於2n—m,則此元素的其他簡單含氧酸,可按其化學式和結構分別加上下列詞頭來命名(表4,表5)。
①偏自一個分子正酸縮去一分子水而成的酸,定名為偏酸。也可以稱做一縮(一)正某酸,其中“一”和“正”兩字通常均予略去。表4分子中僅含一個原子成酸元素的簡單含氧酸
成酸元素的氧化值 | 化 學式 | 詞頭 | 例解 |
(2n-m)+2 | HmXOn+1(有-O-O-結構) | 過 | | | HNO4 | H3PO5 | H2SO6 |
(2n-m)+2 | HmXOn+l(無-O-O-結構) | 高 | | HClO4 | | | |
(2n-m)+1 | Hm-1XOn(均無-O-O-結構) | 高 | HMnO4 | | | | |
2n-m | HmXOn | (正) | H2MnO4 | HClO3 | HNO3 | H3PO4 | H2SO4 |
(2n-m) -2 | HmXOn一1 | 亞 | H4MnO4 | HClO2 | HNO2 | H3PO3 | H2SO3 |
(2n-m) -3 | Hm+1XOn一1 | 次 | | | H2NO2 | | |
(2n-m) -4 | HmXOn-2 | 次 | | HClO | | H3PO2 | H2PO2 |
成酸元素的價數 | 化 學式 | 詞 頭 | 例 | 解 |
2n-m | Hm-1On-1XOXOn-1Hm-1 | (一縮)二,焦,重 | H 4P2O7 | H2S2O7 |
2n-m-2 | Hm-lOn-2XOXOn-2Hm-1 | (一縮)二亞 | H4P2O5 | H2S2O5 |
2n-m | Hm-1On-lXXOn-1Hm-1 | 連二 | H4P2O6 | H2S2O6 |
2n-m-2 | Hm-1On-2XXOn-2Hm-1 | 連二亞 | | H2S2O4 |
2H-m-3 | HmOn-2XXOn-2Hm | 連二次 | | H2N2O2 |
2n—m | Hm-1On-1XXs-2XOn-lHm-1 | 連多 | | H2S2O6 |
2n—m | Hm-1On-1XOOXOn-1Hm-1 | 過二 | H4P2O8 | H2S2O8 |
①此處Xs-2中的X均為二價,而其他兩個X的化合價為2n-m。
②原酸分子中氫氧基的數目和成酸元素的氧化值相等時,可用詞頭“原”字來表示。稱為“原某酸”。原酸或以自由狀態存在,或以鹽或酯的形式存在。例如:
H4CO4原碳酸 H6TeO6原碲酸
H4SO6原硫酸 H4SiO4原矽酸
H5PO5原磷酸
③硫代的含氧酸中用硫原子(S)代替氧原子(O)而得的酸,通稱為硫代酸,分別叫做“幾硫代某酸”,其中“幾”為“一”字時可以省去。其他硫屬取代氧的酸,可以依此而命名為硒(碲)代某酸。例如:
H2S2O3硫代硫酸 HSCN 硫(代)氰酸
H2CS3三硫代碳酸 HSeCN 硒(代)氰酸
④鐵的含氧酸:理論上存在的鐵的含氧酸HFeO2及H2FeO4分別命名為(正)鐵酸和高鐵酸,其鹽則分別稱為(正)鐵酸鹽和高鐵酸鹽。
(2)酸酐和醯基:簡單含氧酸完全脫水後形成的二元氧化物,除了可按二元化合物命名外,還可以依從原來的酸名,命名為某(酸)酐。例如:
化學式 視作二元化合物視作某酸酐
CO2 二氧化碳 碳(酸)酐
N2O5 五氧化二氮 硝(酸)酐
N2O3 三氧化二氮 亞硝(酸)酐
SO3 三氧化硫 硫(酸)酐
SO2 二氧化硫 亞硫(酸)酐
簡單的含氧酸脫去氫氧基後餘下的基叫做
醯基,醯基從原來的酸名命名。若酸中全部氫氧基均已除去,就叫做某醯(基);若僅除去一部分氫氧基,則命名為某酸幾醯(基),幾指除去的氫氧基數目而言,基字通常可省(—SO
2OH和—SOOH則另定名稱為
磺基與亞磺基)。例如:
SO2— 硫(酸)醯(基)CrO2— 鉻(酸)醯基
Cr(OH)O2— 鉻酸一醯(基) VO2— 釩(酸)醯基
WO2— 鎢(酸)醯基
(3)取代含氧酸 其他基取代含氧酸中氫氧基後形成的酸叫做取代含氧酸,一般均從原來的酸命名為幾某基某酸,一字均予省略,基字最好不省略。僅以含—SO3H者稱做某磺酸;含一SO2H者叫某亞磺酸。例如:
NH2PO(OH)2氨基磷酸 Cl·SO2·OH 氯基磺酸
(NH2)2P2O3(OH)2氨基焦磷酸 NH2·SO·OH 氨基亞磺酸
ClCrO2(OH) 氯基鉻酸 NH2·SO2·OH 氨基磺酸
(4)簡單含氧酸鹽
①中式鹽酸中能電離的氫全部被金屬根或陽電性根取代而成的中式鹽,命名為某酸某(金屬)。
在含氧酸鹽名稱中,化合價通常恆定的金屬元素,其價數不必標明;化合價通常僅有兩種的金屬元素,其價數用亞、(正)、高等詞頭來標明,和二元化合物所規定的相同。
化合價通常不止兩種的金屬元素,其價數一般用一價、二價、三價等詞頭標明。但是為了使這些金屬元素常見的含氧酸鹽名稱能夠簡明起見,特對下述金屬元素的某些常見價數規定用亞、(正)或高等詞頭標明,且正字通常省略。
錳:二價為正。
鉑:二價為亞,四價為正。
稀土金屬:二價為亞,三價為正,四價為高。
例如,無變價者:
AlAsO4砷酸鋁
通常僅有兩種變價者:
Cu
2CO
3碳酸亞銅CuCO
3碳酸銅 碳酸銅
碳酸銅CoSO4硫酸鈷Co2(SO4)3硫酸高鈷
化合價通常不止兩種者:
MnSO4硫酸錳Mn2(SO4)3硫酸三價錳
稀土金屬:
Ce(SO4)2硫酸高鈰Ce2(SO4)3硫酸鈰
變價金屬的價數也可以在相應的元素名稱後加帶括弧的羅馬數字來標明。如上述兩種化合物可依次稱為:硫酸鈰(Ⅳ)、硫酸鈰(Ⅲ)。
②酸式鹽與鹼式鹽酸式鹽中的氫用“氫”字表示,羥基鹽中的氫氧基用“羥”來表示。氧基鹽中的氧用“氧化”表示。“
氫”、“
羥”、“氧化”等字均置於金屬名前,其數目用一、二、三等詞頭表示,一字通常省略。
常見的、在水溶液中穩定的陽離子的氧化金屬根,給予下列特定名稱;其鹽除可按上述氧基鹽命名法命名外,尚可按此項特定名稱來命名。
氧化金屬根的名稱如下,其中“一”字可省略,“二”字不可省略。
HfO鉿氧根UO鈾(一)氧根
MoO2鉬二氧根UO2鈾二氧根
TiO鈦氧根ZrO鋯氧根
ThO釷氧根WO鎢氧根
如果金屬元素具有不同的氧化數,應該在金屬的名稱後面用加圓括弧的羅馬數字標明其氧化
數。氧化金屬根的化合價,則在其名稱的後面用加括弧的阿拉伯數字;或在其化學符號的右上角
用阿拉伯數字來標明。例如MoO鉬(Ⅲ)氧根(1+);MoO鉬(Ⅴ)氧根(3+)。
例如,酸式鹽:
NaH
2PO
4磷酸二氫 Na
2HPO
4 磷酸二氫鈉
磷酸二氫鈉 磷酸氫二鈉
磷酸氫二鈉化學式 一般命名 用特定根名命名
BiONO3 硝酸氧化鉍 硝酸氧鉍
(SbO)2SO4硫酸二氧化二銻 硫酸氧銻
(VO2)2SO4硫酸四氧化二釩 硫酸雙氧釩
(UO)2SO4硫酸二氧化二鈾 硫酸氧鈾
(UO)2(ClO4)2高氯酸二氧化鈾 高氯酸雙氧鈾
(VO)SO4 硫酸氧化釩 硫酸(二價)氧釩
b.羥基鹽
Cu(OH)IO4 碘酸羥銅
V(OH)2(SO4)3硫酸二羥二釩(V)
複雜的酸式鹽和鹼式鹽,在用上述方法命名時,若根據其他根基的數目可以算出酸根的數目,則通常都略去表示酸根數目的詞頭,因為幾某酸之類的名稱容易和同多酸鹽的名稱相混。
複雜的酸式鹽或鹼式鹽還可以視作分子化合物來命名,將酸或鹼的名稱放在前面,鹽的名稱放在後面,中間用化學介詞“合”字連綴來命名。分子的數目用一、二、三等詞頭來標明,並在名稱的後面附上化學式,但是當確定它的結構是屬於配位化合物時,則應按配位化合物來命名
表6 命名方法
化學式 | 用氫字命名 | 視作分子化合物 | 類 名 |
複雜的酸式鹽: | | | |
KIO3·2HIO3=KH2(IO3)3 | 碘酸二氫鉀 | 二(碘酸)合碘酸鉀 | 酸式碘酸鉀 |
4K2SO4·3H2SO4=K8H6(SO4)7 | 硫酸六氫八鉀 | 三(硫酸)合四(硫酸鉀) | 酸式硫酸鉀 |
5K2SO4·3H2SO4=K5H3(SO4)4 | 硫酸三氫五鉀 | 三(硫酸)合五(硫酸鉀) | 酸式硫酸鉀 |
複雜的鹼式鹽: | | | |
CuCO3·Cu(OH)2 | 碳酸二羥銅 | 氫氧化銅合碳酸銅 | 鹼式碳酸銅 |
Al2(SO4)a·Al(OH)3=Al(OH)SO4 | 硫酸羥鋁 | 氫氧化鋁合硫酸鋁 | 鹼式硫酸鋁 |
SnO·SnCO3 | 碳酸氧化亞錫 | 氧化亞錫合碳酸亞錫 | 鹼式碳酸亞錫 |
③混鹽和復鹽 混鹽和復鹽可依照3(2)的規定命名,當有幾個電負性時,在名稱中將電負性較強者放在前面;有幾個電正性組分同時存在時,在名稱中者放在前面。混鹽和復鹽也可視作分子化合物來命名,在名稱中將分子量較小者放
Ca(NO3)Cl 氯化硝酸鈣 NH4MgPO4磷酸鎂銨
Ca(OCl)Cl 氯化次氯酸鈣KCaP4磷酸鈣鉀
KNaCO3碳酸鈉鉀
KCl·MgCl2·6H2O 六水合氯化鎂氯化鉀,俗名光鹵石
Fe(NH4)2(SO4)2硫酸亞鐵銨
或FeSO4·(NH4)2SO4硫酸銨合硫酸亞鐵
其他
同多酸與同多酸鹽、雜多酸與雜多酸鹽
(1)同多酸 由兩個或兩個以上同種簡單含氧酸分子縮水而成的酸叫做同多酸,命名方法是:由r分子正某酸HmXOn(或原某酸HmXOn)縮去q分子水而成的同多酸,稱為“q縮r某酸”(或q縮r原某酸)。
焦酸(重酸)也可以說是屬於同多酸之列,但因為比較簡單而常見,所以在簡單含氧酸中已述及了。
(2)同多酸鹽它有兩種命名法。
①按照同多酸的名稱,稱為“幾縮幾某酸幾某”(或幾縮幾原某酸幾某);因為陽離子數已註明,所以幾縮二字可以省去。此命名法常用。
②將同多酸鹽按比例解析成為酸酐或鹼酐來命名。在名稱中將酸酐與鹼酐的比例用阿拉伯數字表示,寫在名稱前的方括弧中,名稱為[X:Y]某酸某。例如:
實驗式按①法命名 解析式按②法命名
Na4B2O5(一縮)二硼酸四鈉 2Na2O·B2O3[1:2]硼酸鈉
Na2Mo2O7(一縮)二鉬酸二鈉 Na2O·2MoO2[2:1]鉬酸鈉
Na4V2O7焦釩酸鈉、(一縮)二釩酸四鈉 2Na2O·V2O5[1:2]釩酸鈉
Na2B4O7(五縮)四硼酸二鈉 Na2O·2B2O [2:1]硼酸鈉
Na2W2O7(一縮)二鎢酸二鈉 Na2O·2WO3[2:1]鎢酸鈉
(3)雜多酸雜多酸命名有兩種方法。兩法都是將雜多酸解析為水、成酸的金屬氧化物及非金屬或兩性金屬所成的酸,並據此命名。但以阿拉伯數字在名前記出其數目比
細胞中的
水是活細胞中含量最多的化合物。不同種類的生物體中,水的含量不同;不同的組織、器官中,水的含量也不同。
細胞中水的存在形式有自由水和結合水兩種,結合水與其他物質相結合,是細胞結構的重要組成成分,約占4.5%;自由水以游離的形式存在,是細胞的良好溶劑,也可以直接參與生物化學反應,還可以運輸營養物質和廢物。總而言之,各種生物體的一切生命活動都離不開水。
細胞內無機鹽大多數以離子狀態存在,其含量雖然很少,但卻有多方面的重要作用:有些無機鹽是細胞內某些複雜化合物的重要組成成分,如Fe是血紅蛋白的主要成分,Mg是葉綠素分子必需的成分;許多無機鹽離子對於維持細胞和生物體的生命活動有重要作用,如血液中鈣離子含量太低就會出現抽搐現象;無機鹽對於維持細胞的酸鹼平衡也很重要。
 氧化鉻
氧化鉻 氯化鈉
氯化鈉 磷酸
磷酸
 氯化鉀
氯化鉀 一氯一氧化釩
一氯一氧化釩 二氧化碳滅火器
二氧化碳滅火器 氫氧化鈉
氫氧化鈉
 氯化銅
氯化銅 溴
溴 氧化亞氮
氧化亞氮 碳酸銅
碳酸銅 磷酸二氫鈉
磷酸二氫鈉 磷酸氫二鈉
磷酸氫二鈉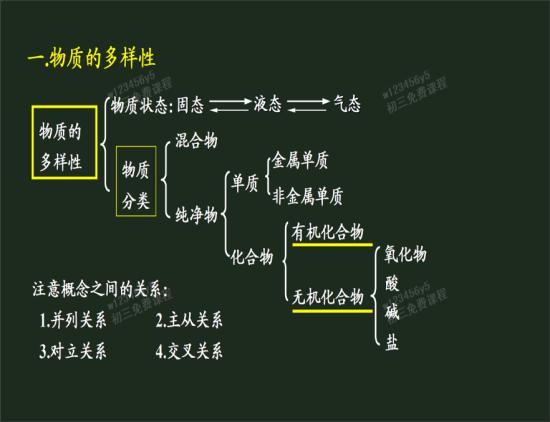
 氫氧化鈣
氫氧化鈣 硫酸
硫酸