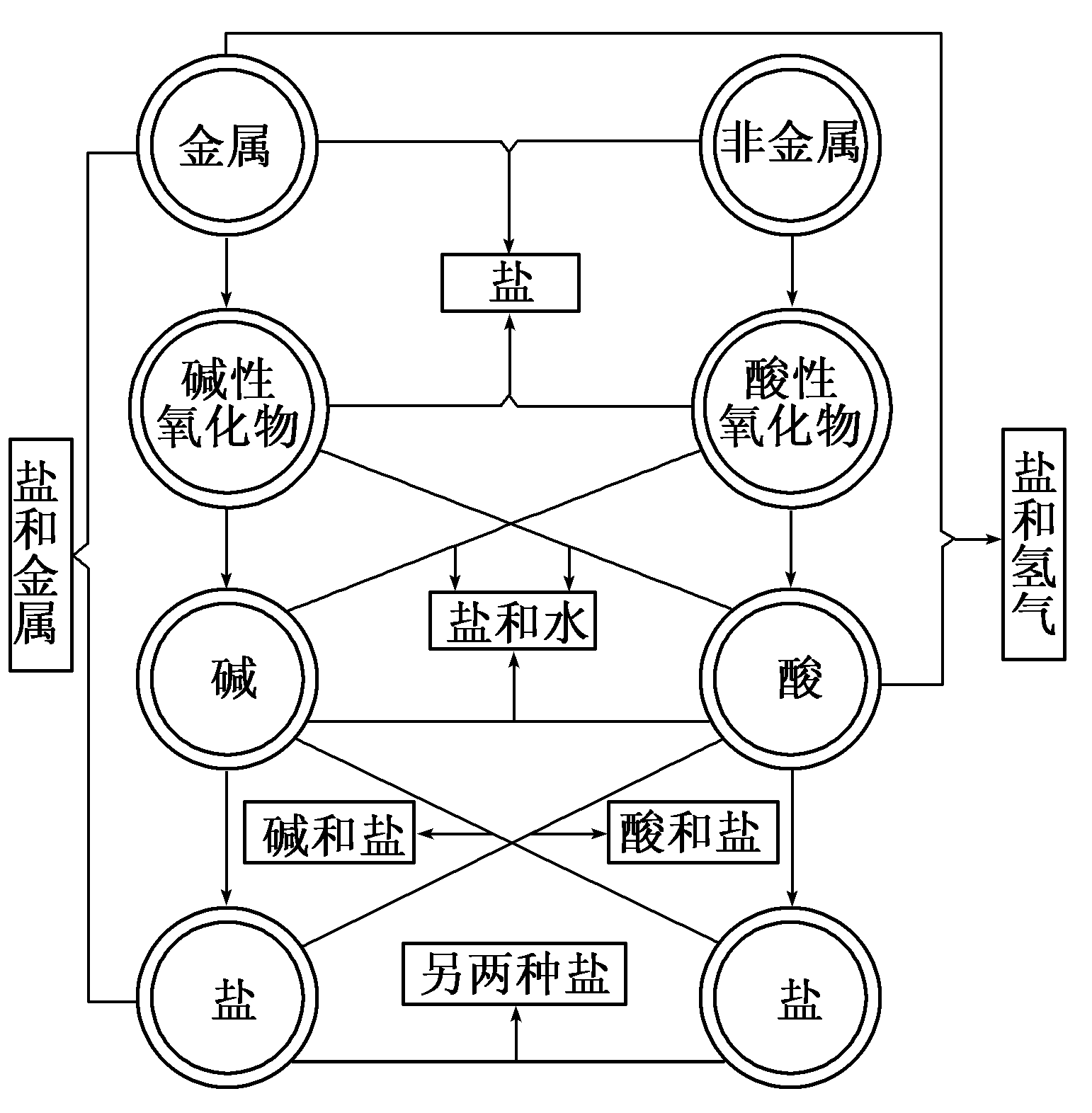
簡介
我們知道,鹼跟酸反應生成鹽和水,鹼跟某些非
金屬氧化物反應,以及碳酸鹽與酸反應,也生成鹽和
水.例如
2NaOH+CO2=Na2CO3+H2O
Ca(OH)2+SO3=CaSO4+H2O
Ca(OH)2+SO2=CaSO3↓+H2O
此類非金屬氧化物稱為酸性氧化物
非金屬氧化物大多數是酸性氧化物,我們熟悉的非金屬氧化物中,一氧化碳和
一氧化氮不是酸性氧化物,因為它們的性質和酸性氧化物不同,通常不能將其歸入酸性氧化物。NO
2 N2O等也不是酸性氧化物。
酸性氧化物包括所有酸度指數大於1的氧化物。一個典型的酸性氧化物是石英(SiO2),其酸度指數為2,它在酸度指數為1的鹼性熔劑LiM中的溶解度比在其他大量氧化物中的都大,而在酸性熔劑中的溶解度則偏小。富含Al2O3、P2O5和SO3的氧化物與之相似。酸性氧化物的特點是溶解度曲線的斜率為正。和鹼性氧化物的情形類似,比LiM中氧化鋰含量更高的熔劑和這些酸性氧化物具有更好的相容性,但這種熔劑流動性更好,更容易結晶。
除上述四種氧化物外,所有的酸性氧化物都具有一般意義上的溶解度,如Fe2O3、TiO2、WO3和Sb2O3等。其溶解度逐漸上升至LiT—LiM的中間附近,然後開始下降,在80%四硼酸鋰附近時接近0。然而,這種溶解度的下降是偶然的,僅僅是因為受結晶的影響,溶解度應該和SiO2的一樣繼續上。
性質及其他
通性
1.與水反應生成相應的酸(除了
二氧化矽SiO
2,它不與水反應)
2.與鹼反應只生成一種鹽和水
其他
1、酸性氧化物大多數能跟水直接化合生成含氧酸.
CO2+H2O=(可逆)H2CO3
SO3+H2O=H2SO4
SO2+H2O=(可逆)H2SO3 (亞硫酸)
2、含氧酸也可以受熱分解生成酸性氧化物.例如,將亞硫酸加熱可得到二氧化硫和水:
H2SO3=SO2+H2O
在這裡二氧化硫可以看做是亞硫酸脫水後的生成物.
SiO
2,N
2O
5,也是酸性氧化物,但
二氧化矽不溶於水,不能與水直接化合生成矽酸
3、判定酸性氧化物最重要依據是化學反應前後各元素化合價保持不變.
4、由兩種元素組成,其中一種元素是氧元素
特例
二氧化矽是較特殊的酸性氧化物。
二氧化矽可以和氫氟酸反應,但不能同水反應(刻蝕玻璃的反應)
注意
非金屬氧化物中大多數是酸性氧化物。
含氧酸才有酸性氧化物。
一氧化碳、一氧化氮,二氧化氮不是酸性氧化物。