研究歷史
1979年Senger等首次報導與惡性轉化有關的一種包含RGD
整合素結合區的
磷酸化糖蛋白與腫瘤的關係,稱之為轉化相關性磷酸蛋白。後來Franzen等從
骨基質和
牙齒中分離出一種磷酸蛋白,特性與轉化相關性磷酸蛋白相似,人們將其命名為OPN.後來一些學者在不同的組織細胞中發現了OPN,因此OPN曾被稱為44kD骨酸蛋白,PP69,骨延蛋白1,尿蛋白,分泌的磷蛋白、
骨唾液酸蛋白、44kD骨磷蛋白和。自1986年來相繼克隆了大、小鼠OPN,人OPN,豬OPN,牛OPN,雞OPN和兔OPNcDNA.近年來,OPN在早期細胞免疫應答、
肉芽腫炎症、腫瘤發生及轉移的作用中倍受關注。(有刪減)
基因結構
OPN人的OPN
基因定位在染色體4q13,是單一編碼基因,8kb大小,具有7個
外顯子和6個
內含子組成。小鼠位於
5號染色體上,基因長約7Kb,包括7個外顯子,其5’端有
啟動子序列,該啟動子中IKb長度也被測序並用GCG
程式分析了轉錄因子的可能識別部位,這些轉錄因子包括API-5、PEA-3、PEA-1、Ets等。
OPN
基因結構的變異性較大。OPN本身是多
等位基因,在小鼠有3個等位基因,人類至少有2個等位基因。通過比較分析,發現儘管不同種屬甚至同一
種屬不同組織的OPN基因具有一定的
多態性,其總體核苷酸序列還是呈中度保守性,其中編碼N末端和C末端以及含
RGD序列的50個胺基酸區具有高度序列保守性。
OPN
啟動子包括1個TATA盒(-28-22)、1個顛倒的CCAAT盒(-55-50)及1個GC盒及多種轉錄因子的結合位點。API結合部位是高度保守的增強子樣元件。OPN基因啟動子上含有多個
應答元件,如VitD
反應元件,
糖皮質激素反應元件,Ras反應元件,激活蛋白(AP)21結合位點等。在OPN啟動子上有5個PEA-3的識別位點,PEA是癌基因轉錄因子Ets家族的重要靶點,在多種基因的TPA應答中起重要作用。RAE是ras激活元件,位於OPN啟動子的-725-712,它是一個類Ets序列,在Ha-ras
轉染細胞O田N
轉錄增強與其有關。在
啟動子顛倒的CCAAT盒上,距轉錄起始點-53-49處有-v-Sre
反應元件,其參與介導v-Src轉染細胞中OPN轉錄水平的上調。啟動子中還存在BPV-E2(十70-+82)及API/PEA-1結合位點(-718-714,-312-305),它們都與
癌基因激活的表達增強有關,BPV-E2是一個由牛
乳頭瘤病毒工型所編碼的轉錄因子,能使病毒轉化嚙齒類動物的細胞。此外,研究發現,OPN基因5 '上游側區有孕激素調控元件。
蛋白結構
(1)
精氨酸-
甘氨酸-天冬氨酸(RGD)序列:Yee(1996年)提出OPN含有(Arg-Gly-Asp,RGD)序列,這一序列在不同物種的OPN中都普遍存在,這一序列對於OPN發揮
粘附功能起著重要的作用。
RGD序列為高度保守的特異性細胞黏附功能閾,通過該序列可與
細胞表面整合素受體 avβ、avβ3、avβ5等結合,介導
糖蛋白與細胞間的粘附過程,引起局部黏附,改變
細胞骨架,促進細胞游。RGD序列具有高度保守性,一旦變異或缺失將喪失其促粘附的功能。
(2)
凝血酶裂解位點:RGD序列結構中有RS位點,位於RGD序列
羧基端第6位
胺基酸殘基所形成的肽鍵,是凝血酶的裂解位點,可將其裂解成45kD及24kD兩個片斷。其中45kD片斷更能刺激細胞的黏附和遷移。與完整的OPN分子相比,被凝血酶裂解後含有RGD序列的N末端片斷(45kD片斷)促進粘附的功能反而加強,而缺乏
RGD序列的氨基片斷(24kD片斷)其
粘附能力減弱。凝血酶對OPN的剪下很可能是機體對OPN功能的一種自然生理調節。
表達方式
(1)高血壓:人主動脈
平滑肌細胞暴露在160 mmHg的高壓下3h,然後再培養,結果3h後發現高壓組同非高壓組相比細胞增殖11%。
免疫印跡分析發現,培養8 h以內OPN的表達沒有明顯的改變,24h後OPN表達比對照組增加大約50%;
(2)
高血糖:糖尿病人群中
動脈粥樣硬化的患病率較高,在糖尿病狀態下,大鼠近端小管細胞中OPN表達上調,另外,無論是人類還是大鼠,其動脈中膜平滑肌細胞的OPN表達均明顯亢進。高濃度葡萄糖處理的
平滑肌細胞表達OPN增加可被PKC抑制劑GF109203X抑制;
(3)低氧:對大鼠主動脈平滑肌細胞進行研究發現,在缺氧(3%O2) 2 h後OPN mRNA及OPN 蛋白的表達增加,6、12 h後下降,24 h後又增加。PKC和P38
絲裂原活化蛋白激酶抑制劑可以明顯減弱缺氧誘導的OPN表達,高濃度葡萄糖可以加強缺氧誘導的OPN表達;
(4)
干擾素:
IFN-γ(1 000 U/ml)明顯刺激平滑肌細胞內骨橋蛋白的表達,Western Blotting分析24 h干預組OPN量較對照組提高71.18%,48 h後較對照組提高75.66%,說明IFN-γ能在基因水平上刺激
大鼠平滑肌細胞內OPN的表達;
(5)
成纖維細胞生長因子:成纖維細胞生長因子-1(FGF-1)可以與其受體結合刺激大鼠主動脈平滑肌細胞表達OPN mRNA及OPN蛋白,高度選擇性的FGF-1
受體酪氨酸激酶(
Src)抑制劑PD166866可以減弱FGF-l誘導的OPN mRNA表達,另外PP2(Src特異性抑制劑)和
絲裂原細胞外信號反應激酶(
MEK)抑制劑PD98059都可以減弱FGF-l誘導的OPN 表達,說明FGF-1與
FGFR-1結合在
轉錄水平上通過Src/MEK/MAP信號路徑上調OPN的表達,通過OPN的表達可以
介導成纖維細胞的遷移;
分布範圍
調節方式
結合位點
OPN分布廣泛並受多種因素的調控,能與許多物質結合。
(1)結合多種整合素受體:已發現αvβ1、αvβ3、αvβ5、α5β1、α8β1、α4β1和α9β1等7種整合素能與OPN結合,2個α4β1整合素結合部位位於OPN的N-末端
凝血酶片酸的38 aa結構域上,α9β1能結合凝血酶斷裂的OPN N-末端上新型識別序列SVVYGLR。
(2)與
CD44變異體(CD44V)結合:CD44V以非
RGD序列結合OPN的C末端和N末端結構域。
(3)與
補體H因子結合:OPN能以高親和力結合H因子,調節補體活性。
自身調節
OPN有
磷酸化和
去磷酸化兩種形式,磷酸化修飾是影響OPN活性的一個重要因素。多種激酶對OPN中
絲氨酸、
蘇氨酸殘基發生磷酸化有不同部位,發生蛋白磷酸化部位不同可能是其
組織特異性的原因之一。磷酸化後的OPN與
細胞表面整合素受體結合,而去磷酸化OPN則能與
CD44受體結合,從而引起不同的效應。完整的OPN分子經
凝血酶剪下成為兩個大小不同的肽段,剪下後隱含於
蛋白胺基酸鏈內部的受體結合部位
RGD序列得以暴露,能夠介導RGD序列依賴的
黑色素瘤細胞的粘附和遷移,而完整的OPN分子則不具有這樣的功能。
骨橋蛋白基因5’上游-94~-80、-124~-115及-439~-409序列為
啟動子或
增強子順式作用元件,它們與相應的
反式作用因子結合後,增強骨橋蛋白基因的表達,但在三者中,後者的作用較前二者弱。-107~-105區域為
負調控元件,該元件與相應的反式作用因子結合後,降低骨橋蛋白的表達活性。
外部調節
OPN表達受激素生長因子,
癌基因產物的調控。不同的細胞類型可能有不同的調節機制,種因素能調控OPN的表達:
(1)感染和損傷能使T細胞和MФ的OPN上調錶達。
(5)葡萄糖和血清:高濃度的葡萄糖通過PKC依賴途徑和己糖胺途徑增強大鼠主動脈
平滑肌細胞表達OPN;血清活化的血管平滑肌細胞高水平表達OPN mRNA。
(6)
腎素-血管緊張素系統(RAS):腎局部遠段小管的RAS能上調OPN的產生,血管緊張素Ⅱ能直接增加人心臟OPN的表達。
(7)鈉鹽飲食:
高鹽飲食能增強完整腎或培養的
腎細胞表達OPN,而缺鈉飲食能減少大鼠腎表達OPN。
(8)其他:
低氧能刺激OPN mRNA
轉錄水平及OPN的產生,TPA、
癌基因(ras)能誘導OPN mR-NA的轉錄。患
IgA腎病的病人尿分泌OPN減少,振盪液體流動通過胞內Ca2+動員和
MAPK活化調節OPN基因。AngⅡ能直接增加心臟OPN的表達。高蛋白和高
膽固醇飲食可以誘導腎表達骨橋蛋白。
脂多糖(LPS)和
一氧化氮(NO)激活的
巨噬細胞,可誘導OPN
基因表達和蛋白質的分泌。腫瘤促進劑
佛波酯可通過激活多種轉錄調控因子而增強骨橋蛋白基因表達。
生物學作用
1.細胞
粘附 OPN通過依賴
RGD序列(αvβ1、αvβ3、αvβ5、αvβ1、α8β1)和非依賴RGD序列(α4β1、α9β1)結合存在於
細胞表面上的多種
整合素受體,起細胞粘附作用。OPN能粘附轉化的JB6細胞和HL60細胞(αvβ5和α4β1受體),且OPN以非RGD形式結合轉化的
成纖維細胞,
凝血酶斷裂的OPN能增強OPN與APP活化和
佛波酯活化的
血小板和
B淋巴細胞的粘附以及T細胞的粘附。
2.細胞募集 在體外OPN是一種化學趨化劑,外源性OPN以劑量依賴性方式(5.0~40 mg/L)指導成纖維細胞的遷移;它能刺激大鼠和牛
平滑肌細胞的遷移,能支持
粘附到人和小鼠T細胞,在體內皮下注射OPN後,在注射部位附近,OPN可以直接地誘導趨化作用並間接協助M向其它趨化劑移動。此外OPN還能促進
破骨細胞和
B細胞的趨化作用。
3.
細胞因子表達 OPN加強Th1並抑制Th2細胞因子的表達,它通過LPS刺激直接誘導產生IL-12,抑制
IL-10的表達。對IL-12的作用是依賴OPN
磷酸化。OPN可以使早期Th1細胞因子應答
極化。OPN還協同刺激人
T細胞增殖並促進人單個核細胞表達Th1細胞因子。關節內OPN作為產生IL-1、NO和
PGE2的一種固有的抑制劑。
4.信號轉導 骨橋蛋白作為一種基質功能性非膠原蛋白,主要通過兩種機制發揮
細胞信號分子的作用。一是以分子內RGD
基元與整合蛋白(integrin)家族分子結合;二是與
細胞表面粘附性糖蛋白CD44以非RGD依賴方式結合。兩種作用方式均通過激活細胞內特異性
信號傳導系統而介導細胞
粘附、遷移和增殖。OPN與
整合素受體結合後啟動信號轉導
級聯反應,促進
基因表達的改變,並誘導NF-КB活性,OPN能誘導骨骼蛋白的粘附斑激酶(FAK)和
樁蛋白(Paxillin)的
磷酸化改變,還能影響胞內Ca2+濃度。
7.
細胞免疫 OPN敲除後小鼠存在Th1介導的
免疫缺陷,
角膜感染HSV-1後,OPN敲除的小鼠不能對HSV表現遲發
超敏反應,也沒有發生HSV伴隨的
角膜炎,編碼OPN基因與小鼠抗
立克次氏體基因(RicR)鄰近,引起OPN早期缺陷的RicR
等位基因與立克次氏體感染有關,而高水平表達的OPN的小鼠對立克次氏體病有抵抗力,OPN在
Th1細胞介導的
肉芽腫的形成中起重要作用。
參與體內代謝
成骨細胞、
骨細胞及
破骨細胞均可分泌OPN,在
骨基質的礦化和吸收過程中有重要作用。OPN在軟骨
內化骨、膜內化骨區域含量豐富,在編織骨中,於成骨細胞、骨細胞的
胞漿中可以觀察。OPN分子中有一富含天冬氨酸的區域,通過這一區域OPN可以與組織中的輕
磷灰石結合而發揮作用。在骨基質礦化開始後,成骨細胞中OPN-NA水平開始增高,在
骨重建的過程中OPN的骨質線和
骨膜板有較高的濃度,這意味著OPN對成骨細胞的翁附過程和礦化的中止過程起重要作用。OPN在骨
重吸收的過程中也有重要的功能。在
骨吸收的過程中,當破骨細胞與骨接觸時,在細胞與骨間隙間形成一個特殊的微結構,此結構是由破骨
細胞膜皺摺形成的指狀結構與骨表面合圍而成的空白區,它與細胞外環境隔離,其中酸性環境促使鈣溶解和
磷酸鹽基質產生。
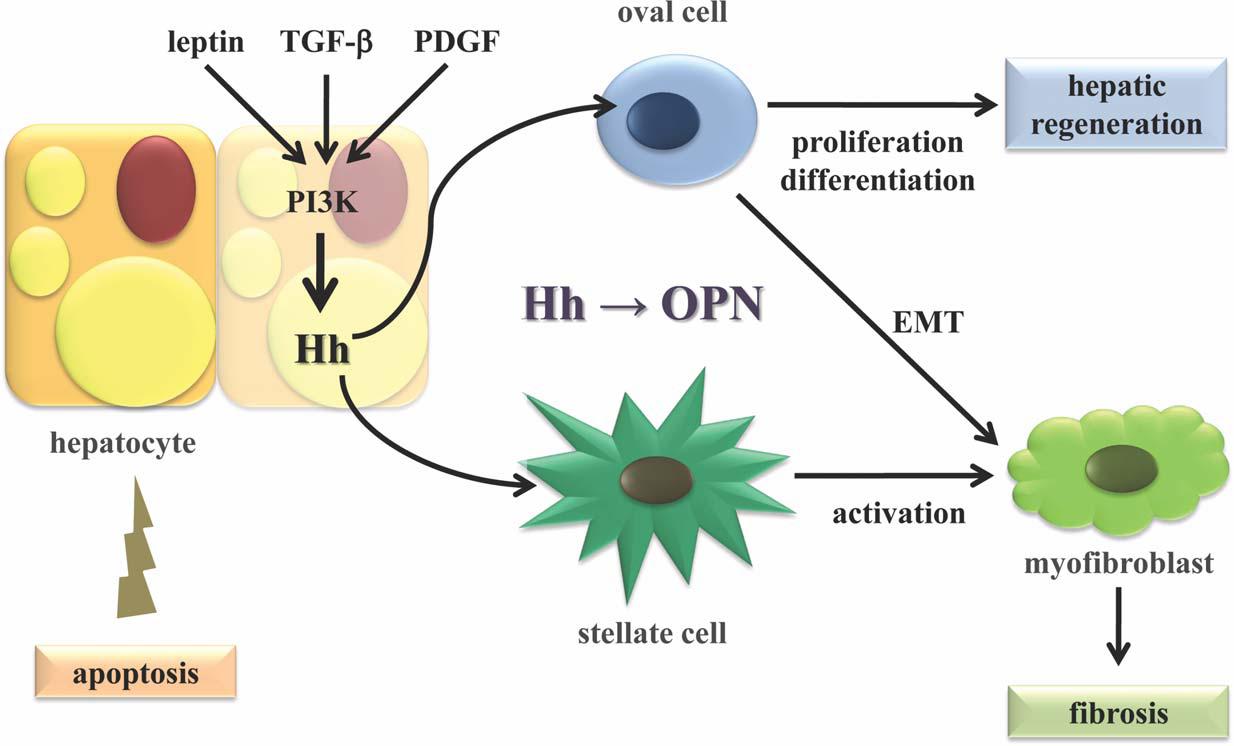
OPN與腫瘤
OPN有明顯促進腫瘤惡化的傾向。它可看作是一種惡性腫瘤生長的血清標誌。OPN在許多組織中不同水平的表達與機體對感染和創傷的反應有關,OPN與
實體瘤、動脈粥樣硬化斑塊、
肉瘤組織形成等病理過程相關聯。OPN在腫瘤的轉移過程中也發揮重要作用,也可以看作是腫瘤已發生轉移的標誌物,
腫瘤轉移病人血清中OPN水平明顯升高。OPN能抑制NO的產生從而提高轉移細胞的存活力。
OPN與免疫系統
OPN在
淋巴細胞,包括T細胞及NK細胞亞群,被非特異結合後不久即開始表達,另外OPN在對抗感染的
非特異性免疫及
自身免疫中起一定作用,其對
巨噬細胞有化學誘導的作用,因而有人認為可以把其看作一種
細胞因子[34]。OPN還可以與
CD44相互作用,能引起CD44依賴的化學
趨化性增高[35],而CD44的變異型能與OPN的C端或N端結合,而不依賴於
RGD序列OPN與消化系統
OPN廣泛分布於消化系統,特別是與外界相同的腔道的上皮表面。經檢測證實有OPN分布與表達的
消化器官和組織有:胃,
小腸,闌尾,
大腸,膽囊上皮,肝內膽管,胰腺,
唾液腺管和唾液腺
粘液細胞。胃腸道肌內
神經叢的
神經節,肝臟的巨噬細胞也有OPN的表達。
在
大鼠、小鼠及人的腎臟均有OPN的表達,OPN是血管
腎小管細胞和腎乳頭表面細胞均可分泌OPN,在體外可抑制
草酸鈣晶體的成核,生長和聚集,正常人尿中OPN的濃度為6×10-8mol·L-1,足以抑制
草酸鈣結晶,其在尿中濃度可以反映尿抑制結石形成的能力。
OPN在炎症反應過程中的作用
OPN主要通過β1和β3
整合素受體以及部分
白細胞表面的
CD44受體對白細胞的黏附和遷移發揮
調理作用。。OPN經
凝血酶酶切以後,其N-末端片段能夠與
巨噬細胞表面的CD44受體結合,對巨噬細胞具有趨化功能;而其C-末端片段則可與
細胞表面的整合素受體αvβ1相互作用,
介導巨噬細胞的黏附和遷移。OPN與T細胞表面整合素受體以及CD44受體的相互作用能夠促進Th1的產生而抑制向Th2的分化,從而加強機體
細胞免疫的功能而抑制
體液免疫反應的發生。在
心肌細胞、
血管內皮細胞和巨噬細胞等細胞中,OPN能夠通過下調誘生型
一氧化氮合酶( inducibleNOS,iNOS)的表達,抑制
炎症反應的發生。OPN在炎症反應過程中具有
雙向調節作用,只是在不同的環境中OPN的作用可能會表現出不同的側重,如此可能更有助於控制炎症反應的強度,調節
組織修復的進程。
OPN與組織修復
成體組織中創傷多通過
瘢痕組織進行修復。在
肉芽組織中,絕大多數
新生血管內皮細胞中都存在OPN mR-NA的高表達。OPN能夠促進內皮細胞的增殖、遷移以及新生血管管形的發生。在缺血誘導的
視網膜血管化的發病過程中,OPN能夠通過介導
血管內皮細胞與
細胞外基質的相互作用,加速血管內皮細胞的增殖,促進新生血管床的形成。中膜血管平滑肌細胞(VSMC)參與
創傷癒合的進程,VSMC增殖以及細胞外基質堆積造成的
血管壁肥厚以及血管重塑過程中血管壁的收縮是導致血管管腔狹窄的主要原因。在VSMC
去分化過程中,OPN的表達明顯加強,OPN通過與
整合素受體αVβ3等的相互作用,調節VSMC的黏附和遷移。
總之,骨橋蛋白作為一種新的
細胞因子,在人體中發揮著重要的作用。越來越多的研究,證實著骨橋蛋白的重要性,相信以後還會發現更多它的神奇的作用,為人類疾病的研究和治療做出貢獻。