化學類別
CAS NO. 64544-07-6
英文名稱 CEFUROXIME AXETIL
英文別名 Cefuroxime 1-Acetoxymethyl Ester; 5-Thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid, 3-(((aminocarbonyl)oxy)methyl)-7-((2-furanyl(methoxyimino)a cetyl)-amino)-8-oxo-, 1-(acetyloxy)ethyl ester, (6R-(6alpha,7beta(Z)))-; Axoril; CCI 15641; Ceftin; Cefurax; Cefuroxime 1-acetoxyethyl ester; Cefuroxine 1-acetoxyethyl ester; Cepazine; Elobact; Kefurox; Oraxim; Ximos; Zinacef; Zinnat; 1-(acetyloxy)ethyl (6R,7R)-3-[(carbamoyloxy)methyl]-7-{[(2E)-2-furan-2-yl-2-(methoxyimino)acetyl]amino}-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate
化學名稱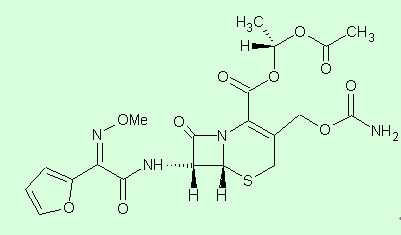 頭孢呋辛酯
頭孢呋辛酯 (6R,7R)-7-[2-呋喃基(甲氧亞氨基)乙醯氨基]-3-氨基甲醯氧甲基-8-氧代-5-硫雜-1-氮雜雙環[4.2.0]辛-2-烯-2-羧酸,1-乙醯氧基乙酯。
化學結構式
分子式
C20H22N4O10S
分子量
510.48
藥代動力學
該品脂溶性強,口服吸收良好,吸收後迅速在腸黏膜和門脈循環中被非特異性酯酶水解為頭孢呋辛,分布至全身細胞外液;
血清蛋白結合率約為50%。餐後口服該品250mg和500mg後,血
藥峰濃度(Cmax)於2.5~3小時到達,分別為4.1mg/L和7.0mg/L。食物可促進該品吸收,空腹和餐後口服該品的絕對
生物利用度分別為37%和52%。飲用牛奶可使該品的藥-時曲線下面積值(AUC值)增高。增高幅度在兒童組較成人組更為顯著。該品的血消除
半衰期(t1/2)為1.2~1.6小時,較
頭孢克洛、頭孢氨苄和
頭孢拉定略長;新生兒和腎功能減退患者的t1/2延長;老年(平均年齡84歲)患者的血清t1/2可延長至約3.5小時。空腹和餐後口服該品500mg後,24小時尿中排泄量分別為給藥量的32%和48%。
血液透析可降低該品的血藥濃度。
 血清蛋白
血清蛋白藥理毒理
該品為頭孢呋辛的乙醯乙酯。在體內水解後釋出
頭孢呋辛而發揮其抗菌活性,該品之作用機制、抗菌譜和抗菌作用皆與頭孢呋辛同。與其他口服
頭孢菌素相比,該品對革蘭陽性球菌包括肺炎雙球菌、A組(溶血性)
鏈球菌和金葡菌作用並不弱,而對革蘭陰性菌如淋球菌、
流感桿菌、卡他摩拉菌和大腸桿菌科等的作用則優於
頭孢克洛(cefaclor)。 該品為第二代
頭孢菌素類抗生素。口服經胃腸道吸收後,在
酯酶作用下迅速水解為頭孢呋辛而發揮抗菌作用。對革蘭陽性球菌的活性與
第一代頭孢菌素相似或略差,但對葡萄球菌和革蘭陰性桿菌產生的β內醯胺酶顯得相當穩定。除耐甲氧西林葡萄球菌、腸球菌屬和李斯特菌屬外,其他陽性球菌(包括厭氧球菌)對該品均敏感。該品對金黃色葡萄球菌的抗菌活性較
頭孢唑啉差,1~2mg/L的該品可分別抑制對
青黴素敏感和耐藥的全部
金黃色葡萄球菌。
適應病症
該品適用於
溶血性鏈球菌、金黃色葡萄球菌(耐甲氧西林株除外)及流感嗜血桿菌、大腸埃希菌、
肺炎克雷伯菌、奇異變形桿菌等腸桿菌科細菌敏感菌株所致成人急性
咽炎或扁桃體炎、急性中耳炎、上頜竇炎、
慢性支氣管炎急性發作、
急性支氣管炎、單純性尿路感染、皮膚
軟組織感染及無併發症淋病奈瑟菌性
尿道炎和宮頸炎。兒童咽炎或扁桃體炎、急性中耳炎及膿皰病等。
用法用量
口服。成人一般一日0.5g;
下呼吸道感染患者:一日1g;單純性
下尿路感染患者:一日0.25g。均分2次服用。單純性淋球菌尿道炎單劑療法劑量為1g。5~12歲小兒急性咽炎或急性
扁桃體炎:按體重一日20mg/kg,分2次服用,一日不超過0.5g;急性中耳炎、膿皰病:按體重一日30mg/kg,分2次服用,一日不超過1g。
 扁桃體
扁桃體不良反應
該品一般耐受性良好,常見的不良反應都是胃腸道反應如噁心、嘔吐、腹瀉及稀便等。偶有
偽膜性腸炎。由於片劑咬碎後味苦,兒童不歡迎。不主張用於5歲以下兒童。
 皮疹
皮疹3、偶見
假膜性腸炎、嗜酸粒細胞增多、血膽紅素升高、血紅蛋白降低、
腎功能改變、Coombs試驗陽性和一過性肝酶升高。
主要禁忌
⑴對該品及其他頭孢菌素類過敏者、有青黴素
過敏性休克或即刻反應史者及胃腸道吸收障礙者禁用。⑵5歲以下小兒禁用。
孕婦及哺乳期婦女用藥
⑴動物試驗中未發現對胎兒的有害證據,但在人類研究中缺乏足夠的資料,因此僅在有明確指征時,孕婦方可慎用該品。⑵該品可經乳汁排出,故哺乳期婦女應慎用或暫停哺乳。
 消化道
消化道兒童用藥
5歲以下小兒宜服用頭孢呋辛酯混懸液。
老年患者用藥
老年(平均年齡84歲)患者的血消除半衰期(t1/2)可延長至約3.5小時,因此應在醫生指導下根據腎功能情況調整用藥劑量或用藥間期。
注意事項
1、該品與青黴素類或頭黴素類(cephamycins)有交叉過敏反應,因此對青黴素類、青黴素衍生物、青黴胺及頭黴素類過敏者慎用。
2、腎功能減退及肝功能損害者慎用。3、有
胃腸道疾病史者,特別是
潰瘍性結腸炎、局限性腸炎或抗生素相關性結腸炎者慎用。
 肝細胞
肝細胞4、長期服用該品可致菌群失調,引發
繼發性感染。如發生輕度
假膜性腸炎,停藥即可,但對於中、重度假膜性腸炎患者,須對症處理並給予抗
艱難梭菌的抗菌藥物。
5、該品應於餐後服用,以增加吸收,提高血藥濃度,並減少胃腸道反應。
6、該品應吞服,不可嚼碎。
7、對實驗室檢查指標的干擾:
抗球蛋白(Coombs)試驗可出現陽性;硫酸銅尿糖試驗可呈假陽性,但葡萄糖酶試驗法不受影響;高鐵氰化物血糖試驗可呈假陰性,但葡萄糖酶試驗法和
抗壞血酸氧化酶試驗法不受影響;血清
丙氨酸氨基轉移酶、門冬氨酸氨基轉移酶、
鹼性磷酸酶和血尿素氮可升高;採用Jaffe反應進行血清和
尿肌酐值測定時可有假性增高。5歲以下小兒禁用該品,宜服用頭孢呋辛酯混懸液。
8、動物試驗中未發現對胎兒的有害證據,但在人類研究中缺乏足夠的資料,因此僅在有明確指征時,孕婦方可慎用該品。9、該品可經乳汁排出,故哺乳期婦女應慎用或暫停哺乳。老年(平均年齡84歲)患者的血消除半衰期(t1/2()可延長至約3.5小時,因此應在醫生指導下根據腎功能情況調整用藥劑量或用藥間期。
 抗球蛋白
抗球蛋白相互作用
⑴呋塞米、依他尼酸、布美他尼等強利尿藥,
卡氮芥、鏈佐星等抗腫瘤藥及
氨基糖苷類抗生素等腎毒性藥物與該品合用有增加腎毒性的可能。⑵克拉維酸可增強該品對某些因產生β內醯胺酶而對該品耐藥的革蘭陰性桿菌的抗菌活性。⑶該品與
丙磺舒合用可使該品的藥-時曲線下面積值(AUC值)增加約50%。⑷該品與抗酸藥合用可減少該品的吸收。
 β細胞
β細胞製劑規格
⑴
頭孢呋辛酯片⑵頭孢呋辛酯膠囊按C16H16N4O8S計算⑴0.125g⑵0.25g
 血漿蛋白
血漿蛋白藥物鑑別
1、在含量測定項下記錄的
色譜圖中,供試品中A、B異構體峰的保留時間應與對照品中A、B異構體峰的保留時間一致。2、該品的紅外光吸收圖譜應與頭孢呋酯對照品的圖譜一致。
 色譜圖
色譜圖藥物檢查
結晶性 取該品,依法測定(附錄Ⅸ D),應無消光位和雙折射現象。
異構體取該品適量,照含量測定項下的方法試驗,B異構體峰的相對保留時間約為0.85,A異構體峰的相對保留時間為1.0。供試品色譜圖中A異構體峰的面積與A、B異構體峰的面積和之比應為0.48~0.55。水分 取該品,照水分測定法(附錄Ⅷ M 第一法 A)測定,含水分不得過1.5%。有關物質 取該品適量,精密稱定,加流動相製成每1ml中約含0.2mg的溶液,作為供試品溶液;精密量取適量,加流動相製成每1ml中約含6μg的溶液,作為對照溶液。照含量測定項下的方法試驗,取對照溶液20μl注入
液相色譜儀,調節儀器靈敏度,使主成分峰高約為記錄儀滿量程的10%,再取供試品溶液和對照溶液各20μl,分別注入液相色譜儀,記錄色譜圖至主峰保留時間的2.5倍,供試品溶液如顯雜質峰,量取各雜質
峰面積的和,不得大幹對照溶液主峰的面積。熾灼殘渣 取該品1.0g,依法檢查(附錄Ⅷ N),遺留殘渣不得過0.2%。重金屬 取熾灼殘渣項下遺留的殘渣,依法檢查(附錄Ⅷ H 第二法),含重金屬不得過百萬分之二十。
 血清
血清含量測定
照
高效液相色譜法(附錄Ⅴ D)測定。色譜條件與系統適用性試驗 用十八烷基矽烷鍵合矽膠為填充劑;以0.2mol/L磷酸二氫銨溶液-甲醇(62:38)為流動相;檢測波長為278nm。取頭孢呋辛酯對照品適量,精密稱定,用流動相溶解(必要時可超聲處理)並製成每1ml中含0.2mg的溶液,取此溶液在60℃水浴中加熱至少1小時,即得相對保留時間約為1.2的頭孢呋辛酯△<2>-異構體,取20μl注入液相色譜儀,頭孢呋辛酯A、B異構體之間,頭孢呋辛酯A異構體與頭孢呋辛酯△<2>-
異構體之間的分離度應符合規定。
 頭孢呋辛酯
頭孢呋辛酯理論板數按頭孢呋辛酯A異構體峰計算,應不低於1500。測定法 取該品適量,精密稱定(約相當於頭孢呋辛50mg),置100ml量瓶中,加甲醇振搖,使溶解,並稀釋至刻度,搖勻,精密量取10ml,置20ml量瓶中,用流動相稀釋至刻度,搖勻,取20μl注入液相色譜儀,記錄色譜圖;另取頭孢呋辛酯對照品適量,同法測定。按外標法以
峰面積計算。
雜質分離
實驗部分
儀器與試藥日本島津高效液相色譜儀CLASSLC10A,SPD10A紫外檢測器,CR6A數據處理機。頭孢呋辛酯原料(廣州某藥廠提供),甲醇(色譜純),磷酸二氫胺(分析純)。
色譜條件色譜柱,DickmaC18柱(5μm,150mm×46mm);流動相A:0.2mol/L磷酸二氫胺溶液,流動相B:甲醇;流速,1.3mL/min,梯度洗脫;檢測波長,278nm;進樣量,20μL。
方法結果
精密稱取供試品75mg,置50mL量瓶中,加甲醇溶解並稀釋至刻度,搖勻,作為供試液;另精密吸取供試液5mL,置100mL量瓶中,加甲醇稀釋至刻度,再吸取1mL置25mL量瓶中,加甲醇稀釋至刻度,作為對照溶液;另取甲醇作為空白溶液,各取20μL,分別進樣,
梯度洗脫,0~5min,流動相B的比例從15%增至35%,維持10min;60min時,流動相B的比例增至48%,65min時,流動相B的比例增至70%,維持5min,75min時,流動相A的比例增至85%,維持10min。以外標法計算各雜質及總雜質的含量。
專家討論
頭孢呋辛酯的主要雜質是頭孢呋辛酯Δ3異構體(熱降解產生),反頭孢呋辛酯異構體(光解產生),以及其他各種合成中帶入的副產物和其他雜質。據報導,ICP已就新藥研製中關於雜質的檢查達成共識:凡含量大於0.1%的雜質原則上都在控制之列。很明顯,頭孢呋辛酯原料中,Δ3異構體、反頭孢呋辛酯異構體的含量均已大於0.1%,若採用CHP2000收載的限度方法,僅控制了總雜質的量,對單個雜質沒有作出限度規定,似不甚合理。
BP2000對幾個主要雜質的限度分別作出規定,但採用的是簡單的歸一化法,由於雜質含量與主成分含量相差較大,很難同時準確測量主成分峰面積和雜質峰面積,而參數的設定,對大峰和小峰面積測量準確度的影響,也會造成計算誤差。有專家提出,採用自身對照法,既克服了簡單歸一化法的缺點,又解決了缺乏雜質對照品的問題。取樣品溶液分別於60℃水浴1h及254nm紫外照射24h,混合溶液,分別採用梯度洗脫法和恆定洗脫法進行分離,兩法均可分離出頭孢呋辛硫酸鹽(異構體B、A)、頭孢呋辛酯Δ3異構體、反頭孢呋辛酯(異構體B、A)等雜質。梯度洗脫法較恆定洗脫法具更佳峰形及分離度,可分離出更多的雜質,如二α頭孢呋辛乙醚異構體等雜質.
 頭孢呋辛酯
頭孢呋辛酯 血清蛋白
血清蛋白 扁桃體
扁桃體 皮疹
皮疹 消化道
消化道 抗球蛋白
抗球蛋白 β細胞
β細胞 血漿蛋白
血漿蛋白 色譜圖
色譜圖 血清
血清 頭孢呋辛酯
頭孢呋辛酯 血清蛋白
血清蛋白 扁桃體
扁桃體 皮疹
皮疹 消化道
消化道 抗球蛋白
抗球蛋白 β細胞
β細胞 血漿蛋白
血漿蛋白 色譜圖
色譜圖 血清
血清