解釋
單質
拼音:dān zhì
英文:elementary substance
一般來說,單質的性質與其元素的性質密切相關。比如,很多
金屬的
性質都很明顯,那么它們的單質
還原性就很強。不同種類元素的單質的性質差異在結構上反映得最為突出。
與單質相對,由多種元素組成的純淨物叫做
化合物。自然界中的物質大多數為化合物。
一種元素組成的純淨物,叫做單質。
由一種元素的
原子組成的以
游離形式較穩定存在的物質。例如
氧氣(O2)、
氯氣(Cl2)、
硫黃(S8)、
鐵(Fe)等。單質和元素是兩個不同的概念。元素是具有相同
核電荷數(
質子數)的原子的統稱。一種元素可能有幾種單質,例如氧元素有
氧(O2)和
臭氧(O3)兩種單質。
例金屬:鋁(Al)、鐵(Fe)
非金屬:氧(O)、硫(S)、矽(Si)、磷(P)、碘(I)、氫(H)
稀有氣體:氦(He)、氖(Ne)、氬(Ar)、氪(Kr)、氙(Xe)、氡(Rn)。
內容
首先,單質一定是純淨物,純淨物是有一種物質構成的,比如銅,鐵,碳酸鈣等。
其次,單質是由一種元素構成的,銅和鐵是單質,但碳酸鈣不是,因為碳酸鈣由C,Ca,O三種元素構成,所以它不是單質,它是化合物,化合物也是純淨物。
再次,同一種元素可以有不同種結合方式,比如C,它可以構成是石墨,
金剛石等,如果把他們混在一起,不能說是純淨物,只能是同一種元素構成的混合物。
所以說,單質是同種元素構成的純淨物。
錯誤表達有:
2.純淨物是單質;
3.只有一種元素的是純淨物;
單質,化合物,純淨物,混合物的區別和聯繫。
單質結構
金屬
固態金屬以金屬鍵結合成
金屬晶體。為了保證晶體的穩定,原子採取密堆積形式。由於晶體內部有游離電子,所以金屬都導電,而且比較容易失去電子。
非金屬
非金屬單質一般以
共價鍵結合成分子。常溫下,很多非金屬單質都以
雙原子分子形式存在,如
氫氣、氧氣等。一些元素還可形成多原子的分子,如臭氧(O3)、
足球烯(C60)等。
惰性氣體
上述物質中都沒有可自由移動的
電子,因此它們都是電的不良導體。例外的是
石墨,它具有特殊的
層狀結構,質地鬆軟,且可以導電。
同素異形體
由於構成物質的原子(或
分子)的排列不同,或原子的成鍵方式不同,使得同一種元素產生多種單質。各種同素異形體都是不同的物質,具有不同的
物理性質,但
化學性質不一定不同。
參照意義
在熱力學中,以每種元素最穩定的單質的標準生成焓和標準生成自由能為0,以此推算其他物質的熱力學量。由於組成物質的元素只有一種,一般單質的標準熵比化合物低。
關係
共同點
單質和化合物都屬於純淨物。判斷物質是單質還是化合物,首先看物質是不是純淨物,只有屬於純淨物才有可能屬於單質或化合物。不能認為由
同種元素組成的物質一定就是單質,也不能認為由不同種元素組成的物質一定是化合物。例如
白磷和
紅磷,雖然都由
磷元素組成,但它們不屬於一種物質,混合後屬於混合物,不屬於純淨物。又如空氣由多種元素組成,包括
氧元素、
氫元素、
碳元素、
氮元素、
稀有氣體元素等,它屬於混合物,不屬於純淨物,更不是化合物。
區別
從概念上看,單質是由一種元素組成的純淨物,而化合物是由兩種或兩種以上的元素組成的純淨物;從微觀範圍看,單質由同種原子構成,化合物由不同種原子構成;從性質上看,單質不能發生
分解反應,化合物可以發生分解反應。
聯繫
單質和化合物雖然組成元素的種數不同,但它們可以相互轉化。單質可以和單質反應生成化合物,也可以和化合物反應生成另一種化合物。如鎂條在空氣中燃燒生成氧化鎂,其中
鎂、氧氣屬於單質,氧化鎂屬於化合物;一氧化碳燃燒生成
二氧化碳,其中
一氧化碳和二氧化碳屬於化合物,氧氣屬於單質。化合物也可以通過分解反應生成單質,如
過氧化氫分解,放出氧氣,同時生成
水。過氧化氫屬於化合物,氧氣屬於單質。
最後值得注意的是,組成單質的雖然是同一種元素,但是在
單質分子中,有單原子分子(1個原子構成1個分子),如鐵、鎂等;也有雙原子分子(2個原子構成1個分子),如氧氣、氮氣等;還有
多原子分子(多個原子構成1個分子),如臭氧等。另外
同種元素可以形成不同的單質,如白磷和紅磷,氧氣和臭氧等,它們在一定條件下能相互轉化,這種轉化屬於
化學變化。
定義
化合物由兩種或兩種以上
元素的
原子(指不同元素的原子種類)組成的
純淨物。是指從
化學反應之中所產生的
純淨物(區別於單質)。
舉例
化合物具有一定的特性,通常還具有一定的組成。
例:
氯化鈉(sodium chloride, NaCl)是一種通過
鹽酸(hydrochloric acid, HCl)和
氫氧化鈉(sodium hydroxide, NaOH)的化學作用(
中和反應)而成的化合物。HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
元素分類
無機化合物不含碳氫化合物,如
硫酸鉛(lead (II) sulphate, PbSO4),分為:酸、鹼、鹽和
氧化物 共價化合物,例如水。
註:某些化合物,如醋酸(CH3COOH)及醋酸鹽,也屬於有機物。
元素數量
物質世界是多姿多彩的,從古代最原始的分類(金、木、水、火、土)到目前有確定組成的幾十萬種化合物,每年還有大量新的化合物被發現。
比較公認的是美國《
化學文摘》編輯部的統計:已發現天然存在的化合物和人工合成的化合物,大約有三百多萬種。這些化合物有的是由兩種元素組成的,有的是由三種、四種以至更多的
化學元素組成的。 每年依然有新
合成的化合物數量達30餘萬,其中90%以上是有機化合物。
混合物
化合物組成元素不再保持單質狀態時的性質;混合物沒有固定的性質,各物質保持其原有性質(如沒有固定的熔、沸點)。
化合物組成元素必須用化學方法才可分離;
化合物組成通常恆定。混合物由不同種物質混合而成,沒有一定的組成,不能用一種
化學式表元素、單質、化合物的主要區別
要明確
單質和化合物是從元素角度引出的兩個概念,即由同種元素組成的純淨物叫做單質,由不同種元素組成的純淨物叫做化合物。無論是在單質還是化合物中,只要是具有相同核電荷數的一類原子,都可以稱為某元素。
三者的主要區別是:元素是組成物質的成分,而單質和化合物是指元素的兩種存在形式,是具體的物質。元素可以組成單質和化合物,而單質不能組成化合物。
化合物
在通常人們的印象當中,化合物都是由幾種固定的按簡單數學配比的元素所組成,然而更多的化合物卻是
非等比化合物,尤其是無機化合物。所謂非等比化合物,就是組成是非計量比或非整比的化合物,即這些化合物的組成原子間不為小整數比,且組成可在一定範圍內變化,不符合
定組成定律。
分類
最近的研究表明,該類化合物大致包括以下幾類:
(1)由兩種或多種金屬共熔形成的合金體系。由於各類合金可能存在多種相平衡點,因而形 成了多種組成可變的合金化合物。如大家所熟知的鋼,由Fe與C組成的二元體系中,由於組成的不同可形成奧氏體、萊氏體、馬氏體和珠光體等不同的相。
(2)在岩鹽體系中,晶格中由於生成極小部分的缺陷而呈現特殊顏色的化合物,如下鈉蒸氣中加熱氯化鈉形成Na+δCl(δ<<1),是一種淺綠色化合物。
(3)許多過渡金屬的氧化物、
硫化物、氮化物、碳化物或氫化物,這些具有豐富的物理和化學性質的化合物一般都是非等比化合物。
構成
化合物種類繁多,達一千多萬種,有的化合物由陰陽離子構成,如氯化鈉NaCl、
硫酸銨
(NH4)2SO4等;有的化合物由分子構成,如
氨氣NH3、甲烷CH4、五氧化二磷P2O5、二硫化碳CS2等;有的化合物由原於構成,如
二氧化矽SiO2、碳化矽SiC等。化合物可以分為無機化合物(不含碳的化合物)和有機化合物(含碳的化合物,除CO、CO2、H2CO3和
碳酸鹽等)兩大類。按化學性質的不同,可以把化合物分為氧化物、酸類、鹼類和鹽類。
純度鑑定
化合物純度的鑑定方法,從快速、便宜、簡便的要求出發,主要來之於以下幾點:
TLC法
1 展開溶劑的選擇,不只是至少需要3種不同
極性展開系統展開,我的經驗是首先要選擇三種
分子間作用力不同的溶劑系統,如氯仿\甲醇,環己烷\
乙酸乙酯,正丁醇\醋酸\水,分別展開來確定組分是否為單一斑點.這樣做的好處是很明顯的,通過
組份間的各種差別將組分分開,有可能幾個相似組份在一種溶劑系統中是單一斑點,因為該溶劑系統與這幾個組分的分子間力作用無顯著的差別,不足以在TLC區分。而換了分子間作用力不同的另一溶劑系統,就有可能分開.這是用3種不同極性展開系統展開所不能達到的.
2 對於一種溶劑系統正如wxw0825所言,至少需要3種不同極性展開系統展開,一種極性的展開系統將目標組分的Rf推至0.5,另兩種極性的展開系統將目標組分的Rf推至0.8,0.2。其作用是檢查有沒有極性比目標組分更大或更小的雜質。
3 顯色方法,光展開是不夠的,還要用各種顯色方法。一般一定要使用通用型
顯色劑,如10%硫酸,碘,因為每種顯色劑(不論是通用型顯色劑,還是專屬顯色劑在工作中都遇到他們都有一化合物不顯色的時候),再根據組分可能含有混雜組份的情況,選用專屬顯色劑。只有在多個
顯色劑下均為單一斑點,這時才能下結論樣品為薄層純
熔程法
原理很簡單,純化合物,
熔程很短,1,2度。混合物熔點下降,
熔程變長。
HPLC法
對於HPLC因為常用的系統較少,加之其分離效果好,我們一般不要求選擇三種分子間作用力不同的溶劑系統,只要求選這三種不同極性的溶劑系統,使目標峰在不同的保留時間出峰。
軟電離質譜法
如ESI-MS,APCI-MS。大極性化合物選用ESI-MS,極性很小的化合物選用APCI-MS,這些
軟電離質譜的特點是只給出化合物的準
分子離子峰,通過正
負離子的相互溝通來確定
分子量。如果樣品不純,就會檢出多對準
分子離子峰,不但確定了純度,還能明確混雜物的分子量。
核磁共振法
從氫譜中如果發現有很多積分不到一的小峰,就有可能是樣品是樣品中的雜質。利用門控去偶的技術通過對碳譜的定量也能實現純度鑑定。
好了,不能再多寫了。這裡只是對常見的純度鑑定方法做了一個小結,從快速,便宜,簡便的要求出發,以第一點最合要求,往後次之,所以對第一點詳加講述。當然每種方法多有各自的局限性,如基於氫譜的純度鑑定,如果發現有很多積分不到一的小峰,還有可能使樣品中的活潑質子,基於
軟電離質譜的純度鑑定,如果混雜物的分子量與目標物一樣就無法檢出。等等還有很多。這需要大家在工作中積累,思考。要講的話,我看好幾篇都講不完。
最後說一下對化合物純度的要求,世界上不存在100%純的化合物。你希望要多高的純度應該與你的目的有關,例如,如想測核磁共振鑑定結構,一般要求95%的純度,如果想測EI-MS,純度越
高越好。99%以上。
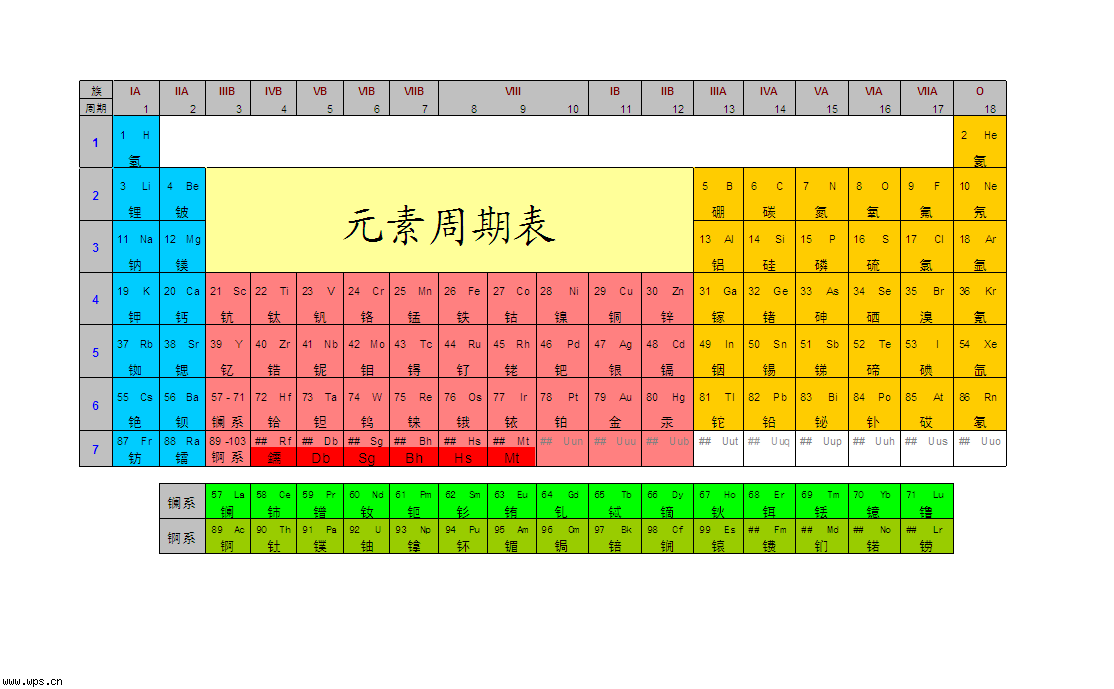
周期表
化學元素周期表所有
化學物質都包含元素,即任何物質都包含元素,隨著人工的核反應,更多的新元素將會被發現出來。
質子數量相同,
中子數量不同的原子或離子也屬於相同的元素,質子數相同,中子數量不同的原子或離子被稱為
同位素.
元素的種類是由質子數決定的
中文命名
元素以部首來表示常溫(298K)時之物態:
“釒”為金屬。例:銅、銠、鐵 (汞是非“釒”字旁的金屬)
其他為非金屬。
“石”為非金屬固體。例:矽、碳
“氣”為非金屬氣體。例:氧、氟
“氵”為非金屬液體。例:溴、
除從
古代中國就發現而且常用的元素(金、銀、銅、鐵、鉑、錫、硫、碳、硼、汞、鉛),元素的名稱是十九、二十世紀創造的,組成由個部首和表示讀音的部分。讀音部分幾乎全部是大約根據
歐洲和
北美洲現代或中古化學家或地方的名稱(參見#
歐文)
Er(Erbium)=釒+耳→鉺
Nd(Neodymium)=釒+女→釹
Eu(Europium)=釒=+有→銪
Ka(Kalium)=釒+甲→鉀
Na(Natrium)=釒+內→鈉
Sb(Stibium)=釒+弟→銻(用第一音節的一部分)
I(Iodine)=石+典→碘(用最後音節)
Ar(Argon)=氣+亞→氬(用第一音節的一部分)
少數部分元素中文名字是描述特色:
溴:味道臭
氯:顏色綠
氫:重量輕
氮:“淡”取沖淡空氣之意
氧:“養”取支持生命之意
English
“元素”-element
歐文命名
因為歐洲語文有親切的關係,除了那些各語文從遠古就知的,所用的元素名稱都是非常類似,因為科學名稱都來源於新拉丁文。大部分元素結尾是“-ium”,一些
羅馬語系語文結尾“-io”。例如,鉕在常見歐文是:
法文:prométhium
西班牙文、義大利文:prometio
加泰隆文:prometi
和中文元素名字不一樣的是歐文元素名字大部分是描述特色,其它:
Yttrium(釔)、Terbium(鋱)、Ytterbium(鐿):這三者都來自
瑞典小鎮伊特比。
10個左右來源於人或神名,例:
- Flash製作元素周期表
遊戲
製作簡介
中文名稱: 元素
英文名稱: Elements
發行時間: 2008年
製作發行: 製作廠商:QB9
遊戲發行:MumboJumbo
遊戲簡介
作為一名
鍊金術士,在這款以
文藝復興時期為背景的獨特消除遊戲中,你的任務是使用古老的鍊金術書—元素之書,來揭開其中隱藏的秘密,而且把各種元素轉變成新的物質。
遊戲評測
畫 面:
遊戲畫面表現出唯美的3D渲染效果,各種元素寶石的消除過程具有精彩光影特效,細膩的動態背景圖象包括水,火,星,光,空氣,宇宙等15大主題,會使你充分感受到自然界的壯觀秀麗。
聲 音:
悠揚而舒緩的
背景音樂,給玩家的整體感覺是恢弘中帶著神秘,以及動聽而富有質感的消除
音效,一切設計都很符合遊戲主題,將營造出一個神奇的魔法世界氛圍。
上手度:
遊戲的過關目標是在完成畫面上方要求的步驟數量同時,將分裂小寶石還原成大顆的元素,你可以通過滑鼠的操作進行換取,將2顆相同顏色的寶石放在同一區域內不斷合併,使寶石由小變大。
創 意:
不同於以往的消除作品,《元素》是一款非常新穎的消除遊戲,以消除元素的體積大小作為消除
創意,你可以將各種元素不斷結合來完成目標,充滿了策略性和趣味性。
可玩性:
遊戲分為經典的故事模式,充滿挑戰性的時間模式,和
自由選擇寶石種類的無止境模式,包括數十個充滿益智性的有趣關卡,你可以不斷創造多達15種顏色的寶石,《元素》具有很高的耐玩性。