基本介紹
硫化物的定義,硫化物合成,物理性質,顏色,溶解性,化學性質,水解,灼燒,氧化,硫化物酸鹼性,重要的硫化物,多硫化物,硫化物的鑑定,硫化物來源,硫化物的套用,
硫化物的定義
鹼金屬硫化物和硫化銨易溶於水,由於水解其溶液顯鹼性。鹼土金屬、鈧、釔和鑭系元素的硫化物較為難溶。當陽離子的外層電子構型為18電子和18+2電子時,往往由於較強的極化作用而形成難溶的、有顏色的硫化物。大多數不溶於水的硫化物可溶於酸並釋放出硫化氫,極難溶的少數金屬硫化物(如CuS、HgS)可用氧化性酸將其溶解,此時S被氧化成硫而從溶液中析出。難溶金屬硫化物在溶液中存在溶解-沉澱平衡。控制溶液的酸度,可以改變溶液中S2- 離子的濃度,從而將溶解度各不相同的難溶金屬硫化物分別沉澱出來。這是定性分析中用硫化氫分離、鑑定金屬離子的基礎。
硫化物合成
無機硫化物通常可通過以下方法合成:(註:K為國際溫度單位開爾文)
1、單質直接化合,例如:
C + 2S CS2
CS2

2、硫酸鹽或高價硫化物的還原,例如:
Na2SO4 + 4C→ Na2S + 4CO 1373K
In2S3 + 2 → In2S + 2H2S
→ In2S + 2H2S

3、溶液中或高溫的複分解反應,例如:
FeCl2 + H2S → FeS↓ + 2HCl
3SiO2 + 2Al2S3→ 3SiS2 + 2Al2O3 1373K
4、以硫代酸鹽為原料製取,例如:
(NH4)2MoO4+ 4(NH4)2S + 4H2O → (NH4)2[MoS4] + 8NH3·H2O
(NH4)2MoO4+ 2HCl --(加熱)→ MoS3 + H2S + 2NH4Cl
5、高價硫化物加熱分解,例如:
MoS3 --(加熱)→ MoS2 + S
物理性質
顏色
溶解性
金屬的酸式硫化物都可溶於水,但正鹽中只有鹼金屬硫化物和硫化銨可溶。一般地講,金屬硫化物的溶解度可通過陽離子極化力(離子電荷數/離子半徑,Z/r)的大小來預測。陽離子極化能力的增強,將導致化合物共價性的增加,極性減小,因而溶解度也降低。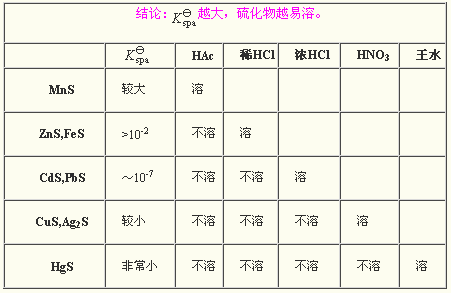 金屬硫化物在酸中溶解性
金屬硫化物在酸中溶解性
 金屬硫化物在酸中溶解性
金屬硫化物在酸中溶解性化學性質
水解
S2-+ H2O ⇌ HS-+ OH-
HS-+ H2O ⇌ H2S + OH-
H2S的pKa分別約為:pKa1 = 6.89 和 pKa2 = 15±2, 因此金屬硫化物溶液會呈不同程度的鹼性,而鹼金屬的硫化物溶液的鹼性更是可以與相應的氫氧化物匹敵。
灼燒
灼燒硫化物礦物時可能發生兩種反應:
以上兩步都是冶鍊金屬時,轉化硫化物礦石的重要方法。
氧化
S2-- 2e-= S; -0.407V
硫化物酸鹼性
硫化物和相應的氧化物類似,其酸鹼性隨周期和族的變化也和氧化物的類似,但硫化物的鹼性不如氧化物強。
H2S | NaHS | Na2S | As2S3 | As2S5 | Na2S2 |
H2O | NaOH | Na2O | As2O3 | As2O5 | Na2O2 |
\ | 鹼性 | 鹼性 | 兩性 | 酸性 | 鹼性 |
同周期元素最高氧化態硫化物從左到右酸性增強;同族元素相同氧化態的硫化物從上到下酸性減弱;同種元素的硫化物中,高氧化態的硫化物酸性更強。因此As2S5酸性強於Sb2S5,而Sb2S5的酸性則要強於SnS2和Sb2S3。
重要的硫化物
硫化氫是一種無色有毒的氣體,臭雞蛋氣味,空氣中硫化氫的容許含量不超過0.01mg/L。硫化氫能夠與人體的血紅素中的亞鐵離子結合生成硫化亞鐵,使其失去反應活性。經常與硫化氫接觸會引起嗅覺遲鈍,消瘦,頭痛等慢性中毒。實驗室里常用金屬硫化物與酸作用製備硫化氫。硫化氫的水溶液是氫硫酸,二元弱酸。無論在酸性介質還是鹼性介質中,硫化氫的還原性都很強。
多硫化物
多硫化物是含有多硫離子Sn的化合物,n=2,3,4,5,6,...,9。多硫化物可由硫在硫化物溶液中煮沸製得,其溶液一般都為黃色,且顏色隨n值的增加而加深。


多硫化物在酸性溶液里很不穩定,酸化時即放出硫化氫和硫:

硫化物的鑑定
點滴法點滴法是鑑定硫離子和硫氫根離子的靈敏方法,其步驟為:在點滴板上混合可溶硫化物的鹼性溶液和1%的硝普酸鈉Na2[Fe(CN)5NO](亞硝基鐵氰化鈉)溶液,若試樣中存在S離子則會出現不同深度的紅紫色,靈敏度1:50000。其機理是[Fe(CN)5(NOS)]4-離子的生成。 除此之外,向點滴板中加入試液、濃鹽酸、幾顆對氨基二甲基苯胺晶體和0.1mol/L氯化鐵溶液,若在2~3分鐘後出現藍色,也可證明硫離子的存在。機理是生成了藍色的亞甲基藍。
硫化物來源
硫化物(sulfides)及其類似化合物包括一系列金屬、半金屬元素與S、Se、Te、As、Sb、Bi結合而成的礦物。礦物種數有350種左右,硫化物就占了2/3以上,其他為硒化物(selenides)、碲化物(tellurides)、砷化物(arsenides),及個別銻化物(antimonides)和鉍化物(bismuthides)。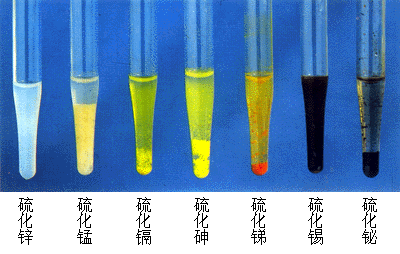 一些金屬硫化物
一些金屬硫化物
 一些金屬硫化物
一些金屬硫化物本大類礦物只占地殼總質量的0.15﹪,其中絕大部分為鐵的硫化物,其他元素的硫化物及其類似類似化合物只相當於地殼總質量的0.001﹪。儘管其分布量有限,但卻可以富集成具有工業意義的礦床,主要有有色金屬,如Cu、Pb、Zn、Hg、Sb、Bi、Mo、Ni、Co等均以本大類礦物為主要來源,故本大類礦物在國民經濟中具有重大意義。
硫化物的套用
硫化氫系統是傳統且較廣泛的分析陽離子的方法,主要依據各離子硫化物溶解度的顯著差異,將常見的陽離子分成五組。
組試劑 | HCl | 0.3 mol/L HCl, H2S 或 0.2~0.6 mol/L HCl TAA,加熱 | NH3 + NH4Cl (NH4)2S 或 TAA,加熱 | / | |
組的名稱 | I組 銀組 鹽酸組 | II組 銅 錫組 硫化氫組 | III組 鐵組 硫化銨組 | IV組 鈣鈉組 可溶組 | |
組內離子 | Ag Hg2 Pb | II A Pb Bi Cu Cd | II B Hg As(III,V) Sb(III,V) Sn(II,IV) | Al Mn Cr Zn Fe Co Fe Ni | Ba K Ca Na Mg NH4 |
由於H2S氣體毒性大,且儲存不便,故一般多以硫代乙醯胺(CH3CSNH2,TAA)水溶液作沉澱劑。
在酸性溶液中TAA水解產生H2S,可替代H2S: CH3CSNH2 + H + 2H2O ⇌ CH3COOH + NH4 + H2S↑ 在氨性溶液中水解生成HS,可替代(NH4)2S: CH3CSNH2 + 2NH3 ⇌ CH3-C(-NH2)=NH + NH4 + HS在鹼性溶液中水解生成S,可替代Na2S: CH3CSNH2 + 3OH ⇌ CH3COO + NH3 + H2O + S 硫化物的其他套用還有:

