形成方式
1.組成分子裡原子個數不同,如:氧氣(O2)和臭氧(O3)。
2.晶體,如:金剛石 (正四面體空間網狀結構的原子晶體)、石墨(層狀結構的混合型晶體)和C60(存在單個分子的分子晶體)。
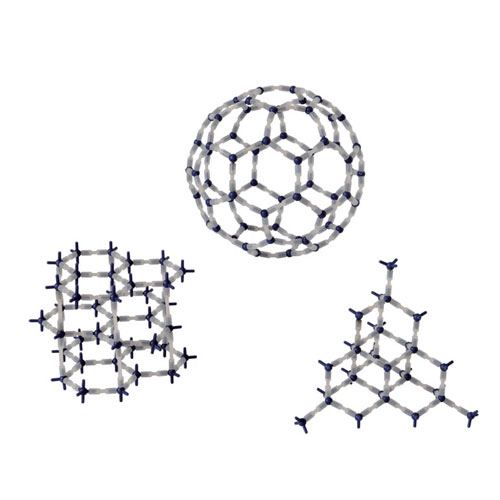 從左至右:石墨,C60,金剛石
從左至右:石墨,C60,金剛石3.晶體裡分子的排列方式不同,如:斜方硫和
單斜硫。
物理與化學性質
同素異形體之間的性質差異主要表現在物理性質上,性質差異的原因是結構不同。同素異形體之間的轉化屬於化學變化,但不屬於氧化還原反應。例如氧氣是沒有顏色、沒有氣味的氣體,而臭氧是淡藍色、有魚腥味的氣體;氧氣的沸點為-183℃,而臭氧的沸點為-112.4℃。
同素異形體的
化學性質相似。以熟知的金剛石與石墨為例,金剛石每個碳原子與相鄰的四個碳原子以共價鍵連線,形成四面體結構,是一種原子晶體。而石墨中,碳原子呈層狀排列,每一層的碳原子以共價鍵連線形成平面六邊形,因此相對穩定,但層與層只見僅依靠微弱的分子間作用力連線,易發生相對滑動,因此石墨的化學性質與金剛石相比更為活潑,物理性質差異更加明顯,金剛石是無色透明的晶體,熔點與硬度遠大於石墨。而石墨是深灰色、質軟、不透明,易導電的片狀固體。
相互轉化
在大氣平流層的25km處,存在一厚度為20km臭氧層,臭氧濃度可達10ppm。在臭氧層中,存在O2和O3相互轉化的動態平衡:O2⇌O3。在轉化過程中吸收了大量的紫外線,所以,臭氧層是地球上生物免遭紫外線傷害的自然屏障。 .
早在上個世紀30年代,就已經開始有石墨轉化為金剛石的工業生產。目前,製得的金剛石雖達不到寶石級,但滿足工業生產的要求還是綽綽有餘的。90年代後,由石墨製得C60等球狀分子和碳納米管及其化合物C60H60、C60F60及籠形的金屬化合物。2004年英國科學家又成功地從石墨晶體中剝離出單層的石墨片,這種世界上最薄的材料具有優異的導電導熱性和其他特殊的性質,必將在社會生產的各種領域大有作為。
同素異形體的相互轉化有時也會給人類帶來危害。最典型的例子是白錫在13.2℃時開始轉化為灰錫,低溫或已有少量灰錫時,這種轉變加速。由於白錫是金屬晶體,密度較大,而灰錫是金剛石型的原子晶體,密度較小,所以白錫在低溫轉化為灰錫時體積迅速膨脹,生成的灰錫呈粉末狀,造成錫製品的損壞。在不明真相的年代,這種現象被稱為“錫瘟”。1873年英國的斯科特率領的南極探險隊由於用錫焊制的油桶在低溫下發生“錫瘟”致使燃油泄漏而遇難。
相關示例
碳
碳的同素異形體有金剛石、石墨、富勒烯、碳納米管、石墨烯和石墨炔;它們的不同性質是由微觀結構的不同所決定的。
(1)金剛石
金剛石呈正四面體空間網狀立體結構,
碳原子之間形成
共價鍵。當切割或熔化時,需要克服碳原子之間的共價鍵,金剛石是自然界已經知道的物質中硬度最大的材料,它的熔點高。上等無瑕的金剛石晶瑩剔透,折光性好,光彩奪目,是人們喜愛的飾品,也是尖端科技不可缺少的重要材料。顆粒較小、質量略為低劣的金剛石常用在普通工業方面,如用於製作儀器儀表軸承等精密元件、機械加工、
地質鑽探等。鑽石在磨、鋸、鑽、拋光等加工工藝中,是切割石料、金屬、陶瓷、玻璃等所不可缺少的;用
金剛石鑽頭代替普通
硬質合金鑽頭,可大大提高鑽進速度,降低成本;鑲嵌鑽石的牙鑽是牙科醫生得心應手的工具;鑲嵌鑽石的眼科手術刀的刀口鋒利光滑,即使用一千倍的顯微鏡也看不到一點缺陷,是摘除眼睛內白內障普遍使用的利器。金剛石在機械、電子、光學、傳熱、軍事、航天航空、醫學和化學領域有著廣泛的套用前景。
 C60的結構
C60的結構(2)石墨
石墨是片層狀結構,層內碳原子排列成平面六邊形,每個碳原子以三個共價鍵與其它碳原子結合,同層中的
離域電子可以在整層活動,層間碳原子以
分子間作用力(范德華力)相結合。石墨是一種灰黑色、不透明、有金屬光澤的晶體。天然石墨耐高溫,熱膨脹係數小,導熱、
導電性好,摩擦係數小。石墨被大量用來做電極、坩堝、電刷、潤滑劑、鉛筆等。具有層狀結構的石墨在適當條件下使某些原子或基團插入層內與C原子結合成石墨層間化合物。這些插入化合物的性質基本上不改變石墨原有的層狀結構,但片層間的距離增加,稱為膨脹石墨,它具有天然石墨不具有的可繞性,回彈性等,可作為一種新型的工程材料,在
石油化工、
化肥、
原子能、電子等領域廣泛套用。
(3)富勒烯
富勒烯(Fullerene) 是單質碳被發現的第三種同素異形體。任何由碳一種元素組成,以球狀,橢圓狀,或管狀結構存在的物質,都可以被叫做富勒烯,富勒烯指的是一類物質。富勒烯與石墨結構類似,但石墨的結構中只有六元環,而富勒烯中可能存在五元環。1985年Robert Curl等人製備出了C60。1989年,德國科學家Huffman和Kraetschmer的實驗證實了C60的籠型結構,從此物理學家所發現的富勒烯被科學界推向一個嶄新的研究階段。富勒烯的結構和建築師Fuller的代表作相似,所以稱為富勒烯。
(4)碳納米管
碳納米管作為
一維納米材料,重量輕,六邊形結構連線完美,具有許多異常的力學、電學和化學性能。近些年隨著碳納米管及納米材料研究的深入其廣闊的套用前景也不斷地展現出來。
碳納米管,又名
巴基管,是一種具有特殊結構(徑向尺寸為納米量級,軸向尺寸為微米量級,管子兩端基本上都封口)的一維量子材料。碳納米管主要由呈六邊形排列的碳原子構成數層到數十層的同軸圓管。層與層之間保持固定的距離,約0.34nm,直徑一般為2~20 nm。並且根據碳六邊形沿軸向的不同取向可以將其分成鋸齒形、扶手椅型和螺旋型三種。其中螺旋型的碳納米管具有手性,而鋸齒形和扶手椅型碳納米管沒有手性。
(5)石墨烯
在2015年硼墨烯發現之前,石墨烯既是最薄的材料,也是最強韌的材料,斷裂強度比最好的鋼材還要高200倍。同時它又有很好的彈性,拉伸幅度能達到自身尺寸的20%。它是目前自然界最薄、強度最高的材料,如果用一塊面積1平方米的石墨烯做成吊床,本身重量不足1毫克便可以承受一隻一千克的貓。
石墨烯目前最有潛力的套用是成為
矽的替代品,製造超微型電晶體,用來生產未來的超級計算機。用石墨烯取代矽,計算機處理器的運行速度將會快數百倍。
另外,石墨烯幾乎是完全透明的,只吸收2.3%的光。另一方面,它非常緻密,即使是最小的氣體原子(氫原子)也無法穿透。這些特徵使得它非常適合作為透明電子產品的原料,如透明的觸摸顯示屏、發光板和
太陽能電池板。
作為目前發現的最薄、強度最大、導電導熱性能最強的一種新型納米材料,石墨烯被稱為“黑金”,是“新材料之王”,科學家甚至預言石墨烯將“徹底改變21世紀”。極有可能掀起一場席捲全球的顛覆性新技術新產業革命。
(6)石墨炔
石墨炔,是繼富勒烯、碳納米管、石墨烯之後,一種新的全碳納米結構材料,具有豐富的碳化學鍵、大的
共軛體系、寬面間距、優良的化學穩定性,被譽為是最穩定的一種人工合成的二炔碳的同素異形體。由於其特殊的
電子結構及類似矽優異的半導體性能,石墨炔有望可以廣泛套用於
電子、
半導體以及
新能源領域。研究表明,石墨炔是一種非常理想的儲鋰材料,且其獨特的結構更有利於鋰離子在面內和面外的擴散和傳輸,這樣賦予其非常好的
倍率性能,從實踐證明石墨炔是一種非常有前景的儲鋰能源材料,科學家也預測它在新能源領域將產生非比尋常的影響。
氧
氧的同素異形體有氧氣,臭氧,四聚氧,八聚氧。
(1)氧氣
氧氣,化學式O
2,式量32.00,是無色無味的氣體,也是氧元素最常見的單質形態。熔點為218.4℃,沸點為-183℃。
液氧為天藍色,固氧為藍色晶體。且不易溶於水,1L水中可以溶解約30mL氧氣。在空氣中,氧氣約占21% 。常溫下不是很活潑,與許多物質都不易作用。但在高溫下則很活潑,能與多種元素直接化合,這與氧原子的電負性僅次於
氟有關。
(2)臭氧
臭氧(O
3)又稱為超氧,是氧氣(O
2)的同素異形體。在常溫下,它是一種有特殊臭味的淡藍色氣體。臭氧主要存在於距地球表面20~35公里的
同溫層下部的
臭氧層中。在常溫常壓下,穩定性較差,可自行分解為氧氣。臭氧具有青草的味道,吸入少量對人體有益,吸入過量對人體健康有一定危害(不可燃,
純淨物)。氧氣通過
電擊可變為臭氧。
(3)四聚氧(又名過臭氧)
O
4的預計構型為
正四面體或者矩形,從兩種構型中性分子O
4,正一價分子O
4+和負一價分子O
4-的基態電子結構,並根據能量最低原則確定了各自的結構參數,從而得到了O
4分子2種結構的基態總能量、一價
電離能及電子親合勢能。O
4與氧原子、普通氧分子O
2和臭氧分子O
3的計算結果比較,顯示O4分子可以以正方形結構或正四面體結構形式存在,其中正方形結構更有可能是O
4分子的真實空間結構。
四聚氧有極其猛烈的氧化性,其氧化性在單質中最強,遠超氟氣、二氟化氪和各類氟化氧等已知的超強氧化劑。可與絕大多數物質甚至部分稀有氣體直接反應。近期甚至用O4與氬(Ar)直接化合製得了極不穩定的一氧化氬(ArO)。
(4)八聚氧(又名ε氧/紅氧)
四聚氧的分子式是O
4,1924年,
吉爾伯特·牛頓·路易斯首先預測了它的存在。1999年,科學家認為固態氧的ε相(壓強大於10GPa下存在)中氧的存在形式為O
4。然而2006年時,X射線晶體學表明這種被稱作ε氧或紅氧的穩定相實際上是O8。
形成於正常
大氣壓的54.36K(-218.79°C)以下。固態的氧氣由於吸收紅色光,像液氧一樣,是淺藍色透明物質。氧分子因它在分子
磁化(molecular magnetization)上與
晶體結構、
電子排布、
超導電性的關係而受到關注。氧分子是能承載
磁矩的唯一的簡單
雙原子分子(通常情況下縱使所有分子也只有少數能夠如此)。它被認為是“受自旋控制(spin-controlled)”的晶體,並因此展現出不尋常的磁性規律。在極高壓下,固氧從熱絕緣材料變成金屬的形態;而在極低溫下,它甚至能變成
超導體。對固氧的結構研究始於19世紀20年代,目前,已確定六種涇渭分明的晶體相。
磷
磷的同素異形體有多種,常見的有白磷、紅磷。
理化常數:
國標編號:41001
CAS號:7723-14-0
英文名稱:Phosphorus red
分子式:P
外觀與性狀:紫紅色無定形粉末,無臭,具有金屬光澤,暗處不發光。
分子量:123.90
熔 點:590℃(4357kPa)
密 度:
相對密度(水=1)2.20;相對密度(空氣=1)4.77。
穩定性:穩定
危險標記:8(易燃固體)
主要用途:用於製造火柴、農藥,及用於有機合成。
對環境的影響:
該物質對環境有害。
一、健康危害
侵入途徑:吸入、食入、經皮吸收。健康危害:經常吸入此種粉塵,可引起慢性磷中毒。可致皮炎。
毒性:屬低毒類。危險特性:遇明火、高熱、摩擦或撞擊有引起燃燒的危險。與氧化劑混合能形成有爆炸性的混合物。燃燒時放出有毒的刺激性煙霧。
化學反應活性較高,與氟、氯等能發生劇烈的化學反應。燃燒(分解)產物:氧化磷、磷烷。
現場應急監測方法:
直接進水樣氣相色譜法。
實驗室監測方法:
氣相色譜法。
應急處理處置方法:
一、泄漏應急處理
隔離泄漏污染區,周圍設警告標誌,切斷火源。建議應急處理人員戴好防毒面具,穿相應的工作服。用水潤濕,使用無火花工具收集於乾燥淨潔有蓋的容器中,倒至空曠的地方,乾燥後即自行燃燒。如果大量泄漏,與有關技術部門聯繫,確定清除方法。
二、防護措施
呼吸系統防護:佩帶防塵口罩。眼睛防護:必要時戴安全防護眼鏡。身體防護:穿工作服。手防護:戴防護手套。其它:工作現場嚴禁吸菸。工作後,淋浴更衣。注意個人清潔衛生。
三、急救措施
皮膚接觸:脫去污染的衣著,立即用清水徹底沖洗。就醫。眼睛接觸:立即提起眼瞼,用流動清水或生理鹽水沖洗至少15分鐘。吸入:迅速脫離現場至空氣新鮮處。必要時進行人工呼吸。就醫。食入:誤服者給充分漱口、飲水,就醫。滅火方法:乾粉、砂土。
(2)白磷
白磷是磷的一種同素異形體,分子是由四個磷原子構成的正四面體, 鍵角60°,化學式為P
4。為白色蠟狀固體,遇光會逐漸變為淡黃色晶體(所以又稱為黃磷),有大蒜的氣味,有毒。著火點很低,能自燃,在空氣中可以發光。白磷是一種易自燃的物質,其
燃點為40 ℃,但因摩擦或
緩慢氧化而產生的熱量有可能使局部溫度達到40 ℃而燃燒。因此,不能說氣溫在40 ℃以下白磷不會自燃。
白磷是一種有強毒的物質。人的中毒劑量為15mg,致死量為50mg。誤服白磷後很快產生嚴重的胃腸道刺激腐蝕症狀。大量攝入可因全身出血、嘔血、便血和循環系統衰竭而死。若病人暫時得以存活,亦可由於肝、腎、心血管的功能不全而慢慢死去。皮膚被磷灼傷面積達7%以上時,可引起嚴重的急性溶血性貧血,以至死於急性腎功能衰竭。常期吸入磷蒸氣,可導致氣管炎、肺炎及嚴重的骨骼損害。
白磷的貯存:
由於白磷非常危險,因此不能將白磷露置於空氣中。根據白磷不溶於水,且比水的密度大,可以將少量的白磷放入盛有冷水的廣口試劑瓶中,並經常注意保持足夠的水量。通過水的覆蓋,既可以隔絕空氣,又能防止白磷蒸氣的逸出,同時還能保持白磷處於燃點之下。不常用的白磷可以貯存於封口的試劑瓶中,並埋入沙地里。
白磷的取用:
由於白磷的
燃點低,人的手溫就容易使它燃燒,所以取用白磷時必須用鑷子去取,絕對不能用手指去接觸,否則手就會被灼燒,造成疼痛難愈的灼傷。如果遇到大塊白磷需要切割成小塊時,必須把它放在盛有水的水槽中,用小刀在水面下切割,絕不能暴露在空氣中進行,否則切割時摩擦產生的熱也容易使白磷燃燒。
白磷的用途:
白磷雖然危險,但也有很多用途。
在工業上用白磷製備高純度的磷酸。利用白磷易燃產生煙(P
2O
5)和霧(P
2O
5與水蒸氣形成H
3PO
4),在軍事上常用來制煙幕彈。還可用白磷製造
紅磷、
三硫化四磷、
有機磷酸酯、燃燒彈、殺鼠劑等。
在高壓下,白磷可轉變為
黑磷,它具有層狀網路結構,能導電,是磷的同素異形體中最穩定的。如果氧氣不足,在潮濕情況下,白磷氧化很慢,並伴隨有磷光現象。白磷可溶於熱的濃鹼溶液,生成
磷化氫和次磷酸二氫鹽;乾燥的氯氣與過量的磷反應生成
三氯化磷,過量的氯氣與磷反應生成
五氯化磷。磷在充足的空氣中燃燒可生成五氧化二磷,如果空氣不足則生成
三氧化二磷。
接觸白磷的物品的處理
由於白磷的毒性大且易自燃,接觸過白磷的實驗用品必須進行適當的處理。所用的刀子和鑷子要在通風廚中用酒精燈灼燒。擦過上述工具或用於吸乾白磷的紙片不能丟在廢紙簍里。也要在通風廚中燒掉。實驗中用過的水槽要衝洗數遍。人接觸白磷後的急救方法人的手接觸到白磷後,要立即用水沖洗,然後用2%的CuSO4溶液(或2%的AgNO3溶液)輕抹,再用3%~5%的NaHCO3溶液濕敷。禁止用油脂性的燒傷藥膏。如果誤服白磷而中毒時,要儘快用CuSO4溶液洗胃,發生的反應為:2P+5CuSO4+8H2O=5Cu+2H3PO4+5H2SO4 11P+15CuSO4+24H2O=5Cu3P↓+6H3PO4+15H2SO4 通過上述反應將劇毒的白磷轉化為無毒的H3PO4或不溶於酸的Cu3P沉澱。
與同分異構體關係
同分異構現象是指化合物具有相同的分子式,但具有不同結構的現象。
常見的異構類型有:
4.立體異構結構相似,但由於微小偏差導致結構不同。
(1)
順反異構立體異構的一種,由於雙鍵不能
自由旋轉引起的,一般指烯烴的雙鍵或多取代環烴的取代基位於環的不同側造成的
同分異構。
(2)
光學異構構造相同的分子,如使其一
平面偏振光向右偏轉,另一側向左。則兩種互為光學異構體。
(3)
手性異構手性異構就是光學異構。手性異構的兩分子像人的左右手一樣鏡像對稱。
5.構象異構同一種化合物的構象,可通過單鍵旋轉由一種變為另一種,則這兩種互為構象異構體。
注意:
同分異構體是存在於化合物的概念,而同素異形體的適用對象是單質。
與同位素關係
同素異形體是指
同種元素的不同單質, 它們是單質,換句話說它是物質。比如石墨和金剛石,它們是物質,而且是同一種元素,但是結構不同,所以它們是同素異形體。
而同位素是中子數不同但質子數相同的同種元素的不同原子,它只是原子,比如,沒有中子的1H和有一個中子的2H 或者 2C1和4C1,它們只是原子而已,它們不是單獨的物質所以它們是同位素。
H2和H3:H3是3個氫原子,H2是兩個氫原子,它們是不同的物質,它們是同素異形體。
 從左至右:石墨,C60,金剛石
從左至右:石墨,C60,金剛石
 C60的結構
C60的結構
