基本介紹
簡史
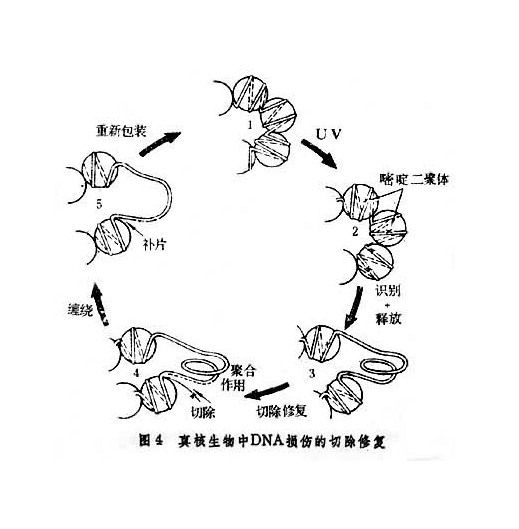 DNA損傷修復
DNA損傷修復損傷類型
檢測方法
放射法
液體計數法
超速離心法
病毒復活法
染色互換法
修複方式
光復活
切除修復
重組修復
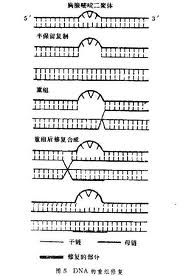

 DNA損傷修復
DNA損傷修復
DNA損傷修復(repair of DNA damage)在多種酶的作用下,生物細胞內的DNA分子受到損傷以後恢復結構的現象。 DNA損傷修復的研究有助於了解基因突變的機制,衰老和癌變的...
DNA損傷是複製過程中發生的DNA核苷酸序列永久性改變,並導致遺傳特徵改變的現象。情況分為:substitutation (替換)deletion (刪除)insertion (插入)exon skipping (外顯...
DNA修復(DNA repairing)是細胞對DNA受損傷後的一種反應,這種反應可能使DNA結構恢復原樣,重新能執行它原來的功能;但有時並非能完全消除DNA的損傷,只是使細胞能夠耐受...
DNA損傷應答(DNA-damage response)是生物的基本生理機制之一,這一機制旨在保護生物的基因組。2015年9月8日,DNA損傷應答發現者因此獲得2015年拉斯克獎基礎醫學研究獎...
DNA損傷修復(repair of DNA damage)是在細胞中多種酶的共同作用下,使DNA受到損傷的結構大部分得以恢復,降低了突變率,保持了DNA分子的相對穩定性。DNA損傷修復學...
切除修復 (excission repair):對多種DNA損傷包括鹼基脫落形成的無鹼基點、嘧啶二聚體、鹼基烷基化、單鏈斷裂等都能起修復作用。此系統是在幾種酶的協同作用下,...
損傷造成機體部分細胞和組織喪失後,機體對所形成缺損進行修補恢復的過程,稱為修復。由各種酶(如DNA聚合酶、連線酶等)協同作用,修復DNA突變損傷,以保持DNA分子中信息...
中文名稱:SOS修復英文名稱:sos repair “SOS”是國際上通用的緊急呼救信號。SOS修復是指DNA受到嚴重損傷、細胞處於危急狀態時所誘導的一種DNA修復方式,修復結果只是...
損傷造成機體部分細胞和組織喪失後,機體對所形成缺損進行修補恢復的過程,稱為修復。由各種酶(如DNA聚合酶、連線酶等)協同作用,修復DNA突變損傷,以保持DNA分子中信息...
重組修復(recombination repairing):複製含有嘧啶二聚體或其它結構損傷的DNA,但當複製到損傷的部位時,子代DNA鏈中與損傷部位相對應的部位出現缺口,新合成的子鏈比未...
基因修復技術是指DNA修復(DNArepairing),是細胞對DNA受損傷後的一種反應,可使DNA結構恢復原樣,重新能執行它原來的功能。基因修補技術可修補單一突變基因,治療某些因...
跨損傷DNA合成,這是一種利用損傷核苷酸為摸板,通過DNA聚合酶使鹼基摻入到複製終止處進行DNA合成,從而延緩DNA的修復。...
DNA突變是指個別dNMP(脫氧單磷酸核苷)殘基以至片段DNA在結構、複製或表型功能的異常變化,也稱為DNA損傷。...
損傷造成機體部分細胞和組織喪失後,機體對所形成缺損進行修補恢復的過程,稱為修復。由各種酶(如DNA聚合酶、連線酶等)協同作用,修復DNA突變損傷,以保持DNA分子中信息...
通過式修復是SOS修復的一種。一般認為SOS修復可通過兩種機制對DNA損傷進行修復,即 通過式修復 和 切除式修復。這兩種修復可造成損傷位點產生突變,是傾向差錯式修復...
多種因子綜合損傷是在多種酶的作用下,生物細胞內的DNA分子受到損傷以後恢復結構的現象。 DNA損傷修復的研究有助於了解基因突變機制,衰老和癌變的原因,還可套用於...
是指照射過紫外線的細胞的DNA,不需要可見光的反應而修復,使細胞的增殖能力恢復的過程。與此相對應的需要可見光的DNA的修復稱為光修復。暗修復的機制有去除修復和...
生物細胞為了保持遺傳物質DNA的穩定.具有種種機構.DNA修復酶就是其中之一。...... 將受損傷的DNA修復,修復成與原來同樣正常的DNA。修復酶的作用雖因DNA損傷的種類...
環境污染與DNA修復,是探討環境污染物對 DNA(脫氧核糖核酸)的損傷和對DNA修復功能的影響,DNA是一種生物高分子聚合物。它主要存在於動物和植物細胞核的染色體內,也...
SOS修復系統是細胞DNA受到損傷或複製系統受到抑制的緊急情況下,細胞為求生存而產生的一種應急措施。包括誘導DNA損傷修復、誘變效應、細胞分裂的抑制以及溶原性細菌釋放...
DNA修復機制之一。認為是經過下列四步酶促反應完成的。...... (3)以未受損傷一方的DNA單鏈作模版,修復填補損傷鏈中切除產生的缺口;(4)由連線酶把修復好的DNA...
直接修復(direct repair): 是通過一種可連續掃描DNA,識別出損傷部位的蛋白質將損傷部位直接修復的方法。該修復方法不用切斷DNA或切除鹼基。 ...
