大皰性類天皰瘡 疾病簡介 大皰性類天皰瘡(Bullous pemphigoid,BP)是最常見的
皮膚 自身免疫性表皮下大皰病。好發於老年人,以泛發的瘙癢性大皰疹為特點,黏膜受累比較少見,可伴顯著的病態。然而,BP的表現極為多樣,開始容易被誤診,尤其在疾病的早期或不典型病例,患者可以完全沒有大皰。對這些病例,診斷BP的前提首先需要高度懷疑,並立即採取適當的治療措施。BP是器官特異性自身免疫病的範例。病人自身抗體的靶抗原是
皮膚 和黏膜中連線粘附複合物-半橋粒的兩種成分。
疾病歷史 幾個世紀以來,
大皰性皮膚病 的描述使用過許多術語。從18世紀開始,“天皰瘡”這個詞用於描述任何類型的大皰性皮疹。直到1953年,Lever基於其特殊的臨床和病理學特點,認為BP是一個不同於天皰瘡的疾病。
十年後,Jordon,Bertner[4]和同事們證明了BP患者有針對
皮膚 基底膜帶(basement membrane zone, BMZ)的自身抗體,該抗體與組織結合,並存在在循環中。這一發現提示由於自身抗體針對了促進真皮與表皮粘附的
皮膚 結構成分,進而導致表皮下粘附不良。幫助我們理解BP的其他里程碑包括靶蛋白的免疫組化特點、這些蛋白的基因克隆和疾病動物模型的建立。
流行病學 BP是一個典型的老年病,常在60歲後發病。年發病率估計至少在每百萬人群6-7個新病例(60歲後發病快速增長);然而,這些數字需要進一步精化(例如,利用年齡配對的個體作為分母)。90歲以上患病的相對風險是60歲或更年輕人的300倍,男性明顯高於女性。本病也發生在兒童,但較罕見。某些特定HLA II等位基因在BP患者中比普通人更普遍。在白種人,BP患者與等位基因DQB1*0301有顯著的相關性,在日本人,最近發現BP患者中等位基因DRB1*04, DRB1*1101, DQB1*0302有較高的頻率。本病無地域傾向性。
發病機制 BP是一種免疫介導的疾病, 發生的
體液免疫 和細胞免疫直接針對兩個抗原:BP抗原180 (BP180, BPAG2 或XVII型膠原)和BP抗原230( BP230或BPAG1)[表1]。BP180是一種胞外區為膠原的跨膜蛋白,BP230是屬於斑蛋白家族的一種胞漿蛋白。這兩種抗原都是半橋粒的成分。半橋粒是在復層上皮或其它複合上皮,如
皮膚 或黏膜中能促進表皮與間質粘附的複合物。
體外研究和動物模型的體內研究提供了大量的證據,證明BP自身抗體的致病作用。此外,妊娠期
類天皰瘡 患者,其母體內的BP180自身抗體通過胎盤轉移到新生兒體內,可導致新生兒出現暫時性的大皰性皮損。最後,BP與特殊的主要組織相容性複合體(major histocompatibility complex,MHC)II類單體的相關性及對
免疫抑制 治療的反應間接支持了BP的自身免疫病因學。
體液應答和細胞應答 幾乎所有BP患者的循環中都有能與BP180結合的自身抗體。更特異地說,位於BP180胞外區、接近跨膜區的非膠原性NC16A域,是與抗體結合的免疫顯性決定蔟域。然而,
抗原 位點也可在BP180胞外和胞內的其他區域,將近70%患者的血清可以識別BP180。BP患者也對胞內的BP230有明顯的自體反應性。與BP230反應的自身抗體主要與BP230的C末端結合。遍及BP180和BP230的許多
抗原 位點的存在可能是由於“
表位擴展 ”現象(見下文)。這種現象也可以解釋患者血清中很少含有針對BMZ其他成分的自身抗體。
圖1 大皰性類天皰瘡大皰形成的可能機制 BP患者針對BP180和BP230發生的自身反應性T細胞反應,可能對刺激B細胞產生致病性的自身抗體是至關重要的。針對BP180的自身反應性T細胞應答受特定的HLA II類等位基因限制(如 HLA-DQB1*0301)),這個等位基因在BP患者中普遍存在。這些T淋巴細胞,主要的相關表位可能位於NC16A域,具有CD4+的表型,產生Th1細胞因子(如干擾素γ)和Th2細胞因子(如白介素[interleukin,IL]-4, IL-5和IL-13;見第5章)。Th2細胞因子與本病的病生理學有顯著關係,它們在
皮損 組織和病人血清中占主要地位,Th2細胞因子還調控IgG4的分泌,後者是抗BP180自身抗體的一個主要亞型。
在
自身抗體 與它們的靶抗原結合後,發生了一系列級聯反應,導致表皮下
水皰 形成。這些反應包括補體的活化、
炎症細胞 (主要為嗜中性細胞和嗜酸性粒細胞)的募集,各種趨化因子和蛋白酶的釋放,如基質金屬蛋白酶9(matrix metalloproteinase-9,MMP-9)和中性粒細胞彈性蛋白酶。這些蛋白酶不僅降解BP180,而且水解各種細胞外基質蛋白。通過釋放蛋白酶和前炎性介質如IL-5和eotaxin,表明浸潤的嗜酸性粒細胞明顯參與了組織損傷。最後,抗BP180的自身抗體還可能通過直接刺激角質形成細胞表達各種細胞因子(如IL-6和IL-8),從而增強了
炎症反應 (圖1)。
自身免疫介導的表皮下大皰病的主要自身抗原*
疾病
靶抗原
分子量(kDa)
形態學結構
大皰性類天皰瘡(BP)
BP180/BPAG2/XVII膠原BP230/BPAG1
180
半橋粒斑/瞄絲
妊娠類天皰瘡
BP180/BPAG2/XVII膠原BP230/BPAG1
180
半橋粒斑/瞄絲
瘢痕性類天皰瘡
BP180/BPAG2/XVII膠原BP230/BPAG1†
180
半橋粒斑/瞄絲
線狀IgA大皰性皮病(LABD)
LAD抗原¶
97/120
瞄絲
獲得性大皰表皮鬆解症
VII型膠原
290/145
瞄絲
大皰性系統性紅斑狼瘡
VII型膠原†
290/145
瞄絲
*沒有完全列出。在這些疾病的病程中,可能檢測到針對其他抗原的自身抗體,這些抗體的重要性還有待確立。在某些病例,可能發生了“分子內表位擴展”現象。
表1 自身免疫介導表皮下大皰病的主要自身抗原
動物模型 動物模型提供了強有力的證據,證明抗BP180的自身抗體是致病性的。將鼠源化的人BP180免疫顯性決定簇(NC16A域)免疫兔,產生的兔抗體被動轉移到新生鼠,能誘導產生具有BP所有主要特點的大皰病 。相反,抗BP230自身抗體僅在兔受損表皮引起
炎症反應 ;然而,最近的發現提示抗BP230抗體能夠在鼠模型中引起炎症反應和表皮下大皰。總之,這些研究使我們推測抗BP180胞外域的抗體在大皰發生的病生理中是至關重要的,而抗BP230抗體的產生則是組織損傷的一個繼發事件。最後,狗、小型豬,馬和貓能自發的發生BP, 其特點與人類中觀察到的相同。
臨床特點 非大皰期
BP的
皮膚 表現極具多形性(圖2-5).前驅期,即疾病的非大皰期,症狀和體徵常無特異性,可僅表現為輕微或嚴重、頑固的瘙癢,或伴表皮剝脫、
濕疹樣 、丘疹和/或蕁麻疹樣的皮損,可持續數周或數月。這些非特異的
皮膚 表現可作為本病的唯一症狀。
大皰性類天皰瘡 大皰期
BP大皰期的特徵表現為:在正常或紅斑
皮膚 上的
水皰 和大皰,伴有蕁麻疹樣和浸潤性的
丘疹 和斑塊,
皮損 偶可呈環形或圖形(見圖2和3)大皰緊張,直徑約1-4cm,皰液澄清,可持續數日。破潰後成為糜爛和結痂。有時,皰液可呈血色。
皮損 常對稱分布,好發於肢體屈側和軀幹下部,包括腹部。在間擦部位可見增殖性的斑塊。
皮損 消退後遺留色素改變,包括色素沉著或色素減退, 偶見
粟丘疹 。10%-30%病人口腔黏膜受累。眼、鼻、咽、食管和
肛門 生殖器區域的黏膜更少受累。約50%患者外周血嗜酸性粒細胞增多。
臨床變異型 BP的許多臨床變異型已為各種各樣的術語所描述(見圖4和圖5)。偶而, 皮損可以是局限性的,如在脛前區(脛前
類天皰瘡 )、孔口周圍、在照射輻射區內、或限於癱瘓的肢體。僅掌跖受累,與
出汗不良 型濕疹相似(出汗不良型
類天皰瘡 )。 皮損為成簇小的張力性大皰,與
皰疹樣皮炎 相似(小皰型
類天皰瘡 )。皮損可類似結節性痒疹(結節型
類天皰瘡 )或表現為紅皮病(紅皮病型
類天皰瘡 ),還有,類天皰瘡扁平苔蘚(lichen planus pemphigoides)。
妊娠類天皰瘡(曾稱
妊娠皰疹 )是BP的一個特殊類型,發生在
妊娠期 (見妊娠類天皰瘡)。常在
孕中期 或晚期發生,罕見在產後發生。早期為瘙癢的丘疹或蕁麻疹樣損害,繼而發生
水皰 和大皰。皮疹首發於臍周和腹部,可泛發。
最後,兒童BP的臨床特點(兒童期BP)與成人相似(見圖5)。據報導可顯著地累及手掌、足跖和黏膜。此外,還有一種特殊的類型,累及外陰和肛周(兒童外陰
類天皰瘡 )。
伴發的疾病 大多數情況下,BP患者伴發內臟惡性腫瘤可能與患者的高齡有關。儘管在三個
病例對照研究 中,某些癌症(如消化道、膀胱和肺)和淋巴細胞增生性疾病的發生率高些,但BP患者惡性腫瘤高風險的趨勢似乎是被邊緣化了。偶有個別病例,皰病顯然與
惡性腫瘤 同時發生。因此,若有系統表現和非典型表現如BP發生在
中年人 ,則建議作癌症的篩查。對普通人群中的BP病人,應推薦作與年齡相關的癌症篩查試驗。
有罕見的病例報導,BP患者伴發炎症性腸病和其他自身免疫性疾病如類風濕關節炎、橋本甲狀腺炎,皮肌炎、
紅斑狼瘡 以及自身免疫性血小板減少症。這些相關性其實並非偶然,它反映了一種發生
自身免疫性疾病 的遺傳易感性。然而,
病例對照研究 並沒有發現任何證據表明BP患者自身免疫性疾病的高風險。
創傷、燒傷、放療或UV照射(包括PUVA)可以是一些BP患者的發病誘因。BP也可與某些皮膚病伴發,如銀屑病、扁平苔蘚。大皰可局限在銀屑病的斑塊上,推測真皮表皮交界處的慢性炎症導致了
抗原 暴露於自身反應性T細胞,引起繼發性的
免疫反應 (
表位擴展 現象)。
最後,BP患者還可伴發神經系統疾病,如多發性硬化症、Shy-Drager 綜合徵或肌萎縮側索硬化症。這些相關性的意義還不清楚。然而,值得注意的是在
中樞 和外周神經系統有BP230神經元變體的表達。
藥物引起的大皰性類天皰瘡 有些病人,BP可由於系統用藥引起。涉及的藥物很多,包括利尿藥(如呋塞米、布美他尼)、鎮痛藥(如非那西丁)、D-青黴胺、抗生素(如阿莫西林、環丙沙星)、碘化鉀、金和卡托普利。以一些藥物(如呋塞米)作藥物激發試驗, 已觀察到BP皮損的複製,但是,在診斷BP時,同時能記錄下歸咎藥物的很少。有一個
病例對照研究 ,比較了BP發病前長期使用的藥物,發現BP病人比對照組使用利尿劑和精神安定藥更為頻繁。有的利尿劑是醛固酮類拮抗劑,可能會增加BP發生的風險。因此,對所有BP病人必須詳細詢問用藥史,以排除藥物誘發的可能,因為及時停藥可使疾病很快好轉。
藥物引起BP的機制有待闡明。在有遺傳易感性的人,藥物可能通過改變
免疫反應 或改變表皮基底膜的
抗原性 而誘發疾病。
診斷和鑑別診斷 BP的診斷依靠典型的臨床表現、組織學特點,最重要的是直接和間接免疫螢光(immunofluorescence,IF)顯微鏡的
陽性 所見。IF顯微鏡所見能為大多數皰病病例的正確分類提供充分和必要的線索。然而,特別是間接免疫螢光陰性的病例,還需作
免疫化學 研究(如下),以證明自身免疫反應的靶抗原是BP180和/或BP230。在疾病早期或非典型患者,尚無充分發展的大皰性皮損,診斷就得依靠直接免疫螢光的
陽性 結果和靶向
自身抗原 的特徵。(見表1)
光鏡和電鏡
在BP的非大皰期或不典型患者,光鏡僅能看到表皮下裂隙和嗜酸性粒細胞性海綿水腫,很少能提供特異的信息。在早期水皰的活檢標本,典型所見為表皮下皰、真皮上層嗜酸性粒細胞和單一核細胞的炎症浸潤。水皰內有纖維蛋白網和數量不等的
炎症細胞 浸潤(圖6),電鏡顯示形成的表皮下皰在透明板水平。
圖6 大皰性類天皰瘡的病理 表皮下皰,真皮和皰腔內由嗜中性粒細胞和嗜酸性粒細胞組成的炎性浸潤。插入的圖片(高倍放大)顯示多數嗜酸性粒細胞的浸潤。
A 病損周圍
皮膚 的直接免疫螢光顯微鏡檢查可見沿表皮基底膜帶(箭頭)有線狀連續的IgG沉積。在
瘢痕性類天皰瘡 和獲得性大皰性表皮鬆解症可見到相同的標記模式。B 利用鹽裂的正常人
皮膚 為底物作間接免疫螢光顯微鏡檢查。BP病人血清中的IgG自身抗體能與裂隙(箭頭)的表皮側(頂)結合。人為分離的水平由星號所示。在一組
瘢痕性類天皰瘡 病人中可見到相同的標記模式。細胞核染為藍色。
圖7 直接和間接免疫螢光顯微鏡所見 免疫螢光顯微鏡
在幾乎所有的病人中,皮損周圍未受累
皮膚 的直接免疫螢光顯微鏡檢查,可見特徵性沿表皮基底膜(BMZ)連續、細線狀IgG和/或C3(以及比較少見的其他Ig類別)的沉積(圖7A),IgG4和IgG1是主要的IgG亞類。仔細分析BMZ的線狀螢光模式(N鋸齒狀與U鋸齒狀模式),以及用1M NaCl處理過的病損周圍
皮膚 (即鹽裂皮膚)作 IF,有助於鑑別BP與其他自身免疫性大皰病。BP患者的免疫沉積物在鹽裂
皮膚 的表皮側(頂部)或在同時在表皮側和真皮側。儘管不能作為常規,但計算機輔助螢光重疊抗原圖(fluorescence overlay antigen mapping,FOAM)技術可以更精確地確定免疫反應物沉積的位置。
在60%—80%病人的循環中可檢測到抗基底膜帶抗體IgG, 以及少見的IgA 和IgE 類抗體。這些自身抗體常結合於鹽裂正常人
皮膚 的表皮側,及少見的表皮和真皮兩側(圖7B)。對間接免疫螢光檢查,底物要選擇鹽裂的正常人
皮膚 ,而不是完整的正常人皮膚或猴舌。最後,如果有條件,以
皮膚 作底物,或以缺乏諸如BP180或VII型膠原特異性基底膜蛋白的角質形成細胞係為底物,測試循環中的自身抗體,可以精確地確定它們的反應模式。
免疫電鏡
免疫電子顯微鏡並不能廣泛使用,用金標記法已證明體內IgG抗體沉積主要在半橋粒下基底細胞膜的外側,與BP180胞外域的定位是一致的。通過間接免疫電鏡,發現針對BP230和BP180的自身抗體分別結合在半橋粒斑(圖8)和半橋粒下透明板水平。
在角質形成細胞提取物的免疫印跡和免疫沉澱研究中,60%–100%病人血清中有能與180kDa 和/或230kDa分子結合的自身抗體,它們分別對應BP180和BP230(見表1; 圖9A,B)。病人血清也常有特異的IgA和 IgE自身抗體。在原核系統或真核系統(如桿狀病毒)表達的BP180和 BP230重組蛋白,正逐漸套用於檢測自身抗體(圖9C)。用包被了BP
抗原 特定域(如BP180 的NC16A域和BP180或BP230的C末端)的重組蛋白行酶聯免疫吸附試驗(Enzyme-linked immunosorbent assays,ELISAs),已發現是檢測自身抗體相當特異(>90%)的方法。在未選擇的BP患者中進行這個試驗,其總體敏感性可能比得上以鹽裂
皮膚 為底物的間接IF。與免疫印跡相比,ELISA所測的
抗原 是在天然條件下,因此與構象抗原的結合活性沒有丟失。ELISA檢測目前有商品化的產品,能快速鑑定患者血清的反應特性。
圖8 用免疫金標記的間接免疫電鏡觀察 根據特徵性的免疫病理所見和臨床表現,BP可與天皰瘡、副腫瘤性天皰瘡及
皰疹樣皮炎 相鑑別。最近的研究發現,表皮下皰患者,在表皮基底膜有IgG或C3的線狀沉積,具備以下四個臨床指標的,強烈提示BP的診斷:
沒有黏膜受累
沒有頭頸部受累
年齡大於70歲。
然而,將BP與以下自身免疫性的表皮下皰病鑑別有時具有挑戰性(見表1)
獲得性大皰性表皮鬆解症(Epidermolysis bullosa acquisita,EBA)臨床表現多樣(見下)。雖然EBA經典的“非炎症型”有其臨床特點,但“炎症型”與BP的臨床表現極為相似。與BP患者相同,黏膜也可受累。
線狀IgA大皰性皮病(Linear IgA bullous dermatosis,LABD)不是一個單一的病,它代表了一組表皮下大皰病。LABD皮疹在成人呈多形性,在兒童,除有生殖器和口周的皮損外,還常有環形和多環形的皮損。後者皮損也常出現在兒童BP患者。
瘢痕性類天皰瘡 (cicatricial pemphigoid,CP)是一種多相性的疾病,共同點是黏膜受累為主,病程慢性,有形成瘢痕的傾向(見下)。
皮膚 損害僅見於25%—30%的CP患者,常累及頭部及軀幹上部。若患者同時有口腔和
皮膚 的損害,CP與BP的區分較難。受累黏膜部位明顯的瘢痕和有限的
皮膚 損害支持CP的診斷,有時鑑別要依靠免疫螢光的結果(見表1)。
圖9 血清樣品與BP180和BP230的反應性 還有一小組病人,特點與BP相似,但循環中的自身抗體是針對表皮基底膜帶的特定抗原,包括大約200kDa的蛋白(抗p200
類天皰瘡 )和105 kDa的蛋白(抗p105類天皰瘡),他們的歸類還需作進一步的研究。
初始(Incipiens)
類天皰瘡 .老年人,全身瘙癢,伴或不伴皮損,在循環中存在抗表皮基底膜帶的自身抗體,且是針對BP180和/或BP230的,但常規IF顯微鏡檢查為陰性。這是一個很困擾的問題。這些老年人中,有一部分最初的直接IF為陰性,最終發展為BP,可以認為患有初始
類天皰瘡 。對這些患 者作早期治療,可能會影響本病的臨床過程。
疾病預後 BP病程慢性,可以自發的加重或緩解。由於頑固的瘙癢、大皰、糜爛或膿皰瘡樣皮損,本病患者常有明顯的病態,嚴重的影響生活質量。儘管大多數病人在治療後可得到臨床緩解,但在老年患者中還是有相當的死亡率。發病第一年的死亡率在10%-40%間。年齡和Karnofsky評分<40(範圍0-100)者顯著影響預後。患者同時患的其他疾病和治療的方式(
皮質激素 和/或免疫抑制劑的系統套用)也可能影響整個病情和死亡率。
基於ELISA試驗,最近證明患者血清中抗BP180的IgG和IgE自身抗體水平與疾病的嚴重程度有相關性。此外,與BP180 NC16A域和C末端均有反應性的IgG抗體與一種黏膜易受累BP的特殊臨床表型有關。然而,這些ELISA結果用於指導治療的實際價值尚需進一步驗證。
疾病治療 BP的治療基本上是基於
臨床經驗 ,而非對照研究(表2和3)。
最普遍使用的是系統用皮質類固醇。對
皮損 泛發的病人,口服潑尼松0.5–1mg/kg/日,通常可以在1-2周內控制病情,然後在6-9個月內逐漸減量。然而,老年人使用皮質類固醇常伴發顯著的不良反應,如高血糖、感染、
骨質疏鬆 、充血性心力衰竭等。最近,一個大樣本的對照研究強調了局部套用強效皮質類固醇不僅對限局性或輕型BP有效,並且似乎在泛發性BP患者中與口服皮質類固醇具有相同的效力,最重要的是其系統的不良反應更少。偶爾,為了迅速控制病情,必要時可採用甲
潑尼松龍 衝擊療法 。
免疫抑制劑的套用還有爭議。一些臨床醫生在單獨使用皮質類固醇不能控制病情、或患者有使用皮質類固醇的禁忌症時,傾向於將它們作為二線治療藥物。最常用的是硫唑嘌呤、甲氨碟呤、苯丁酸氮芥(0.1mg/kg/日,通常4–6mg/日),環磷醯胺(1–3mg/kg/日),環孢素(1–5mg/kg/日)及麥考酚酸莫酯(1.5–3.0g/日)。為增加有效性,減少毒副作用,硫唑嘌呤的劑量(0.5–2.5mg/kg/日)應當根據硫代嘌呤甲基轉移酶(thiopurine methyltransferase,TPMT)的水平作相應調整。應根據藥物的不良反應、病人的整體狀況和醫生的經驗選擇合適的免疫抑制劑。
聯合使用煙醯胺(500–2000mg/日)和米諾黴素或四環素,在小部分病人中取得了一些成功。有系統使用皮質類固醇有禁忌症的患者可作為治療的選擇。若無6-磷酸葡萄糖脫氫酶(glucose-6-phosphate dehydrogenase)的缺乏,也可以套用氨苯風,特別是在有黏膜受累時。局部外用免疫調節劑,如他克莫斯的效果還需驗證。對難治的病歷,IVIG、
血漿置換 或抗CD20的免疫治療(利妥昔單抗)也可試用。
總之,對所有BP病人,重要的是減少
皮膚 損害和系統治療的併發症,包括預防骨質疏鬆、保護胃,評估心血管的功能,減少感染的風險。
大皰性類天皰瘡患者治療的對照試驗調查
作者(年)
設計
干預
病人數目
反應
備註
Roujeau et al. (1984)
隨機化
組1:潑尼松龍 (0.3 mg/kg/日)
41
組2控制疾病所需的全部和每日皮質類固醇用量較組1低
低潑尼松龍劑量
Morel et al. (1984)
隨機化
組1:潑尼松 (0.75 mg/kg/日)
42
在第51天,組1緩解率(33%)與組2(55%)無顯著差異
組2治療反應更好些。
Guillot et al.(1986)
非隨機
組1:單用潑尼松龍
21
在第6個月,組2的復發率和總激素用量低
組2有嚴重不良反應的風險
Dreno et al. (1993)
隨機法
組1:甲強龍(1–1.5 mg/kg/日)
57
在第10天,除組1瘙癢症狀減輕外二組無差異。
僅分析了早期反應
Guillaume et al. (1993)
隨機化
組1:單用潑尼松龍(1 mg/kg/日)
98
在第6個月,緩解率組1(42%)、組2(39%)和組3(29%),無明顯差異
組2有更多併發症。沒有根據TPMT水平調整硫唑嘌呤的用量
Fivenson et al. (1994)
隨機化
組1:煙醯胺(1.5g/日)合併四環素(2g/日)
18
在第1個月,療效無差別,但組1不良反應少
研究病人的數目少
Joly et al. (2002)
隨機法
組1:局部外用丙酸倍氯他索
341
在第3周,組1的控制率更好
在第1年,局部治療顯著降低了死亡率和併發症
表2 大皰性類天皰瘡患者治療的對照試驗匯總
大皰性類天皰瘡的治療階梯
輕度和/或限局的疾病
泛發/持續的皮膚病
注意:在任何病人中都應當考慮局部外用超強效皮質類固醇,可以結合系統的治療
*已驗證的
表3大皰性類天皰瘡的治療階梯 循證醫學支持的要點
(1)前瞻性對照試驗(2)回顧性研究和大樣本系列(3)小樣本系列和個案報導
瘢痕性類天皰瘡 疾病簡介 瘢痕性類天皰瘡(Cicatricial pemphigoid,CP)是一種罕見的自身免疫性表皮下皰病,特點以黏膜受累為主,慢性病程,受累黏膜有發展為瘢痕的傾向。本病不應看作是一個臨床單一的疾病,而應當看作是不同類型易累及黏膜表面皰病所共有的一個疾病表型。大多數病人在
皮膚 和黏膜沿表皮基底膜帶有免疫球蛋白和/或補體成分的線狀沉積。以間接免疫螢光檢查,約20%-30%病人的血清中可檢測到循環抗基底膜的自身抗體,通常滴度較低。CP是一種慢性進展性疾病,可導致嚴重的局部併發症。例如,當萎縮性瘢痕和纖維化累及結膜,本病將最終導致失明。
疾病歷史 1794年,Wichmann首先描述了一種伴發眼受累的慢性皰病。1949年,Civatte根據本病特殊的組織病理學所見,將本病從天皰瘡中區分出來。Lever後來建議命名為“良性黏膜
類天皰瘡 ”,考慮到本病可能的破壞性併發症,這個命名並不恰當。在過去的幾十年里,“黏膜性
類天皰瘡 ”在文獻中出現的頻率逐漸增加。隨著免疫螢光顯微鏡的出現,證明了免疫反應物沉積在表皮基底膜帶,提出了CP自身免疫源性的可能性。
流行病學 CP是一種罕見的疾病。在西歐年發生率大約是百萬分之一。本病常發生在老年人,確診時的平均年齡為60-80歲。但是,兒童也有幾例報導。女性發病率高於男性,女性:男性約為1.5-2。尚沒有報告有地域或種族上的傾向性,研究顯示本病與特異的免疫遺傳
單體型 ,主要是HLA-DOw7(HLA--DQB1*0301亞型)相關。總體上看,本病並不與腫瘤伴發。但在一個針對層粘連蛋白5自身抗體的特殊亞型,即抗表皮整聯配體蛋白CP, 有報導發生
癌症 的風險增加。
發病機制 CP的黏膜
皮膚 損害認為是由於
自身抗體 與黏膜和皮膚復層上皮的
基底膜 帶結合所致。這些自身抗體識別半橋粒粘附複合物特殊的結構成分。特殊的是,它們主要與位於胞外區、在瞄絲帶(anchoring filament zone)內的
抗原 位點結合,而不是在半橋粒斑塊內的抗原結合。然而,與CP相關各種自身抗體的致病性(見表1)還不明確,其他機制也可能參與其中。例如,在小部分黏膜
類天皰瘡 病人中,可測出針對NC16A域的特異性T細胞,並有快速效應物功能。在眼CP病人,
結膜 成纖維細胞高表達能結合膠原的熱休克蛋白47(HSP47)和TGF-b1,可導致結膜瘢痕的形成。根據病人自身抗體的反應性,可將CP分為四個不同的亞群。
第一亞群:自身抗體針對層粘連蛋白5(層粘連蛋白332),即抗層粘連蛋白5 CP(也稱為抗表皮整連配體蛋白CP) 。臨床上,抗層粘連蛋白5 CP與其他類型的CP不能區分。病人血清中IgG自身抗體結合在鹽裂
皮膚 的真皮側,與層粘連蛋白5G域的α3鏈反應,少數與β3和/或γ2鏈反應(α3β3γ2)。偶爾,由於自身抗體的交叉反應,可與層粘連蛋白6(層粘連蛋白311;α3β1γ1鏈的異三聚體)的α3鏈結合。體內外的研究提供了令人信服的證據,證明抗層粘連蛋白5的自身抗體是有致病性的。超微結構上定位於瞄絲區域的層粘連蛋白5,是整合素α6β4和整合素α3β1的主要配體。
第二亞群:病人僅在眼部發病,或病變主要為在眼部。在這一型眼CP患者,已證明存在能結合跨膜半橋粒成分-α6β4整合素β4亞單位的自身抗體。
第三亞群:皮損累及黏膜和
皮膚 ,在組織中和循環中存在能與BP相同靶抗原,特別是BP180反應的IgG抗體(見上)。因此,應當歸類為具有抗BP抗原的黏膜
類天皰瘡 。值得注意的是,BP180的抗原區可能主要位於其遠端的C末端部分,超微結構上,已延伸到了緻密板區域。
第四亞群:更具異形性,病人沒有
皮膚 損害,黏膜損害多變。尚不清楚這些病人的自身抗體針對表皮基底膜蛋白的反應是否會導致損傷的發生。
臨床特點 黏膜
“CP表型”病人兩個最常受累的部位是口腔黏膜和眼結合膜。除了這兩個部位外,本病可始於、並累及任何黏膜部位,包括外生殖器黏膜、
肛門 、上呼吸消化道黏膜和/或食道。大約85%病人有口腔黏膜受累(通常無
皮膚 損害)。口腔可能是活動病變的唯一部位。損害通常累及齒齦、頰黏膜和上顎;牙槽嵴、舌和唇則不常受累。
瘢痕性類天皰瘡 牙齦緣的紅斑和糜爛(脫屑性或糜爛性牙齦炎)
結膜受累是常見的,可以導致失明。結膜常是CP的唯一受累部位。多數病例開始為單側,以後累及雙眼。最初為非特異的慢性結膜炎,自覺燒灼感、酸痛感、異物感,有黏液的分泌,病程中病情加重和緩解,最終進展為上皮下結膜纖維化。
在瞼結合膜罕見水皰或大皰。慢性炎症可導致進行性的瘢痕形成,包括下穹隆變淺和
瞼球粘連 。(如在
眼球 和瞼結膜間形成的纖維束;圖12)。結膜的纖維化導致
倒睫 和
瞼內翻 。如果疾病沒有得到控制,
倒睫 、
瞼內翻 和乾燥症(由於淚道的瘢痕形成)可導致淺表
角膜 的創傷、角膜的新生血管化,繼而發生角膜的潰瘍,並致失明。
鼻咽部黏膜的受累常慢性,並且伴發上呼吸道廣泛的損害,最終形成潰瘍結痂、
鼻衄 、相鄰黏膜表面的纖維粘附和氣道阻塞。咽部黏膜的受累表現為咽後壁和側壁的潰瘍及吞咽困難。喉黏膜的受累可能造成嚴重後果,可出現
聲音嘶啞 、失語,甚至發生危及生命、需作氣管插管的氣道阻塞。
由於食道黏膜的糜爛可導致了吞咽困難,但病變也可以完全無症狀。一些病人慢性的炎症導致
食道狹窄 ,繼而發生
吞咽困難 和體重下降。
生殖器和肛門黏膜的受累較為罕見,早期皮損為水皰和慢性糜爛。女性病人進展的病變可引起萎縮性瘢痕和陰道口狹窄。男性病人的
包皮 和
龜頭 間形成粘連。肛門受累也能造成瘢痕形成,嚴重的病例可形成狹窄。
25%–30% CP患者有
皮膚 損害。最常累及頭皮、面部、頸部和軀幹上部。
皮損 常表現為紅斑塊,這些部位易反覆發生
水皰 和糜爛,繼而形成萎縮性的瘢痕。(圖13)。皮損數目通常有限。然而,也有類似BP的泛發皮損及愈後不留瘢痕的病例報導。
診斷和鑑別診斷 光鏡和電鏡
多數CP病人的組織病理學特點和BP類似。完整水皰的標本可見水皰在表皮下或上皮下(沒有棘層松解),主要由數量不等單一核細胞的混合類型細胞浸潤。陳舊的皮損多在真皮上部有纖維化。口腔損害,
炎症細胞 浸潤中常有漿細胞。受累結膜上皮則常有包括單核細胞和肥大細胞的
炎症細胞 浸潤,在黏膜下可見
肉芽組織 。
對新發
水皰 的電鏡檢查發現表皮真皮的裂隙發生在透明板內,這與在BP所見的相同。在進展期有瘢痕的結膜損害中,緻密板呈不連續性、中心增厚或重疊。
免疫螢光顯微鏡
通過直接免疫螢光顯微鏡觀察,80%–95%的CP病人體內結合有針對黏膜和/或
皮膚 基底膜帶的自身抗體。大多數病人病損周圍的活檢標本顯示沿表皮基底膜帶連續、細線狀的IgG和/或C3沉積(見圖7)。值得注意的是,黏膜直接免疫螢光檢查陽性率(50%–90%)比
皮膚 標本(20%–50%)要高。沉積的IgG主要屬於IgG4和IgG1亞類。IgA和IgM的線狀沉積較少見。鹽裂
皮膚 的直接免疫螢光顯微鏡檢查在CP中診斷價值較低。經常是同時有表皮側和真皮側螢光沉積的混合模式,偶可見到僅有表皮側或僅有真皮側的螢光。間接免疫螢光檢查,約20%-30%CP病人的血清中可以檢測到抗基底膜帶抗體。抗體主要是IgG,但IgA及更少見的IgM自身抗體也可檢測到。抗體的滴度通常很低。最近的研究發現抗體滴度較高,且同時存在循環IgG和IgA抗基底膜帶抗體CP患者的病情更嚴重。以正常口腔黏膜或生殖道黏膜及結膜為底物,或用鹽裂
皮膚 為底物,可增加間接免疫螢光檢查的敏感性。採用鹽裂
皮膚 作底物,大多數CP病人的循環抗體結合在表皮側(見圖7),抗層粘連蛋白5 CP患者的IgG循環抗體結合在真皮側。使用鹽裂的口腔黏膜作底物並不能提高敏感性。以基因敲除的
皮膚 作底物(如某基底膜蛋白缺乏的底物)或FOAM技術(見上)作間接免疫螢光檢查,能將抗表皮整聯配體蛋白CP(抗層粘連蛋白5)與EBA區分開。
免疫電子顯微鏡
CP的直接免疫電鏡研究發現免疫沉積物分布或是在透明板下半部及緻密板或是在半橋粒上或周圍,其中大多數沉積在
漿膜 下基底層角質形成細胞的外側。通過間接免疫電鏡觀察,自身抗體常結合在透明板下半部與緻密板的交界處,在半橋粒的下面和側面(圖14)。儘管電鏡研究不能作為常規,並且耗時長,但是,在不能用傳統IF方法證明組織中有免疫反應物的沉積時,如最近在一部分眼CP患者中所描述的,電鏡對確立這些病人CP的診斷是極為有用的。
圖14 間接免疫電鏡觀察 免疫化學研究 免疫化學技術,特別是免疫印跡和免疫沉澱,已證明在具有CP表型患者中自身靶
抗原 是異源性的。循環中的自身抗體與表皮基底膜帶各種蛋白如層粘連蛋白5、BP180發生結合(見表1)。這些靶
抗原 成為了CP不同臨床亞型的血清標記(見上)。
CP患者通常存在抗BP180胞外域的IgA自身抗體。在某些病例中,這些自身抗體優先與蛋白水解分割或脫落的BP180胞外域,即線狀IgA大皰病抗原(見第32章)上的抗原反應位點結合。已經報導的其他靶抗原,包括168kDa抗原(在頰黏膜有高表達)和某些僅有眼部CP病人的45kDa抗原。然而,對這些發現還需要進一步的研究和確定。
以在細菌或真核表達系統中表達的重組蛋白或親和純化的天然蛋白(如BP180、層粘連蛋白5)為底物,採用ELISA檢測CP病人循環中自身抗體是很有用的,具有很高的敏感性和特異性,並且對CP的預後也有指導意義。
鑑別診斷 對
皮損 主要累及黏膜,表現為水皰或糜爛,和受累組織IF檢查顯示有沿表皮基底膜帶線狀、連續的免疫反應物沉積的患者,都需要考慮CP的診斷。CP與其他表皮下自身免疫性大皰病(包括BP、EBA和線狀IgA大皰性皮病)的鑑別非常困難,通常需要複雜的免疫病理研究(見上)。相反地,與尋常性天皰瘡和非自身免疫性
大皰性皮膚病 的鑑別則較為容易,根據組織病理和常規IF檢查一般可資鑑別。
當口腔損害是唯一表現時,臨床上,CP難以與尋常性
類天皰瘡 或糜爛性LP區分。CP晚期,結膜的瘢痕性損害可與以下疾病相似:嚴重的慢性
感染性結膜炎 、由於眼科製劑(包括毛果芸香鹼、碘苷、胍乙啶、β受體阻滯劑)導致的眼部假性
類天皰瘡 、Stevens-Johnson綜合徵和
中毒性表皮壞死松解症 的晚期。罕見的、有泛發皮損的CP則與BP難以鑑別。總之,以黏膜損害為主,伴有瘢痕的病人應優先考慮CP的診斷.
疾病預後 CP是一種特別慢性、具有潛在毀損性、但很少致死的疾病。最重要的併發症是眼部受累導致視覺受損。CP也可以導致體重下降、
呼吸系統 、性器官和泌尿系統的併發症。即使疾病限局,CP對生活質量也有很大的負面影響。由於嚴重的喉部、氣管或食道病變,出現危及生命的併發症是很罕見的。抗層粘連蛋白5CP患者發生實體器官腫瘤,特別是腺瘤的相對風險增大。
疾病治療 CP患者的治療取決於病情的程度和嚴重性,這要根據多學科對受累組織的詳細評估,治療很困難,並且通常令人沮喪。CP的治療計畫主要依靠臨床實踐。
局部治療是很重要的,在某些病例,可足以控制病情。局部外用強效皮質類固醇對輕中度活動性疾病可取得滿意的療效。局部外用皮質類固醇(如漱口藥或局部外用凝膠或咬合劑),合併四環素漱口液和良好的
口腔 衛生,對口腔的皮損有效。皮質類固醇的噴霧劑和吸入劑對治療
鼻腔 、咽部或食道病變有效。對
皮膚 和黏膜的難治性損害,可通過皮損內局部注射皮質類固醇得到改善。
食道狹窄 需作擴張術,以防止吞咽困難和體重下降。在嚴重氣管受累的病人,需行
氣管插管術 以防止窒息。
系統治療的指征為嚴重的眼部、喉部或食管受累,以及局部治療無效的口腔或
皮膚 損害。氨苯碸(50–150mg/日)是控制口腔和
皮膚 損害的一線治療,也可用於輕度的眼部CP患者。環磷醯胺(1-2mg/kg/日)是對迅速進展或嚴重眼部疾病的治療選擇,可單獨,或與口服皮質類固醇聯合使用,或用衝擊療法。這些治療對緩解嚴重的結膜炎症,預防復發和防止瘢痕形成是有效的。有報告使用硫唑嘌呤(2mg/kg/日)有助於部分控制CP的眼部病變和
皮膚 損害。用藥劑量應當根據硫代嘌呤甲基轉移酶的水平進行調整。
通常,僅僅系統服用皮質類固醇治療CP是不夠的,它們治療黏膜損害比
皮膚 損害效果要差。對有顯著食道或喉支氣管受累的病人,應當積極治療,聯合給予潑尼松和環磷醯胺,以防止可能危及生命併發症的發生。對治療CP可能有效的其他療法,包括磺胺吡啶、米諾環素,和四環素與煙醯胺的聯合用藥、局部外用他克莫斯、局部或系統用環孢素、沙利度胺和結膜下注射絲裂黴素。最新的研究提示IVIG或甲氨蝶呤有助於控制進展性的眼部病變。
對累及眼、喉、食道或生殖器的嚴重
瘢痕 形成,必要時需手術治療。當然,手術應當在藥物完全控制了病情(靜止期)後進行。對眼部病變,外科的干預措施包括角膜移植、同種異體的瞼板移植、羊膜移植和瞼縫合術。
 大皰性類天皰瘡
大皰性類天皰瘡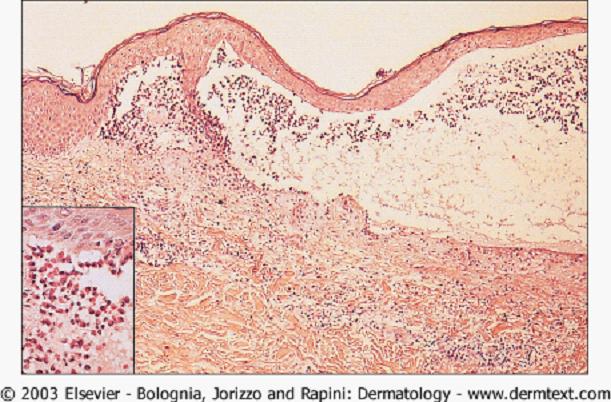 圖6 大皰性類天皰瘡的病理
圖6 大皰性類天皰瘡的病理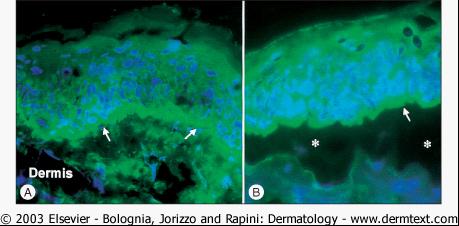 圖7 直接和間接免疫螢光顯微鏡所見
圖7 直接和間接免疫螢光顯微鏡所見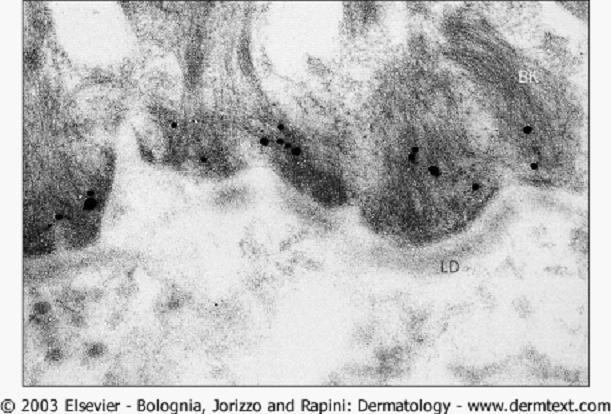 圖8 用免疫金標記的間接免疫電鏡觀察
圖8 用免疫金標記的間接免疫電鏡觀察 瘢痕性類天皰瘡
瘢痕性類天皰瘡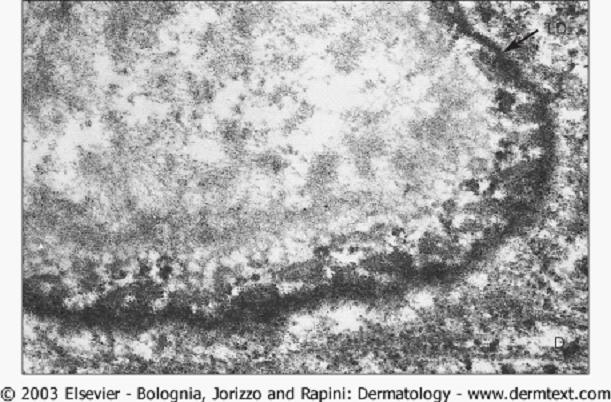 圖14 間接免疫電鏡觀察
圖14 間接免疫電鏡觀察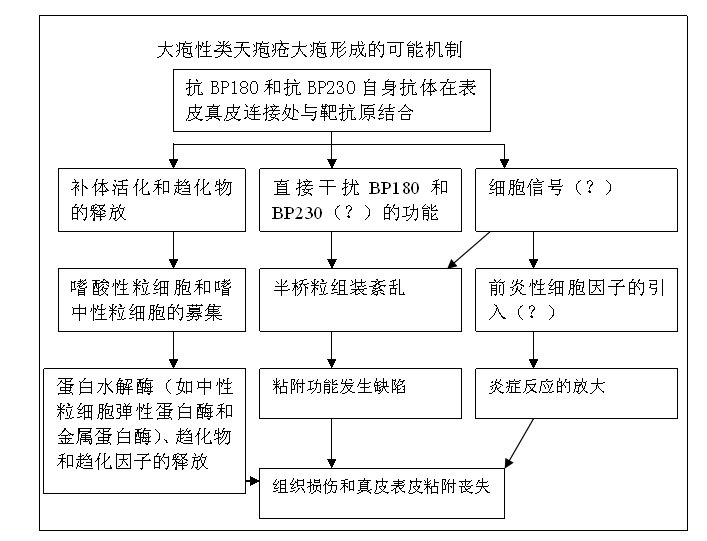 圖1 大皰性類天皰瘡大皰形成的可能機制
圖1 大皰性類天皰瘡大皰形成的可能機制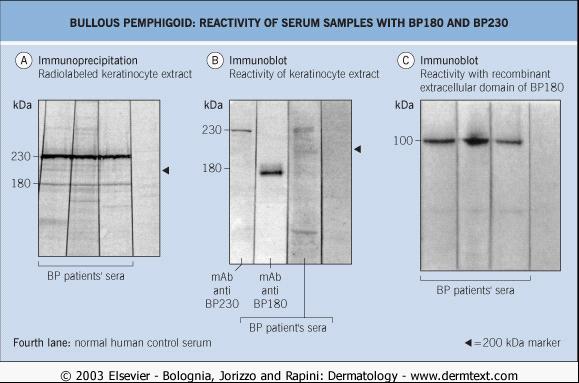 圖9 血清樣品與BP180和BP230的反應性
圖9 血清樣品與BP180和BP230的反應性