基本介紹
概念
特點
類型
複分解反應
 離子反應示意圖
離子反應示意圖氧化還原
 離子反應實驗
離子反應實驗離子互換
絡合反應
 離子反應實驗
離子反應實驗 離子反應條件
離子反應條件 離子反應結構
離子反應結構 離子反應器
離子反應器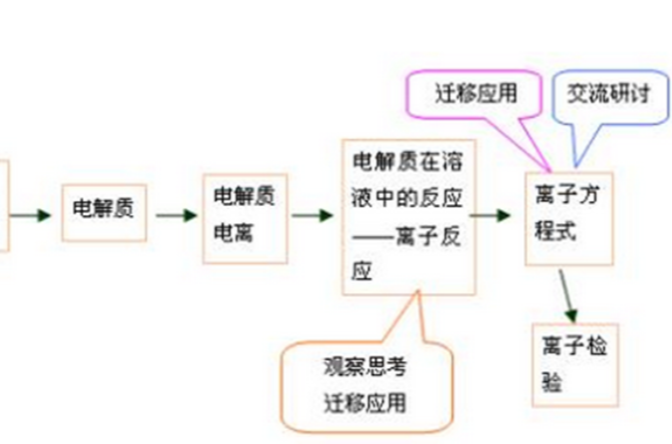
 離子反應示意圖
離子反應示意圖 離子反應實驗
離子反應實驗 離子反應實驗
離子反應實驗 離子反應條件
離子反應條件 離子反應結構
離子反應結構 離子反應器
離子反應器離子反應的本質是某些離子濃度發生改變。常見離子反應多在水溶液中進行。有離子參加的化學反應。根據反應原理,離子反應可分為複分解、鹽類水解、氧化還原、絡合4個...
離子方程式,即用實際參加反應的離子符號表示離子反應的式子。是指可溶性物質可拆的反應。多種離子能否大量共存於同一溶液中,歸納起來就是:一色,二性,三特殊,四...
共價鍵發生異裂時,成鍵電子集中在一個碎片上,產生正負離子,再由正負離子與進攻試劑之間進行的反應,稱為離子型反應。必須指出的是,共價鍵的異裂產生的正負離子,是...
用實際參加反應的離子符號表示反應的式子。一般參加反應的離子可分為強電正離子和弱電負離子。...
離子方程式配平,在離子方程式中,除了難溶物質、氣體、水外,其它的都寫成離子形式,首先讓方程兩端的電荷相等,再用觀察法去配平水、氣體等。...
離子交換反應是指離子交換劑功能基中的陽離子或陰離子與溶液中同性離子進行可逆交換的過程。在濕法冶金中常用於從水溶液中提取有價金屬或作為溶液淨化的一種手段。....
高能重離子反應是我們研究強子結構與強相互作用性質和發展QCD可靠計算方法的重要場所,自旋與核效應則是進行這類研究的重要手段。高能反應通常被分為兩個大類:基本...
反應離子腐蝕技術是一種各向異性很強、選擇性高的乾法腐蝕技術。它是在真空系統中利用分子氣體等離子來進行刻蝕的,利用了離子誘導化學反應來實現各向異性刻蝕,即是...
(ionic polymerization)一、定義:單體在陽離子或陰離子作用下,活化為帶正電荷或帶負電荷的活性離子, v再與單體連鎖聚合形成高聚物的化學反應,統稱為離子型聚合反應...
反應性離子刻蝕 (reaction ionetching;RIE)是製作半導體積體電路的蝕刻工藝之一。在除去不需要的積體電路板上的保護膜時,利用反應性氣體的離子束,切斷保護膜物質的...
金屬離子是某種物質溶於水後的金屬元素的離子。簡單的說就是分子組成的物質中的金屬元素。絕大部分金屬離子是陽離子,但IVB-VIII族金屬可以生成陰離子。金屬離子是...
自由基離子的英 文名是 radical ion。簡稱是離子基。帶有電荷的自由基,具有自由基和離子的雙重性質。帶正電荷的自由基叫自由基正離子(簡稱正離子基,radical ...
帶有電荷的正、負離子自由基。是有機反應中的一種活性中間體,兼有離子和自由基的特性,它可以發生一般的自由基型反應和離子型反應,或者發生進一步的電子轉移反應。...
利用陽離子與陰離子產生的化學反應,根據所產生的化學現象,判斷陰陽離子。...... 利用陽離子與陰離子產生的化學反應,根據所產生的化學現象,判斷陰陽離子。...
SCN離子,含硫氰根離子(SCN)-的化合物。低毒。易與金屬離子形成配位化合物。是3電子16等電子體。...
離子加成反應innic addition rea}lior;化合物中某鍵按不對稱方式斷裂(即異裂),再不對稱地合成新鍵的有機反應。通式為:號一-、 a-Y=7.+E1一s.B一丫Z ...
反應離子腐蝕技術是一種各向異性很強、選擇性高的乾法腐蝕技術。它是在真空系統中利用分子氣體等離子來進行刻蝕的,利用了離子誘導化學反應來實現各向異性刻蝕,即是...
具有極性共價鍵的弱電解質(例如部分弱酸、弱鹼。水也是弱電解質)溶於水時,其分子可以微弱電離出離子;同時,溶液中的相應離子也可以結合成分子。一般地,自上述反應...
