基本介紹
複分解反應是化學中
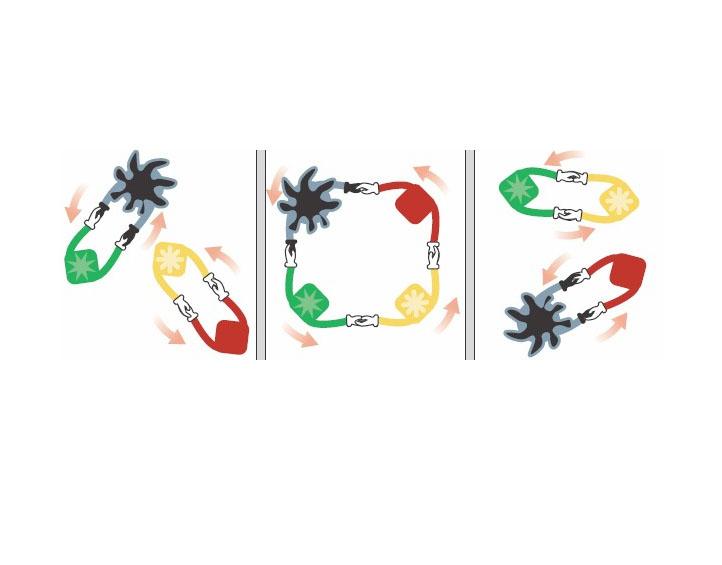
四大基本反應類型之一。要理解它必須抓住概念中的“化合物”和“互相交換成分”這兩個關鍵字。
酸、
鹼、
鹽溶液間發生的反應一般是兩種化合物相互交換成分而形成的,即參加複分解反應的化合物在
水溶液中發生
電離並解離成自由移動的離子,離子間重新組合成新的化合物。因此酸、鹼、鹽溶液間的反應一般是複分解反應。
無機化學中,很少有既是複分解反應又是
氧化還原反應的,在中學階段不考慮化合價變化的複分解反應。
這裡舉出一個既是複分解反應又是氧化還原反應的化學反應
發生條件
基本條件:發生複分解反應的兩種物質能在水溶液中交換離子,結合成難電離的物質(沉澱、氣體或弱電解質)。
1、
鹼性氧化物+酸:酸的酸性較強(如HCl、H
2SO
4、HNO
3等),可發生反應。
2、酸+鹼(
中和反應):當酸、鹼都很弱時,不發生反應。
3、酸+鹽:
強酸制
弱酸;交換離子後有沉澱;強酸與碳酸鹽反應;滿足一個條件即可發生反應。
4、鹼+鹽:
強鹼與
銨鹽反應;兩種反應物都可溶、交換離子後有沉澱、水、氣體三者之一;滿足一個條件即可發生反應。
5、鹽+鹽:兩種反應物都可溶,交換離子後有沉澱、水、氣體三者之一,滿足一個條件即可發生反應。
相關示例
在本段中,所有反應的前提是滿足前段“發生條件”中的要求,所列舉出的條件為補充說明
酸與鹼
條件:酸與鹼中至少有一種可溶。
此外,若生成的鹽不為沉澱(說明:酸鹼中和產生鹽和水,不可能產生氣體),則所有酸鹼中和反應的離子方程式均為【H++OH-====H2O】
(1)從酸的角度分類,即不同酸與鹼反應
鹽酸和鹼反應【HCl+NaOH====NaCl+H
2O】
【2HCl+Ca(OH)
2====CaCl
2+2H
2O】
【2HCl+Cu(OH)
2====CuCl
2+2H
2O】(Cu(OH)
2不溶,但HCl溶,因此能反應)
硫酸和鹼反應【H
2SO
4+2NaOH====Na
2SO
4+2H
2O】
【H
2SO
4+Ca(OH)
2====CaSO
4↓+2H
2O】(CaSO
4微溶)
【H
2SO
4+Ba(OH)
2====BaSO
4↓+2H
2O】
【H
2SO
4+Cu(OH)
2====CuSO
4+2H
2O】
矽酸和鹼反應【H
2SiO
3+2NaOH====Na
2SiO
3+2H
2O】(但由於矽酸微溶,所以反應速率比較慢)
【H
2SiO
3+Ca(OH)
2====CaSiO
3↓+2H
2O】(此反應速率極慢)
(2)從鹼的角度分類,即不同鹼與酸反應
氫氧化鈉和酸反應【HCl+NaOH====NaCl+H
2O】
【H
2SO
4+2NaOH====Na
2SO
4+2H
2O】
【H
2SiO
3+2NaOH====Na
2SiO
3+2H
2O】
氫氧化鈣和酸反應【2HCl+Ca(OH)
2====CaCl
2+2H
2O】
【H
2SO
4+Ca(OH)
2====CaSO
4↓+2H
2O】
【H
2SiO
3+Ca(OH)
2====CaSiO
3↓+2H
2O】
酸與鹽
條件:酸可溶,鹽可以不溶。
 部分酸、鹼、鹽的溶解性表(室溫)
部分酸、鹼、鹽的溶解性表(室溫)鹽酸和碳酸鈣反應(生成碳酸,碳酸不穩定,易分解成水和二氧化碳,下同)
【2HCl+CaCO
3====CaCl
2+H
2O+CO
2↑】
硫酸和氯化鋇反應【H
2SO
4+BaCl
2====2HCl+BaSO
4↓】
鹽酸和硝酸銀反應【HCl+AgNO
3====HNO
3+AgCl↓】
鹼與鹽
條件:鹼和鹽均可溶,常見為強鹼和弱鹽反應生成弱鹼和強鹽。
氫氧化鈉和硫酸銅反應【2NaOH+CuSO
4====Na
2SO
4+Cu(OH)
2↓】
氫氧化鈉和氯化銨反應【NaOH+NH
4Cl====NaCl+NH
3↑+H
2O】
氫氧化鈉和氯化鐵反應【3NaOH+FeCl
3====Fe(OH)
3↓+3NaCl】
氫氧化鈣和碳酸鈉反應【Ca(OH)
2+Na
2CO
3====CaCO
3↓+2NaOH】(工業制NaOH)
氫氧化鐵、氫氧化亞鐵都不會與氯化鈉發生反應。
特例:鹼和鹽中有一種不可溶
氫氧化鈉和硫酸鉛反應【PbSO
4+3NaOH====NaPb(OH)
3+Na
2SO
4】
反應物中鹽不可溶,此處Pb(OH)
3-相當於配合物
氫氧化鎂和銨鹽反應【Mg(OH)
2+2NH
4+====2NH
3↑+Mg
2++2H
2O】
鹼不可溶,但銨鹽溶液水解顯酸性,有H
+與Mg(OH)
2反應
鹽與鹽
條件:兩種鹽都可溶。
特例:只有一種鹽可溶的反應
硫酸氫鈉和碳酸鎂反應【2NaHSO
4+MgCO
3====Na
2SO
4+MgSO
4+CO
2+H
2O】
反應原因:硫酸氫鈉在水溶液中可以電離出H
+
酸與金屬氧化物
鹽酸除鐵鏽【Fe2O3+6HCl====2FeCl3+3H2O】
注意:氯離子對反應有促進作用,硫酸根離子對反應有抑制作用。
特例:NaOH+Al(OH)
3====Na[Al(OH)
4](
四羥基合鋁酸鈉,中學階段簡寫為【NaAlO
2】)
方程式記憶指導
概括上述五種類型的複分解反應能夠發生並趨於完成的條件,可分成兩方面記憶掌握。一方面是對反應物的要求:酸鹽、酸鹼一般行,鹽鹽、鹽鹼都需溶;另一方面是對生成物的要求:生成物中有沉澱析出或有氣體放出,或有水等弱電解質生成。這兩方面必須兼顧,才能正確地書寫有關複分解反應的化學方程式。
特別注意
注意點一:
特別要注意的是,鹼+非金屬氧化物→鹽+水的反應不是複分解反應。
因為根據複分解反應的定義。只有兩種化合物互相交換成分,生成兩種新的化合物的反應才是複分解反應。如【H2SO4+BaCl2====BaSO4↓+2HCl】這個反應中,硫酸的成分(H+和SO42-)與氯化鋇的成分(Cl-和Ba2+)互相交換,形成了硫酸鋇和鹽酸。而例如【CO2+Ca(OH)2====CaCO3↓+H2O】反應中二氧化碳的成分並沒有與氫氧化鈣的成分互相交換,所以這樣的反應不是複分解反應。可以看成CO2溶於水生成H2CO3後,H2CO3再與Ca(OH)2發生複分解反應。
同理,CO2+2NaOH====Na2CO3+H2O和SO2+2NaOH=Na2SO3+H2O之類的反應也不是複分解反應。
注意點二:
酸+
金屬氧化物→鹽+水,屬於複分解反應。如:CaO+2HCl====CaCl
2+H
2O
鹼+
非金屬氧化物→鹽+水,不屬於複分解反應。如:CO
2+2NaOH====Na
2CO
3+H
2O
複分解反應總結
複分解反應是兩種化合物互相交換成分生成另外兩種化合物的反應。其實質是兩種化合物在溶液中發生離子互換,即同時互換陽離子或同時互換陰離子。可簡記為AB+CD=AD+CB
複分解反應的本質是溶液中的離子結合成難電離的物質(如水)、難溶的物質(如沉澱)或揮發性氣體,而使複分解反應趨於完成。 為了準確判別複分解反應的發生,必須熟記常見酸、鹼、鹽的溶解性表,正確地運用物質的溶解性。
1.方法指導:
對複分解反應的理解必須抓住概念中的“兩種化合物”和“互相交換成分”這兩個關鍵字。酸、鹼、鹽溶液之間發生的反應一般是兩種化合物相互交換成分而形成的,即參加反應的化合物在水溶液中發生電離形成自由移動的離子,離子間重新組合成新的化合物,因此酸、鹼、鹽溶液之間的反應一般都是複分解反應。
2.複分解反應發生的條件
複分解反應的發生是需要一定條件的。下面就從反應物和生成物兩個方面,用以下四類具體的反應來分析複分解反應發生的條件。
(1)酸+鹽→新酸+新鹽
反應物中酸必須是可溶的(鹽是否可溶沒有關係),但生成物中至少有一種物質是氣體或沉澱或水。
(2)酸+鹼→鹽+水,反應物中有一種可溶就可以發生反應。
(3)鹽+鹽→新鹽+新鹽,只需要一種可溶就可能反應,且生成物的兩種鹽中至少有一種是沉澱。
(4)鹽+鹼→新鹽+新鹼,只需要一種可溶就可能反應,生成物中至少有一種是沉澱或氣體(只有氨鹽跟鹼反應才能生成氣體)。

 部分酸、鹼、鹽的溶解性表(室溫)
部分酸、鹼、鹽的溶解性表(室溫)
