基本介紹
中文名 :真實世界研究外文名 :Real World Study/Research,RWS/RWR所屬學科 :醫藥文獻出處 :2016年美國國會通過的《21世紀治癒法案 》相近概念 :真實世界證據 ,真實世界數據 首次提出 :1993年,Kapl an等提出
概況,相近概念,套用領域,首次提出,提出背景,RCT的缺陷,提出RWS,國外進展,國內進展,理念引入,首個指南,藥監政策,研究項目,指導原則,試點地區,首個醫療器械上市,首個申報上市新藥,全球首個眼科多病種人工智慧RWS,中國首部生物經濟五年規劃,證實中成藥治療缺血性腦卒中,原發性耳鳴真實世界臨床研究,專刊介紹,項目統計,新冠疫苗藥物,新冠疫苗RWS,抗新冠病毒藥物,中醫藥研究,概念引入,中醫技術規範通則,首個基於家庭醫生研究項目,指導原則,研發新藥,上市再評價,出版著作,便通百萬例RWS,RWS人工智慧行業報告,專業委員會,世界中聯會真實世界研究專業委員會,腫瘤大數據與真實世界研究專委會,中藥協會真實世界研究專委會,研究機構,研究聯盟,研究中心,研究院,重點實驗室,真實世界數據研究平台,海南省臨床真實世界數據研究平台,RCT與RWS互補,研究指南,技術規範,會議論壇,學科評價,人才培養,
概況 國家藥品審評中心將“真實世界研究(Real World Study,RWS;Real World Research,RWR)”定義為:在真實世界環境下收集與患者有關的數據(RWD),通過分析,獲得醫療產品的使用價值及潛在獲益或風險的臨床證據(RWE),主要研究類型是
觀察性研究 ,也可以是
臨床試驗 。
開展真實世界研究最重要的三個環節,分別是高質量的數據與治理、設計嚴謹的研究方案、恰當的統計分析與結果解釋。
真實世界研究,在醫學上是指針對預設的臨床問題,在真實世界環境下收集與研究對象健康有關的數據,通過分析,獲得藥物的使用情況及潛在獲益風險的臨床證據的研究過程,反映了藥品在真實世界中的有效性及安全性。
廣義的真實世界研究既包括以自然人群為對象的研究,也包括以臨床人群為對象的研究;後者所得到的
真實世界證據 既可用於支持醫療產品研發與監管決策,也可用於其它科學目的。
《
真實世界證據支持藥物研發的基本考慮 (徵求意見稿)》僅限於用於支持醫療產品研發與監管決策的真實世界研究,將真實世界研究定義為:在真實世界環境下收集與患者有關的數據(
真實世界數據 ,英文Real World Data,簡寫為RWD),通過分析,獲得醫療產品的使用價值及潛在獲益或風險的臨床證據(
真實世界證據 ,英文Real World Evidence,簡寫為RWE),其主要研究類型是
觀察性研究 ,也可以是實用
臨床試驗 。
早在2016年,美國就通過發布《21世紀醫藥法案》,探索利用“真實世界證據”(RWE)批准現有藥品新適應症和相關研究,隨之而來的是RWS迅速爆火。而在中國,與RWS有關的政策是從2017年的國務院42號文以及2018年發布的《
真實世界研究指南 》開始,進入加速發展期。率先試點的是海南樂城。
相近概念 “
真實世界數據 ”(Real World Data,RWD),“
真實世界證據 (Real World Evidence,RWE)。
套用領域 真實世界證據 的使用涉及藥品開發的各個不同環節。“監管機構越來越關注RWE,特別是醫保支付,這是
真實世界證據 被大量使用的領域。如英國國家臨床最最佳化研究所特別要求用RWE和真實世界研究支持醫保決策、醫保支付方案。”
真實世界研究不同於傳統的
RCT (
隨機對照試驗 ),真實世界研究是非干預的,不人為的對患者入組條件、年齡以及用藥方案等進行限制,得出的結果更符合臨床實際的情況,是真的real world,結果對臨床具有重要指導意義。
真實世界研究不能簡單地視為僅僅只有非干預性研究一種類型,而是涉及到干預性研究和
觀察性研究 兩種類型;多數情況下是觀察性研究,但在某些情況下是干預性研究;有時甚至是干預性和觀察性的研究都同時存在於一個試驗中。反之,經典
臨床試驗 只有單一的基於隨機對照設計的干預性研究。
首次提出 現代意義上的真實世界研究歷史可以追溯至1993年,Kapl an等首次以發表論文的形式明確提出了真實世界研究(RWS)的概念。10餘年來RWS逐漸興起,尤其是2016年底,美國國會公布的《
21世紀治癒法案 》提出,將採用
真實世界證據 用於
藥品 醫療器械 審批,引發業內極大關注。
提出背景 RCT的缺陷 隨機對照試驗 的目的之一就是通過一系列入選與排除標準選取高度均一化(Homogeneous)的受試人群。人為選擇策略能獲得可靠的藥效評價,為
循證醫學 提供科學證據,但這脫離了真實的臨床治療場景,致許多藥物上市後在臨床實踐中並沒那么好。在真實的臨床實踐中,患者群體即使是同一病種,個體與個體有很大的差異,使治療效果往往因人而異。顯然,這種患者群體的高度異質性(Heterogeneous)造成了治療的模糊性和隨機性。在歐美,不乏有依據
RCT 獲批藥物在真實世界中未表現出預期療效而被退市;另外,如
罕見病 藥、兒童藥因入組難,成本大,難開展
RCT 。據2015年的一個統計,“排在美國藥物銷售收入前十名藥物的有效率,好的藥是4個人中1個有效,差的則是25個人中1個有效”。這種廣泛存在的非精確性,導致以
個體化治療 和
保健 為目標的
精確醫學 的興起。
提出RWS 2016年12月7日美國國會通過《
21世紀治癒法案 》(
21st Century Cures Act ),明確
FDA 可以在合適情況下使用
真實世界數據 ,作為
醫療器械 及藥品上市後研究及新適應症開發的審批證據。該法案的一個主要目標是,加快藥品和醫療器械的審批。為了實現“提速”目標,該法案專門制定了第3022條款,即在
美國食品藥品監督管理局 (Food and Drug Administration,
FDA )的基本法規《聯邦食物、藥品和化妝品法案》的第5章中增加一條修正條款:“利用
真實世界證據 ”。隨後,真實世界研究成為製藥巨頭拓展的重要方向。
《21世紀治癒法案》
國外進展 2018年,羅氏收購兩家腫瘤大數據公司,
百時美施貴寶 、
賽諾菲 等製藥巨頭也把RWS納入戰略規劃。
2019年2月,賽諾菲參投開發
真實世界證據 平台及其結果分析的Aetion的B輪融資,此前,賽諾菲設立了RWE項目(RWE&CO)。賽諾菲的RWD平台擁有3億患者數據,覆蓋318個疾病領域,完成40多個RWE項目。
ClinicalTrials網站顯示,真實世界研究數量逐年上升。截至2020年,據不完全統計,以“Real world”相關關鍵字登記在冊的研究達到 1700 多項,其數量達到2016年的兩倍之多。其預計2018-2022 年將出現真實世界研究結論發布的井噴。
國內進展 理念引入 真實世界研究(Real World Study,RWS)的概念在中文科技文獻出現最早在2007年。全球範圍內,以中國為主的東亞地區是真實世界研究申報最為活躍的地區,有18.91%的研究地點在中國。中國是真實世界研究的熱點地區。
首個指南 中國的“真實世界研究”剛起步,2018年8月,在第八屆中國腫瘤學臨床試驗發展論壇上,
吳階平醫學基金會 和中國胸部腫瘤研究協作組攜手發布《2018年中國
真實世界研究指南 》,這是中國首個RWS指南。
藥監政策 2019年4月底,國家藥品監管局啟動實施中國藥品監管科學行動計畫,把“將
真實世界數據 用於
醫療器械 臨床評價的方法學研究”列為首批9個行動計畫項目中的一項,標誌著中國藥品監管部門正式啟動將RWD/RWE用於審評審批方面的探索與研究。
2019年6月,國家藥監局與海南省聯合啟動海南臨床
真實世界數據 套用試點,探索將臨床真實世界數據用於藥品醫療器械產品註冊和監管決策實踐。
2020年3月26日,國家藥監局批准了美國艾爾建公司“
青光眼引流管 ”產品的註冊。
研究項目 肺癌真實世界研究
2019年5月25日,中國首個I-IIIA期NSCLC(
非小細胞肺癌 )真實世界研究項目,在深圳啟動。
相對其他癌種來說,
肺癌 治療領域近十年來進展迅速。在國家政策的支持下,
新藥 進入中國的速度也已經明顯變快。中國有和其他國家幾乎同步的治療指南、先進藥物,然而中國肺癌的
五年生存率 與日本、韓國、美國相比,都處於低位。因此,真實世界研究勢在必行。通過真實世界研究的發現,希望給提升肺癌患者生存率方面提供指導方向和意見。
2019年9月22日,華潤三九聯合
中國藥學會 中藥臨床評價專業委員會啟動十萬例
中藥配方顆粒 安全性真實世界研究項目。
“對於真實世界研究,中國反應很快,力度很大,2018年就依託衛健委衛生髮展研究中心成立了國家藥物與衛生技術綜合評價中心,並負責指南和標準制定,下一步將建立國家級的基於真實世界的共享機制平台。2-3年內,在腫瘤、兒童用藥、心血管三個領域進行指南開發。”
2023年5月,《
中國中藥雜誌 》刊發論文《中藥配方顆粒臨床安全性集中監測評價》,研究結果顯示華潤三九現代中藥配方顆粒臨床
不良反應 發生率為0.015%,屬於罕見級別。這是國內首箇中藥配方顆粒大樣本臨床安全性評價,填補了行業循證安全研究的空白。
中國男性生殖相關基因篩查
2021年7月3日,全球最大規模“男性生殖相關基因篩查與診斷真實世界研究項目”(《中國男性生殖相關基因篩查與診斷真實世界研究暨中國男性生殖相關基因資料庫建設》),在
江蘇 啟動。
指導原則 試點地區 海南樂城
首個醫療器械上市 首個申報上市新藥 2021年4月7日,歐康維視生物宣布其核心品種——治療慢性非感染性葡萄膜炎產品OT-401(
氟輕鬆玻璃體植入劑 )的
新藥 上市申請正式獲國家藥監局受理。這是中國
藥品註冊 史上第一個完全基於真實世界研究數據申報上市的新藥,也是國家藥監局首次受理以真實世界研究數據申報的藥品。
真實世界數據 研究路徑,至少讓這款藥的上市加快1年半。
全球首個眼科多病種人工智慧RWS 在同期評論中,美國
威斯康星大學 影像診斷中心主任Amitha Domalpally將此項研究評價為“標誌著醫學人工智慧研究邁向正確的發展方向”。這項研究最大的意義在於首次在大規模眼科真實世界研究中驗證了人工智慧軟體的準確率。
中國首部生物經濟五年規劃 證實中成藥治療缺血性腦卒中 2022年5月13日,由北京中醫藥大學中醫腦病研究院
高穎 院長、首都醫科大學
吉訓明 副校長牽頭研究的真實世界研究證實“毒損腦絡理論”指導下中成藥
腦栓通膠囊 治療
缺血性腦卒中 的療效。
原發性耳鳴真實世界臨床研究 2022年5月14日,由悅康藥業發起的
悅康通 治療原發性耳鳴真實世界臨床研究首研單位啟動會在北京舉行,此次啟動會成為悅康通
銀杏葉提取物注射液 自2021年10月10日開展真實世界臨床研究以來一次重要里程碑,標誌著悅康通治療原發性耳鳴的真實世界臨床研究正式開始入組
受試者 。該項目的主要研究者是中國工程院院士
韓德民 。
專刊介紹 2021年第11期,《
中國食品藥品監管 》雜誌與
海南省真實世界數據研究院 共建“真實世界數據研究與藥械監管創新”專刊,以專刊特稿、臨床研究方法學、註冊及上市後臨床研究、真實世界證據與監管科學等欄目,介紹真實世界數據研究設計、數據治理技術及統計分析方法研究進展,綜述了
真實世界證據 支持全球醫療器械監管決策現狀,展示了海南博鰲樂城國際醫療旅遊先行區真實世界數據研究成果及案例介紹。
項目統計 2020年有數據統計,在持續升溫的真實世界研究中,有18.91%的研究地點在中國。其中,處於活躍狀態的研究項目占比達68%,比全球平均水平高出15%以上。
新冠疫苗藥物 新冠疫苗RWS 2021年4月,
智利 衛生部公布了由
北京科興中維生物技術有限公司 (Sinovac)聯合多家合作單位開發的
滅活疫苗 克爾來福 (CoronaVac)在智利全國範圍接種的
真實世界數據 。這是智利衛生部基於他們醫保系統數據所做的分析,這也是迄今為止檢驗
克爾來福 保護效力的最大規模
真實世界數據 。2021年7月7日,《
新英格蘭醫學雜誌 (
NEJM )》線上正式發表了智利開展的新冠病毒滅活疫苗克爾來福在真實世界中保護效果研究的結果:接種克爾來福可顯著減少因感染新冠病毒導致的住院、重症和死亡風險。對於完成全程接種人群,克爾來福對預防有症狀的新冠病例的保護效果為65.9%;預防需要住院治療病例的保護效果為87.5%;預防重症病例的保護效果為90.3%,預防感染造成死亡的保護效果為86.3%。
2021年7月1日,
NEJM(The New England Journal of Medicine, 新英格蘭醫學期刊 ) 發表了一項重要研究,分析了兩個
mRNA疫苗 在真實世界研究中的效果:mRNA 疫苗部分接種後,預防新冠病毒感染的有效率為 81%;mRNA 疫苗完全接種後,預防新冠病毒感染的有效率為 91%。
抗新冠病毒藥物 2023年6月9日,中國首個針對已上市抗新冠病毒藥物的大規模真實世界研究在北京正式啟動。該研究由全國30個省市自治區、逾百家大型醫院和基層醫療機構參與,將納入近4萬名新冠患者的真實數據。研究將反映中國新冠治療在臨床方案、隨訪機制、醫療花費等方面的情況,並進一步探索抗新冠病毒藥物的療效、安全性和藥物經濟學價值,為新冠“
乙類乙管 ”常態化管理提供一手數據支持,助力疫情防控“保健康、防重症”目標實現。
中醫藥研究 概念引入 2010年,由
中醫 科學家將真實世界研究(Real World Study,RWS)的概念最早引入中國。
中醫技術規範通則 首個基於家庭醫生研究項目 2019年5月22日,全國首個基於
家庭醫生 的
中醫藥 真實世界研究項目啟動會在廣州召開。這標誌著幾千年來的傳統
中醫藥 採用現代臨床科研方法進行上市後的臨床價值再評價與深度挖潛邁出新的一步,此舉有望為中國近萬種
中成藥 的上市後安全性、有效性驗證找到新方法、新途徑。
指導原則 研發新藥 國家藥監局提出“對於名老中醫經驗方、中藥醫療機構製劑等已有人用經驗藥物的臨床研發,在處方固定、生產工藝路線基本成型的基礎上,可嘗試將真實世界研究與隨機
臨床試驗 相結合,探索臨床研發的新路徑”。
探索將
觀察性研究 (包括回顧性和前瞻性)代替常規臨床研發中I期和/或II期
臨床試驗 ,用於初步探索臨床療效和安全性;在觀察性研究的基礎上,再通過
RCT 或PCT進一步確證已有人用經驗中藥的有效性,為產品的註冊上市提供支持證據。如果經過評價,存在適用的高質量
真實世界數據 ,且通過設計良好的觀察性研究形成的
真實世界證據 科學充分,也可與藥品監管部門溝通,申請直接作為支持產品上市的依據。
對於中藥,用觀察性研究代替一期二期研究,提出研發路徑,彌補歷史數據的缺失。
上市再評價 正常情況下,
中成藥 上市前都要開展嚴格的
隨機對照試驗 (
RCT ),以明確其效力。但是,由於
RCT 在“嚴格限制的科研場所”開展,其結果並不一定適用於“醫療機構、家庭和社區”等真實的醫療環境。因此上市後研究以真實世界研究為主。
真實世界證據 的價值體現在中藥上市後再評價的方方面面,尤其在明確藥物臨床定位、完善安全性信息、確定臨床劑量、開展
藥物經濟學 研究方面更加突出。
出版著作 便通百萬例RWS 2021年4月,便通百萬例真實世界研究項目啟動,旨在針對便通膠囊的臨床運用,通過非隨機對照研究方式註冊登記研究100萬例真實案例。
RWS人工智慧行業報告 2021年10月27日,由
上海域唯醫療科技有限公司 聯合撰寫的全球首份描繪醫療
人工智慧 企業參與真實世界研究的行業發展報告發布。該報告預測在人工智慧技術的驅動下,未來3年,中國真實世界研究市場規模將以每年超過40%的速度增長。
專業委員會 世界中聯會真實世界研究專業委員會 腫瘤大數據與真實世界研究專委會 中藥協會真實世界研究專委會 2019年10月11-12日,
中國中藥協會真實世界研究專業委員會 成立大會暨首屆中醫藥真實世界研究學術研討會等系列學術會議在北京召開。主任委員
孫鑫 闡述了專委會的使命及工作規劃:將充分實現多學科融合交流,團結行業中西醫臨床、數據統計、方法學專家,瞄準
中醫藥 發展痛點,專注構建中醫藥真實世界研究關鍵方法體系,生產高質量中藥
真實世界證據 ,促進證據高效使用與決策轉化。
研究機構 研究聯盟 中國真實世界數據與研究聯盟
中國真實世界研究聯盟
研究中心 廣州市大灣區中醫藥真實世界研究中心
博鰲樂城真實世界數據研究創新中心
博鰲樂城眼病真實世界數據平台
四川省真實世界數據技術創新中心
中藥真實世界循證與轉化浙江省工程研究中心
研究院 海南省真實世界數據研究院
重點實驗室 海南真實世界數據研究與評價重點實驗室
真實世界數據研究平台 2021年下半年,
真實世界數據研究平台 將上線運行,意味著樂城真實世界研究工作又將往前邁出一大步,為推動真實世界研究工作搭建了良好平台,成為中國藥品科學監管的新高地。
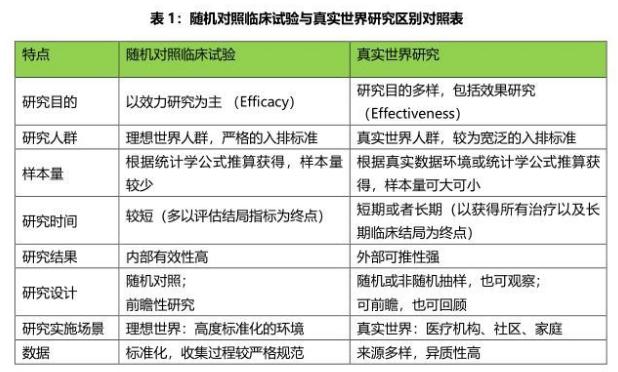
海南省臨床真實世界數據研究平台 RCT與RWS互補 RCT 是理想狀態下釣魚,比如一個魚塘或者網箱,是高度控制的人工環境;而RWS是現實中釣魚,是真實的江河湖泊,是自然環境。
RCT與RWS的區別
研究指南 技術規範 會議論壇 2018年6月,首屆真實世界數據與研究全國大會在成都舉行。
2019年6月,第二屆真實世界數據與研究全國大會在成都舉行。
2019年7月20日至21日,“2019真實世界研究高峰論壇”在
北京大學 召開。
2019真實世界研究高峰論壇
2020年7月,由
南方醫科大學 生物統計學系、開心生活科技聯合舉辦的真實世界研究支持藥物研發和監管決策高端對話在上海舉行,探討如何更好推動真實世界研究套用於藥物研發和監管決策。
2021年4月10日,由
武漢大學董輔礽經濟社會發展研究院 和武漢大學健康經濟與管理研究中心舉辦的“醫藥產業與真實世界大數據前沿論壇”在武漢大學經濟與管理學院召開。
2022年12月8日,首屆“博鰲國際藥械真實世界研究大會”在博鰲召開。
學科評價 2011年,英國製藥工業協會表示,
真實世界證據 與
隨機對照試驗 產生的證據是相互補充的關係,兩者在證據等級中處於“平等地位”。
第三屆中華醫學事務年會上發布了《真實世界研究實踐專家共識》,裡面寫道:“在真實世界研究中沒有任何一種設計一定優於其他設計,也沒有任何一種研究設計能回答所有的研究問題。”
“近年來,中國生命健康領域科技創新、標準化發展均取得了一定的進步,但兩者在相互促進、相互推動方面仍有較大局限。”全國人大代表、中科院院士
李林 告訴記者,最大的局限在於支撐真實世界研究的標準體系尚未建立。
人才培養 在海南省教育廳的支持下,
海南省真實世界數據研究院 與
海南大學 合作開設全國首個跨學科“真實世界數據套用”碩博研究生培養點,為全國真實世界研究工作培養儲備一批高端人才。