基本介紹
是以
沉澱反應為基礎的一種滴定分析方法。
沉澱滴定法必須滿足的條件:1.S小,且能定量完成;2.
反應速度大;3.有適當
指示劑指示終點;4.吸附現象不影響終點觀察。
生成沉澱的反應很多,但符合
容量分析條件的卻很少,實際上套用最多的是
銀量法,即利用Ag+與鹵素離子的反應來測定Cl-、Br-、I-、SCN-和Ag+。
銀量法共分三種,分別以創立者的姓名來命名。

福爾哈德法 ①直接
滴定法。在含Ag的酸性試液中,加NH4Fe(SO4)2為指示劑,以NH4SCN為滴定劑,先生成AgSCN白色沉澱,當紅色的Fe(SCN)2+出現時,表示Ag+已被定量沉澱,終點已到達。此法主要用於測Ag+。②
返滴定法。在含鹵素離子的酸性溶液中,先加入一定量的過量的AgNO3標準溶液,再加指示劑NH4Fe(SO4)2,以NH4SCN
標準溶液滴定過剩的Ag+,直到出現紅色為止。兩種試劑用量之差即為鹵素離子的量。此法的優點是選擇性高,不受弱
酸根離子的干擾。但用本法測Cl-時,宜加入
硝基苯,將沉澱包住,以免部分的Cl-由沉澱轉入溶液。
法揚斯法 在中性或弱鹼性的含Cl-試液中加入吸附
指示劑螢光黃,當用Ag-NO3滴定時,在
等當點以前,溶液中Cl-過剩,
AgCl沉澱的
表面吸附Cl-而帶負電,指示劑不變色。在等當點後,Ag+過剩,沉澱的表面吸附Ag+而帶正電,它會吸附荷負電的螢光黃離子,使沉澱表面顯示粉紅色,從而指示終點已到達。此法的優點是方便。
原則
雖然可定量進行的
沉澱反應很多,但由於缺乏合適的
指示劑,而套用於沉澱滿定的反應並不多,目前比較有實際意義的是銀量法。因此本人將銀量法用兩種表達方式集合一起給大家參考,希望能讓大家都掌握這個方法。
沉澱滴定法:根據其確定終點指示劑的方法不同常分為三種。
詳細
莫爾法
——K2CrO4指示劑
終點時:2Ag++CrO42-=Ag2CrO4ˉ(磚紅色)Ksp=2.0×10ˉ12
沉澱的溶解度S:SAgCl
計量點附近終點出現的早晚與溶液中[CrO42-]有關:
[CrO42-]過大------終點提前------結果偏低(-TE%)
[CrO42-]過小-------終點推遲------結果偏高(+TE%)
 沉澱滴定法
沉澱滴定法實際滴定中:因為K2CrO4本身呈黃色,按[CrO42-]=5.9×10-2mol/L加入,則黃顏色太深而影響終點觀察,實驗中,採用K2CrO4濃度為2.6×10-3mol/L~5.6×10-3mol/L範圍比較理想。(計算可知此時引起的誤差TE<±0.1%)
在實驗中:50~100ml溶液中加入5%K2CrO41ml。
通常溶液的酸度應控制在pH=6.5~10(中性或弱鹼性),
若酸度高,則:
Ag2CrO4+H=2Ag++HCrO4- Ka2=3.2×10-7
2HCrO4-?Cr2O72-+H2OK=98
若鹼性太強:2Ag++2OH-2AgOH=AgO↓+H2O
當溶液中有少量
NH3存在時,則應控制在pH=6.5~7:
NH3++OH-NH3+H2O=Ag+Ag(NH3)2
2.沉澱的吸附現象 先生成的
AgCl↓易吸附Cl-使溶液中[Cl-]↓,終點提前,滴定時必須劇烈搖動。AgBr↓吸附更強。
3.干擾離子的影響
①能與Ag+生成沉澱的陰離子(PO43-、AsO43-、SO32-、S2-、CO32-、C2O42-)
②能與Cr2O72-生成沉澱的
陽離子(Pb2+、Ba2+)
③在弱鹼性條件下易
水解的離子(Al3+、Fe3+、Bi3+)
④大量的
有色離子(Co2+、Cu2+、Ni2+)都可能幹擾測定,應預先分離。
佛爾哈德法
——鐵銨礬[NH4Fe(SO4)2]指示劑
(一)原理:
SCN-+Ag+=AgSCN↓(白色)
Ksp=1.0×10-12終點時:SCN-+Fe3+=FeSCN2+(紅色)
K穩=138
 沉澱滴定法
沉澱滴定法終點出現早晚與[Fe3+]大小有關。
(二)滴定條件
2.直接
滴定法測定Ag+時,AgSCNˉ吸附Ag+,近終點時劇烈搖動
Cl-+Ag+(過量)=
AgClˉ SAgCl=1.35×10-5mol/L大
Ag+(剩餘)+SCN-?AgSCNˉ SAgSCN=1.0×10-6mol/L小
終點時:SCN-+Fe+=FeSCN2+(紅)發生
轉化作用:
AgClˉ+SCN-=AgSCNˉ+Cl-
致使[SCN-]ˉ,已生成的FeSCN2+
離解,紅色消失,多消耗SCN-,造成較大誤差,常採取預防措施:
(2)近終點時,防止劇烈搖動;
(3)加入AgNO3先生成AgClˉ後,先加熱至沸使AgCl凝聚。4.
干擾物質 沉澱滴定法
沉澱滴定法法揚斯法
——吸附指示劑
(一)原理:
吸附
指示劑大多是
有機酸------當被沉澱
表面吸附後------結構發生變化------顏色發生變化
例:用AgNO3溶液
滴定Cl-,採用有機酸
螢光黃指示劑(HFIn),為指示劑:
AgCl+Cl-?AgCl=Cl-吸附構晶離子
計量點後—終點時:AgCl+Ag+?AgCl·Ag+(Ag+過量)AgCl·Ag++FIn-=AgCl+AgFIn
 沉澱滴定法
沉澱滴定法黃綠色粉紅色
(二)滴定條件
2.酸度:一般在中性、弱鹼性、弱酸性溶液中進行
HFIn分子不易被吸附,FIn-陰離子存在與Ka有關.
但:最高pH二甲基二碘螢光黃>Br->曙紅>Cl->螢光黃或
二氯螢光黃銀量法
定義
原理
以
硝酸銀液為
滴定液,測定能與Ag+生成沉澱的物質,根據消耗滴定液的濃度和毫升數,可計算出被測物質的含量。
反應式:Ag++X-→AgX↓
X-表示Cl-、Br-、I-、CN-、SCN-等離子。
指示終點方式
1.原理
終點時2Ag++CrO42-→Ag2CrO4↓(磚紅色)
根據
分步沉澱的原理,
溶度積(
Ksp)小的先沉澱,溶度積大的
後沉澱。由於AgCl的溶解度小於Ag
2CrO
4的溶解度,當Ag+進入濃度較大的Cl-溶液中時,AgCl將首先生成沉澱,而[Ag+]
2[CrO
42-]<Ksp
(Ag2CrO4),Ag
2CrO
4不能形成沉澱;隨著滴定的進行,Cl
-濃度不斷降低,Ag
+濃度不斷增大,在
等當點後發生突變,
[Ag
+][CrO
42-]>Ksp(Ag
2CrO
4),於是出現磚紅色沉澱,指示
滴定終點的到達。
(1)終點到達的遲早與溶液中
指示劑的濃度有關。為達到終點恰好與等當點一致的目的,必須控制溶液中CrO
42-的濃度。每50~100ml滴定溶液中加入5%(W/V)K
2CrO
4溶液1ml就可以了。
(2)用K
2CrO
4作指示劑,滴定不能在酸性溶液中進行,因指示劑K
2CrO
4是
弱酸鹽,在酸性溶液中CrO
42-依下列反應與H
+離子結合,使CrO
42-濃度降低過多,在等當點不能形成Ag
2CrO
4沉澱。
2CrO42-+2H+→←2HCrO4-→←Cr2O72-+H2O
也不能在鹼性溶液中進行,因為Ag+將形成Ag2O沉澱:
Ag++OH-→AgOH
2AgOH→Ag2O↓+H2O
滴定不能在氨性溶液中進行,因
AgCl和Ag
2CrO
4皆可生成[Ag(NH
3)
2]
+而溶解。
3.主要套用
本法多用於Cl-、Br-的測定。
1.原理
在酸性溶液中,用NH4SCN(或KSCN)為
滴定液滴定Ag+,以Fe3+為指示劑的滴定方法。
滴定反應為:
終點前Ag++SCN-→AgSCN↓
鹵化物的測定可用回滴法,需向檢品溶液中先加入定量過量的AgNO3滴定液,以為Fe3+指示劑,用NH4SCN滴定液回滴剩餘的AgNO3,滴定反應為:
終點前Ag+(過量)+X-→AgX↓
Ag+(剩餘量)+SCN-→AgSCN↓
終點時Fe3++SCN-→Fe(SCN)2+(淡棕紅色)
這裡需指出,當滴定Cl-到達
等當點時,溶液中同時有
AgCl和AgSCN兩種難溶性
銀鹽存在,若用力振搖,將使已生成的Fe(SCN)2+
絡離子的紅色消失。因AgSCN的溶解度小於AgCl的溶解度。當剩餘的Ag+被滴定完後,SCN-就會將AgCl沉澱中的Ag+轉化為AgSCN沉澱而使重新釋出。
AgCl→←Ag++Cl-
↓
Ag++SCN-→←AgSCN
這樣,在等當點之後又消耗較多的NH4SCN
滴定液,造成較大的
滴定誤差。
2.滴定條件及注意事項
(1)為了避免上述轉化反應的進行,可以採取下列措施:
a 將生成的
AgCl沉澱濾出,再用NH4SCN滴定液滴定濾液,但這一方法需要過濾、洗滌等操作,手續較繁。
b 在用NH4SCN滴定液回滴之前,向待測Cl-溶液中加入1~3ml
硝基苯,並強烈振搖,使硝基苯包在AgCl的表面上,減少AgCl與SCN-的接觸,防止轉化。此法操作簡便易行。
c 利用高濃度的Fe3+作
指示劑(在
滴定終點時使濃度達到0.2mol/L),實驗結果證明終點誤差可減少到0.1%。
(2)此外,用本法時,應注意下列事項:
a 為防止Fe3+的
水解,應在酸性(HNO3)溶液中進行滴定,在酸性溶液中,Al3+、Zn2+、Ba2+及CO32-等離子的存在也不干擾。與
鉻酸鉀指示劑法相比,這是本法的最大優點。
b 為避免由於沉澱吸附Ag+過早到達終點,在用硝基苯包裹AgCl沉澱時,臨近終點應輕輕旋搖,以免沉澱轉化,直到溶液出現穩定的淡棕紅色為止。
c 本法測定I-和Br-時,由於AgI和AgBr的溶解度都小於AgCl的溶解度,不存在沉澱轉化問題,不需加入有機溶劑或濾去沉澱,
滴定終點明顯確切。
d 滴定不宜在較高溫度下進行,否則紅色
絡合物褪色。
1.原理
用AgNO3液為
滴定液,以吸附指示劑指示終點,測定
鹵化物的滴定方法。
吸附指示劑是一些
有機染料,它們的陰離子在溶液中很容易被帶正電荷的膠態沉澱所吸附,而不被帶負電荷的膠態沉澱所吸附,並且在吸附後結構
變形發生顏色改變。
若以Fl-代表
螢光黃指示劑的陰離子,則變化情況為:
終點時Ag+過量(AgCl)Ag+┇X-
(AgCl)Ag+吸附Fl-(AgCl)Ag+┇Fl-
2.滴定條件
為了使終點顏色變化明顯,套用吸附
指示劑時需要注意以下幾個問題:
(1)吸附指示劑不是使溶液發生顏色變化,而是使沉澱的表面發生顏色變化。因此,應儘可能使
鹵化銀沉澱呈
膠體狀態,具有較大的表面。為此,在滴定前應將溶液稀釋並加入
糊精、澱粉等
親水性高分子化合物以形成
保護膠體。同時,應避免大量中性鹽存在,因為它能使膠體凝聚。
(2)膠體顆粒對指示劑離子的吸附力,應略小於對被測離子的吸附力,否則指示劑將在
等當點前變色。但對指示劑離子的吸附力也不能太小,否則等當點後也不能立即變色。滴定
鹵化物時,鹵化銀對鹵化物和幾種常用的吸附指示劑的吸附力的大小次序如下:
I->二甲基二碘
螢光黃>Br->
曙紅>Cl->螢光黃
因此在測定Cl-時不能選用曙紅,而應選用螢光黃為
指示劑。
(3)溶液的pH應適當,常用的吸附指示劑多是有機弱酸,而起指示劑作用的是它們的陰離子。因此,溶液的pH應有利於吸附指示劑陰離子的存在。也就是說,
電離常數小的吸附指示劑,溶液的pH就要偏高些;反之,電離常數大的吸附指示劑,溶液的pH就要偏低些。
(4)指示劑的離子與加入滴定劑的離子應帶有相反的電荷。
(5)帶有吸附指示劑的
鹵化銀膠體對光線極敏感,遇光易分解析出金屬銀,在滴定過程中應避免強光照射。
測定
巴比妥類化合物,在其結構中的
亞胺基受兩個
羰基影響,上面的H很活潑,能被Ag+置換生成可溶性
銀鹽,而它的二銀鹽不溶於水,利用這一性質可進行測定。
配製與標定
1.配製間接法配製
3.貯藏置玻璃塞的棕色玻瓶中,密閉保存。
1.配製間接法配製
2.標定用硝酸銀滴定液標定,以
硫酸鐵銨指示液指示終點。
注意事項
1.用
鉻酸鉀指示劑法,必須在近中性或弱鹼性溶液(pH6.5~10.5)中進行滴定。因鉻酸鉀是弱酸鹽,在酸性溶液中,CrO42-與H+結合,降低CrO42-濃度,在
等當點時不能立即生成
鉻酸銀沉澱;此法也不能在鹼性溶液中進行,因
銀離子氫氧根離子生成
氧化銀沉澱。
2.應防止氨的存在,氨與銀離子生成可溶性[Ag(NH3)2]+
絡合物,干擾
氯化銀沉澱生成。
5.滴定應在室溫進行,溫度高,紅色絡合物易褪色。
6.滴定時需用力振搖,避免沉澱吸附
銀離子,過早到達終點。但滴定接近終點時,要輕輕振搖,減少氯化銀與SCN-接觸,以免沉澱轉化。
7.吸附
指示劑法,滴定前加入
糊精、澱粉,形成
保護膠體,防止沉澱凝聚使吸附指示劑在沉澱的表面發生顏色變化,易於觀察終點。
滴定溶液的pH值應有利於吸附指示劑的電離,隨指示劑不同而異。
8.吸附指示劑法選用指示劑應略小於被測離子的吸附力,吸附力大小次序為I->二甲基二碘
螢光黃>Br->
曙紅>Cl->螢光黃。
9.滴定時避免陽光直射,因
鹵化銀遇光易分解,使沉澱變為灰黑色。
10.有機
鹵化物的測定,由於有機鹵化物中鹵素結合方式不同,多數不能直接採用
銀量法,必須經過適當處理,使有機鹵素轉變成
鹵離子後再用銀量法測定。
適用範圍
2.硫酸鐵銨指示劑法:在酸性溶液中,用
硫氰酸銨液為滴定液滴定Ag+,採用
硫酸鐵銨為指示劑的滴定方法。
3.吸附指示劑法:用硝酸銀液為滴定液,以吸附指示劑指示終點測定
鹵化物的滴定方法。
允許差
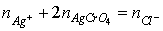 沉澱滴定法
沉澱滴定法 沉澱滴定法
沉澱滴定法 沉澱滴定法
沉澱滴定法 沉澱滴定法
沉澱滴定法 沉澱滴定法
沉澱滴定法 沉澱滴定法
沉澱滴定法 沉澱滴定法
沉澱滴定法 沉澱滴定法
沉澱滴定法 沉澱滴定法
沉澱滴定法 沉澱滴定法
沉澱滴定法 沉澱滴定法
沉澱滴定法 沉澱滴定法
沉澱滴定法 沉澱滴定法
沉澱滴定法 沉澱滴定法
沉澱滴定法