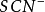基本介紹
- 中文名:莫爾法
- 外文名:Mohr
- 性質:一種衡量沉澱滴定法
- 指示劑:鉻酸鉀
簡介,原理,舉例說明指示劑的用量問題,原理:以AgNO3標準溶液測定Cl-為例,指示劑用量,滴定條件,硝酸銀溶液的配製,主要套用範圍,
簡介
莫爾(Mohr)法是用鉻酸鉀為指示劑,在中性或弱鹼性溶液中,用硝酸銀標準溶液直接滴定氯離子(或溴離子)。根據分步沉澱的原理,首先是生成AgCl沉澱,隨硝酸銀不斷加入,溶液中氯離子越來越小,銀離子則相應地增大,磚紅色鉻酸銀沉澱的出現指示滴定終點。
原理
已知Ksp(AgCl)=1.8x10-10,Ksp(Ag2CrO4)=1.2x10-12,Ksp(AgCl)> Ksp(Ag2CrO4),按照分部沉澱原理則應是鉻酸銀先析出,與實際情況不符。實際上,AgCl是AB型難溶物,鉻酸銀是A2B型難溶物,不能單純通過比較溶度積常數Ksp來確定,而是應該計算沉澱時誰需要的Ag+的濃度小誰先析出。
對於AgCl,AgCl開始析出時,[Ag+]=Ksp(AgCl)/ [Cl-] ;
對於Ag2CrO4,Ag2CrO4開始析出時,[Ag+]=sqrt(Ksp(Ag2CrO4)/ [CrO42-])
舉例說明指示劑的用量問題
以K2CrO4為指示劑
原理:以AgNO3標準溶液測定Cl-為例
終點時:2Ag++CrO42-=Ag2CrO4↓(磚紅色)Ksp=2.0×10ˉ12
沉澱的溶解度S:SAgCl=1.34×10-5mol/L
計量點附近終點出現的早晚與溶液中[CrO42-]有關:
[CrO42-]過大------終點提前------結果偏低(-TE%)
[CrO42-]過小-------終點推遲------結果偏高(+TE%)
指示劑用量
理論計算:在計量點時,溶液中Ag+物質的量應等於Cl-物質的量若計量點時溶液的體積為100ml,實驗證明,在100ml溶液中,當能覺察到明顯的磚紅色鉻酸銀沉澱出現時,需用去AgNO3物質的量為2.5×10-6mol,即實際滴定中:因為K2CrO4本身呈黃色,按[CrO42-]=5.9×10-2mol/L加入,則黃顏色太深而影響終點觀察,實驗中,採用K2CrO4濃度為2.6×10-3mol/L~5.6×10-3mol/L範圍比較理想。(計算可知此時引起的誤差TE<±0.1%) 公式
公式
 公式
公式在實驗中:50~100ml溶液中加入5%K2CrO41ml。
滴定條件
套用鉻酸鉀作指示劑應注意以下幾點:
(1)滴定應當在中性或弱鹼性介質中進行。若在酸性介質中,重鉻酸根離子將與氫離子作用生成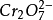 ,溶液中鉻酸根離子濃度將減小,鉻酸銀沉澱出現過遲,甚至不會沉澱;但若鹼度過高,又將出現氧化二銀沉澱。莫爾法測定的最適宜pH範圍是6.5~10.5。若溶液鹼性太強,可先用稀硝酸中和至甲基紅變橙,再滴加稀NaOH至橙色變黃;酸性太強,則用碳酸氫鈉,碳酸鈉或硼砂中和。
,溶液中鉻酸根離子濃度將減小,鉻酸銀沉澱出現過遲,甚至不會沉澱;但若鹼度過高,又將出現氧化二銀沉澱。莫爾法測定的最適宜pH範圍是6.5~10.5。若溶液鹼性太強,可先用稀硝酸中和至甲基紅變橙,再滴加稀NaOH至橙色變黃;酸性太強,則用碳酸氫鈉,碳酸鈉或硼砂中和。
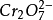
(2)不能在含有氨或其他能與銀離子生成絡合物的物質存在下滴定,否則會增大AgCl和鉻酸銀的溶解度,影響測定結果。若試液中有氨存在,應當先用硝酸中和。而在有銨根離子存在時,滴定的pH範圍應控制在6.5~7.2之間。
(3)莫爾法能測氯離子、溴離子但不能測定碘離子和硫氫根離子。因為AgI或AgSCN沉澱強烈吸附碘離子或硫氫根離子,使終點過早出現,且終點變化不明顯。滴定時必須劇烈搖動。
(4)莫爾法的選擇性較差,凡能與鉻酸根離子或銀離子生成沉澱的陽、陰離子均干擾滴定。
①能與Ag+生成沉澱的陰離子(PO43-、AsO43-、SO32-、S2-、CO32-、C2O42-)
②能與Cr2O72-生成沉澱的陽離子(Pb2+、Ba2+)
③在弱鹼性條件下易水解的離子(Al3+、Fe3+、Bi3+)
④大量的有色離子(Co2+、Cu2+、Ni2+)都可能幹擾測定,應預先分離。
硝酸銀溶液的配製
直接配製,更多的是採用標定的方法配製。若採用與測定相同的方法,用NaCl基準物標定,則可以消除方法的系統誤差。NaCl易吸潮,使用前要在500~600℃乾燥除去吸附水。常用的方法是將NaCl置於潔淨的瓷坩堝中,熱至不再有爆破聲為止。硝酸銀溶液見光易分解,應保存於棕色試劑瓶中。
主要套用範圍
本法多用於氯離子,溴離子的測定,而不能用於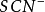 ,碘離子。這是因為
,碘離子。這是因為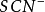 ,碘離子形成的銀鹽沉澱對於他們自身有著強烈的吸附作用,震搖也無法釋放。也不適用於用氯化鈉標準溶液直接滴定銀離子,因為在銀離子的試液里滴加重鉻酸鉀指示劑會立刻沉澱,轉化為氯化銀的速度極慢,重點推遲。因此,使用Mohr 法滴定銀離子時必須採用返滴定法。
,碘離子形成的銀鹽沉澱對於他們自身有著強烈的吸附作用,震搖也無法釋放。也不適用於用氯化鈉標準溶液直接滴定銀離子,因為在銀離子的試液里滴加重鉻酸鉀指示劑會立刻沉澱,轉化為氯化銀的速度極慢,重點推遲。因此,使用Mohr 法滴定銀離子時必須採用返滴定法。