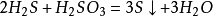研究歷史 硫的英文名為sulfur,源自拉丁文的“surphur”,傳說是來自印度的
梵文 “sulvere”,原義是鮮黃色。指示硫的英文詞頭為“thio-”起源於希臘語中的“theion”(即硫磺)。硫在遠古時代就被人們所知曉。大約在4000年前,
埃及人 已經會用硫燃燒所生成的
二氧化硫 來漂白布匹,
古希臘 和
古羅馬人 也能熟練地使用二氧化硫來熏蒸消毒和
漂白 。公元前九世紀,
古羅馬 著名詩人
荷馬 在他的著作里講述了硫燃燒時有消毒和漂白的作用。
升華硫 硫在古代中國被列為重要的藥材,在中國古代第一部藥物學專著《
神農本草經 》中所記載的46種礦物藥品中,就有
石硫黃 (即硫磺)。在這部著作里還指出:“石硫黃能化金銀銅鐵,奇物”。這說明當時已經知曉硫能與
銅 、
鐵 等金屬直接作用而生成金屬硫化物。世界現存最古的煉丹著作——魏伯陽的《
周易參同契 》,也記述了硫能和易揮發的汞化合成不易揮發的
硫化汞 。在東晉煉丹家
葛洪 的《
抱朴子內篇 》中也有“丹砂燒之成水銀,積變又還成丹砂”的記載。中國對
火藥 的研究,大概始於公元七世紀。當時的火藥是
黑火藥 ,它是由
硝酸鉀 、
硫黃 和
木炭 三者組成。火藥的製造促進了硫磺的提取和精製技術的發展,《太清石壁記》有用升華法精製硫磺的記載。明朝末年
宋應星 的《
天工開物 》一書中對從黃鐵礦石和含煤黃鐵礦石製取硫磺的操作方法作了詳細的敘述。
隨著1746年英國J.Roebuck發明了
鉛室法 製造
硫酸 和1777年硫被法國 A.L.Lavoisier確認為一種元素後,硫便進入了近代化學的大門。在此之後的年代,硫就迅速成為與近代化學工業和現代化學工業密切相關的最重要的元素之一。
古籍解釋 康熙字典
《廣韻》《集韻》𠀤力求切,音留。石硫黃,藥名。《正字通》淮南子,夏至硫黃澤,蓋陽入地,遇隂而成者,舶硫似蜜,黃中有金紅處,擊開如水晶有光,今靑硫不佳。本作流,因其似石,故唐韻從石。亦作畱。俗又作磂。磂字從畱。
含量及其分布 硫在自然界中分布較廣,在地殼中含量為0.048%(按質量計)。在自然界中硫的存在形式有
游離態 和
化合態 。
單質 硫主要存在於火山周圍的地域中。以化合態存在的硫多為礦物,可分為
硫化物 礦和
硫酸鹽 礦。硫化物礦有
黃鐵礦 (FeS
2 )、
黃銅礦 (CuFeS
2 )、
方鉛礦 (PbS)、
閃鋅礦 (ZnS)等。硫酸鹽礦有
石膏 (CaSO
4 ·2H
2 O)、
芒硝 (Na
2 SO
4 ·10H
2 O)、
重晶石 (BaSO
4 )、
天青石 (SrSO
4 )、
礬石 [(AlO)
2 SO
4 ·9H
2 O]、
明礬石 [K
2 SO
4 ·Al
2 (SO
4 )
3 ·24H
2 O]等。在
煤炭 中通常也含有少量的硫。
理化性質
物理性質 核素和原子(離子)結構
硫有25種
同位素 ,其中四種是穩定的:
32 S(95.02%)、
33 S(0.75%)、
34 S(4.21%)和
36 S(0.02%),除
35 S外,其它放射性同位素的
半衰期 都很短。
硫-35 由
宇宙射線 射擊空氣中的
氬 -40而導致,其半衰期為87.48天。
在
森林生態系統 中,硫酸鹽主要來自空氣,少量來自礦物的風化。其中硫的同位素的不同含量可用來確定它們的來歷。
離子半徑 :184pm(S
2- ),29pm(S
4+ );
基態原子電子排布式為:1s
2 2s
2 2p
6 3s2 3p4 。(加粗部分為
價電子 )
分子種類
不同分子種類的硫單質包括S
2 (二聚硫),S
3 (
三聚硫 ),S
4 (四聚硫),S
5 (五聚硫),S
6 (環六硫),S
7 (環七硫),
S8 (環八硫),S
9 (環九硫),S
10 (環十硫),S
11 (環十一硫),S
12 (環十二硫),S
18 (環十八硫),S
20 (環二十硫)和硫鏈等。
色、態
純硫是淺黃色固體,質地柔軟、輕,粉末有臭味。
溶解性
導熱性和導電性都差。性鬆脆,不溶於水。無定形硫主要有彈性硫,是由熔態硫迅速傾倒在冰水中所得。不穩定,可轉變為晶狀硫。晶狀硫能溶於有機溶劑如二硫化碳(而彈性硫只能部分溶解)、
四氯化碳 、甲苯和
苯 。除0價外常見化合價有3種,為-2(硫化氫)、+4(亞硫酸鈉)和+6(硫酸)價;而+2價(
甲醛次硫酸氫鈉 )則並不常見。第一電離能10.360電子伏特。結晶形硫不溶於水,稍溶於
乙醇 和
乙醚 ,溶於二硫化碳、四氯化碳、甲苯和苯。可轉變為晶狀硫(
正交硫 ),正交硫是室溫下唯一穩定的硫的存在形式。原子半徑:88pm。
晶體
以S
8 環在空間的不同排列順序,可以形成幾種硫的單質晶體,其中最常見的是
斜方硫 和
單斜硫 。
斜方硫也稱作菱形硫或是α-硫,它是室溫下唯一的穩定的硫的存在形式。加熱到95.5℃時轉變為單斜硫(此時並未融化)。單斜硫又稱作β-硫,在低於95.5℃時單斜硫會緩慢轉化為穩定的斜方硫。單斜硫和斜方硫均能溶於二硫化碳(
CS2 ),苯(
C6 H6 )等非極性溶劑。
晶胞參數 a = 1043.7 pm
b = 1284.5 pm
c = 2436.9 pm
α = 90°
β = 90°
γ = 90°
粘度
固體硫磺的分子一般為S
8 ,其結構呈馬鞍型,當硫磺受熱時,分子結構發生變化。當加熱到160℃時,S
8 的環狀開始破裂為開鏈,粘度升高,到190℃時粘度最大。繼續加熱到190℃以上時,長鏈開始發生斷裂,粘度又重新下降。在130~160℃時,液硫的粘度最小,流動性最好。硫在各溫度下的粘度見圖。
硫的粘度變化(變數:溫度(℃)) 化學性質 原子性質
親和能 (kJ·mol
-1 ):A
1 :-200,A
2 :590;
電離能(KJ/mol) 第一電離能:999.6
第六電離能:8495
第二電離能:2251
第七電離能:27106
第三電離能:3361
第八電離能:31669
第四電離能:4564
第九電離能:36578
第五電離能:7013
第十電離能:43138
硫在所有的物態中(固態、液態和氣態),硫都有不同的同素異形體,這些同素異形體的相互關係還沒有被完全理解。晶體的硫一般組成一個由八個原子組成的環:S
8 ,也存在不穩定的環狀S
6 分子作為結構單元的硫單質。單質硫的分子以環狀S
8 最為穩定,這種環狀分子中,每個硫原子採取sp
3 不等性雜化,與另外兩個硫原子之間以單鍵相連,
鍵長 是206pm,內鍵角108°,兩個面之間的夾角是98°。無論種類,硫單質常簡寫為S。
常見反應
硫可與變價金屬反應生成低價態金屬硫化物,例如:硫粉與鐵粉(
);硫粉與銅粉(
)。
注意:硫和
汞 常溫下即可反應:
,故可用硫處理泄露的汞;
硫可與
強氧化性酸 反應,如:
(
concentrated 意為濃的)。
化合價及對應化合物
硫在自然界中的常見化合價有-2、0、+4、+6價。
-2價的有H
2 S、Na
2 S以及其他硫化物,0價的硫是硫
單質 ,+4價的SO
2 、H
2 SO
3 、
亞硫酸鹽 (Na
2 SO
3 等),+6價的有SO
3 、H
2 SO
4 、
硫酸鹽 (Na
2 SO
4 等)。
化學鍵能:(kJ/mol) S-H 347
S-C 272
S=C 476
S-O 265
S=O 525
S-F 328
S-S 226
S-Cl 255
危險性
工業硫磺為易燃固體。此外,空氣中含有一定濃度硫磺粉塵時不僅遇火會發生爆炸,而且硫磺粉塵也很易帶靜電產生火花導致爆炸(硫磺粉塵爆炸下限為2.3g/m3) ,繼而燃燒引發火災。按固體火災危險性分類硫磺屬於乙類,硫磺回收和成型裝置屬於火災危險性乙類裝置。人體吸入硫磺粉塵後還會引起咳嗽、喉痛等。
⑴燃燒爆炸 :
①正常情況下燃燒緩慢,與氧化劑混合時燃燒速度劇增;
②與氧化劑混合可形成爆炸性混合物;
③遇明火、高溫易發生火災;
④粉塵易帶高達數千伏乃至上萬伏靜電;
⑤摩擦產生的高溫和明火等均可導致硫磺粉塵爆炸和火災;
⑥一般情況下硫磺粉塵比易燃氣體更易發生爆炸,但燃燒速度和爆炸壓力比易燃氣體小。
⑵對人體危害 :
①因其可在腸內部分轉化為
硫化氫 而被人體吸收,故大量吞入(10g以上)可導致硫化氫中毒;
③長期吸入硫磺粉塵一般無明顯毒性:
接觸限值:中國MAC、美國TWA和STEL均未制定標準
毒理資料:低毒性。
含硫化合物
二氧化硫 二氧化硫通常由硫單質或含硫化合物被氧化而成,如
(其中fire 指點燃,concentrated
有時這個反應生成硫單質:
1、漂白性:
二氧化硫有漂白性,但只能漂白
品紅 等極少數物質,漂白原理是與有機色素化合生成無色物質,且漂白有暫時性,因為化合物會分解。
2、還原性:
⑴二氧化硫可被大部分氧化劑(包括氧氣)氧化:
⑵二氧化硫使高錳酸鉀溶液變無色不是漂白 。
⑶二氧化硫具有
還原性 ,氯氣具有
氧化性 ,二者按體積比1:1同時通入品紅溶液,則溶液不褪色。因為二者恰好完全反應。
3、弱氧化性:
以上內容來自:
硫酸 1、難
揮發性 :由於硫酸沸點較高,相比其他的酸較難揮發,故常利用這一性質用濃硫酸制其他
強酸 (通常是
氯化氫 ):
2、
吸水性 :由於硫酸很容易與水結合成H
2 SO
4 ·xH
2 O,故可以吸收水分子或結晶水合物中的H
2 O:
(或寫成
)
3、
脫水性 :濃硫酸可以把有機物或弱酸中的
氫 和
氧 按照2:1的比例脫去並組合成
水 (分解有機物時通常同時
加熱 ),如:
;
(這類反應有副反應:
)
4、強
氧化性 :+6價的硫可以氧化很多
還原劑 (包括不能與
稀硫酸 反應的
銅 ):
;但由於二氧化硫在濃硫酸介質中還原性遠比水中弱,故
濃硫酸 不與
二氧化硫 反應,但由於二氧化硫易溶於濃硫酸,故仍不能用濃硫酸乾燥二氧化硫。當冷的濃硫酸遇到鐵、鋁等金屬時,反而不會反應,因為這些金屬會
鈍化 ,故可用鐵制或鋁製容器裝運濃硫酸。
硫酸鈣
製取方法 往
氫硫酸 中加入
亞硫酸 (或通入二氧化硫),可以製取硫。化學方程式:
作用用途
工業需求 硫在工業中很重要,比如作為電池中或溶液中的硫酸。硫被用來製造火藥。在橡膠工業中做
硫化劑 。硫還被用來殺真菌,用做化肥。硫化物在
造紙業 中用來漂白。硫酸鹽在
煙火 中也有用途。硫代硫酸鈉和硫代
硫酸氨 在照相中做定影劑、肥料。
硫礦物最主要的用途是生產硫酸和
硫磺 。硫酸是耗硫大戶,中國約有70%以上的硫用於硫酸生產。化肥是消費硫酸的最大戶,消費量占硫酸總量的70%以上,尤其是
磷肥 耗硫酸最多,增幅也最大。硫酸除用於化學肥料外,還用於製作
苯酚 、
硫酸鉀 等90多種化工產品;輕工系統的腳踏車、皮革行業;紡織系統的粘膠、纖維、維尼綸等產品;冶金系統的
鋼材酸洗 、
氟鹽 生產部門;石油系統的
原油 加工、石油催化劑、添加劑以及醫藥工業等都離不開硫酸。
高品位硫鐵礦燒渣可以回收鐵等;低品位的燒渣可作
水泥 配料。燒渣還可以回收少量的銀、金、銅、
鋁 、鋅和鈷等。硫磺除為生產硫酸的原料之外,還廣泛用來生產化工產品,如硫化銅、
焦亞硫酸鈉 等。另外,在食糖生產中,要把硫磺氧化為二氧化硫氣體用於漂白脫色。在農藥生產中也直接或間接使用硫磺;粘膠纖維生產中需用二
硫化 碳作溶劑;硫化金屬礦
浮選 用的藥劑要以二硫化碳為原料;除以上套用外,消費硫磺的行業還有火柴製造、水泥枕軌處理、醫藥等。
硫被用來製造黑色
火藥 、
火柴 等。硫也是生產
橡膠製品 的重要原料。硫還被用來殺真菌,用做
化肥 。硫化物在造紙業中用來漂白。
硫代硫酸 鈉和硫代硫酸氨在照相中做定影劑。硫又是製造某些農藥(如石灰
硫黃 合劑)的原料。
生理作用 半胱氨酸、
蛋氨酸 、同型半胱氨酸和牛磺酸等
胺基酸 和一些常見的酶含硫,因此硫是所有細胞中必不可少的一種元素。在蛋白質中,
多肽 之間的
二硫鍵 是蛋白質構造中的重要組成部分。有些細菌在一些類似光合作用的過程中使用硫化氫作為電子提供物(一般植物使用水來做這個作用)。植物以硫酸鹽的形式吸收硫。無機的硫是
鐵硫蛋白 的一個組成部分。在
細胞色素氧化酶 中,硫是一個關鍵的組成部分。
醫療上,硫還可用來制硫磺軟膏醫治某些皮膚病,但硫對身體危害較大長期在高含硫的工礦下工作對身體有極大損害。
日常生活中,水銀溫度計破裂,可用硫磺灑在散落的汞珠旁,生成穩定化合物(
),防止汞蒸發危害。
防禦措施 根據國家標準《工業硫磺》(GB 2449—2006)規定,有關工業硫磺安全等防護事項如下。
從事工業硫磺生產、運輸、儲存及加工的工作人員,操作時應使用必要的防護用品。
嚴格遵守國家有關消防、危險品的安全條例。工業硫磺堆放場所和倉庫應設定專門滅火器材,嚴禁明火。允許以噴水等方法熄滅燒著的硫磺。
由於硫磺粉塵易爆,使用和運輸工業硫磺時應防止生成或泄出硫磺粉塵。液體硫磺的生產、儲運以及使用遵照相關安全規定執行。
工業硫磺的包裝容器上應有明顯、牢固的標誌,內容包括生產廠名、廠址、產品名稱、商標、等級、淨質量、批號、生產日期、《工業硫磺》標準編號和符合GB 190規定的“易燃固體”標誌。
固體產品可用塑膠編織袋或內襯塑膠薄膜袋包裝,也可散裝。其中,包裝塊狀硫磺可不用內襯塑膠薄膜袋,散裝產品應遮蓋,但粉狀硫磺不可散裝。液體硫磺應使用專門容器儲裝。
產品的運輸按國家有關規定行。
塊狀、粒狀硫磺可儲存於露天或倉庫內。粉狀、片狀硫磺儲存於有頂蓋的場所或倉庫內。
袋裝產品成垛堆放,堆垛間應留有不少於0.75m寬的通道。不許放置在上下水管道和取暖設備的近旁。
代表案例 硫磺倉庫爆炸事故
2008年1月13日,國內某公司的一個分公司硫磺倉庫發生爆炸,造成7人死亡、32人受傷。
① 事故經過 2008年1月13日2時45分,鐵路運輸裝卸承包單位的53名工人在該公司硫磺倉庫內開始從事火車硫磺卸車作業,即從火車卸下並拆開硫磺包裝袋,將硫磺分別倒入平行於鐵路、與地面平齊的34個料斗中,硫磺通過料斗落在地坑中輸送機皮帶上,用輸送機傳送皮帶將硫磺送入硫磺庫內作為該公司生產硫酸的原料。3時40分時地坑硫磺粉塵突然發生爆炸,爆炸衝擊波將料斗、硫磺庫的輕型屋頂、皮帶輸送機、斗式提升機等設備、設施毀壞,造成7人死亡、7人重傷、25人輕傷。
② 事故原因事故發生的主要原因,一是天氣乾燥,空氣濕度低,硫磺粉塵容易爆炸;二是作業時正值深夜,風速低,空氣流動性差,造成局部空間內(皮帶運輸機地坑)硫磺粉塵濃度增大,達到爆炸極限,由現場產生的點火能量引發爆炸。
硫磺成型系統爆炸事故
國內某廠有兩套硫磺回收裝置,共用一台成型結片機,生產能力7500t/a。成型系統包括成型結片機(二樓)、包裝間和成品庫(一樓),包裝間和成品庫混用。
2001年6月23日14時10分,一搬運工將無防火帽的外運貨車開進硫磺成品庫,引起成品庫內小範圍閃爆,幸無人員傷亡。
2003年1月19日10時30分,一電工在拆修成型結片機頂部引風線上的軸流風機時,產生的電火花造成引風線內硫磺粉塵爆炸,爆炸產生的衝擊波將現場一名作業人員推出1.5m遠,所幸有護欄保護,未有傷亡.
 升華硫
升華硫 硫的粘度變化(變數:溫度(℃))
硫的粘度變化(變數:溫度(℃))