基本介紹
- 中文名:二氧化硫
- 英文名:sulfur dioxide
- 化學式:SO2
- 分子量:64.0638
- CAS登錄號:7446-09-5
- EINECS登錄號:231-195-2
- 熔點:-75.5 ℃
- 沸點:-10 ℃
- 水溶性:易溶於水
- 密度:2.9275kg/Nm3
- 外觀:無色氣體
- 閃點:無
- 套用:化學
- 危險性符號:有毒性
- 危險性描述:不燃。若遇高熱,容器內壓增大,有開裂和爆炸的危險
- 管制類型:管制
- 環境危害:對大氣可造成嚴重污染
- 毒性:有毒
- 電解性:屬於非電解質
- 顏色:無色
理化性質,使用限量,套用領域,風險解析,相關術語,接觸控制,注意事項,運輸信息,法律法規,危害防範,檢測方法,常見謠言,
理化性質
物理性質
液態二氧化硫比較穩定,不活潑。氣態二氧化硫加熱到2000℃不分解。不燃燒,與空氣也不組成爆炸性混合物。
無機化合物如溴、三氯化硼、二硫化碳、三氯化磷、磷醯氯、氯化碘以及各種亞硫醯氯化物都可以任何比例與液態二氧化硫混合。鹼金屬鹵化物在液態二氧化硫中的溶解度按I->Br->Cl-的次序減小。金屬氧化物、硫化物、硫酸鹽等多數不溶於液態二氧化硫。
二氧化硫是一個彎曲的分子,其對稱點群為C2v。硫原子的氧化態為+4,形式電荷為0,被5個電子對包圍著,因此可以描述為超價分子。從分子軌道理論的觀點來看,可以認為這些價電子大部分都參與形成S-O鍵。二氧化硫中的S-O鍵長(143.1 pm)要比一氧化硫中的S-O鍵長(148.1 pm)短,而 中的O-O鍵長(127.8 pm)則比氧氣
中的O-O鍵長(127.8 pm)則比氧氣 中的O-O鍵長(120.7 pm)長。二氧化硫的平均鍵能(548 kJ·mol-1)要大於S-O的平均鍵能(524 kJ·mol-1),而
中的O-O鍵長(120.7 pm)長。二氧化硫的平均鍵能(548 kJ·mol-1)要大於S-O的平均鍵能(524 kJ·mol-1),而 的平均鍵能(297 kJ·mol-1)則小於O2的平均鍵能(490 kJ·mol-1)。這些證據使化學家得出結論:二氧化硫中的S-O鍵的鍵級至少為2,與臭氧中的O-O鍵不同,臭氧中的O-O鍵的鍵級為1.5。
的平均鍵能(297 kJ·mol-1)則小於O2的平均鍵能(490 kJ·mol-1)。這些證據使化學家得出結論:二氧化硫中的S-O鍵的鍵級至少為2,與臭氧中的O-O鍵不同,臭氧中的O-O鍵的鍵級為1.5。



分子結構與極性:V形分子,極性分子。
pH:2/3的二氧化硫溶於水生成亞硫酸(H2SO3),溶液的pH值變成2或3。
25℃時二氧化硫在空氣中的擴散係數:1.15*e-5(m2/s)。
40 ℃:6.5 | |
0℃:22 | 50℃:5.0 |
10℃:15 | 60℃:4.0 |
20℃:11 | 70 ℃:3.5 |
25 ℃:9.4 | 80 ℃:3.4 |
30℃:8 | 90 ℃:3.5 |
100℃:3.7 |
化學性質
二氧化硫化學性質極其複雜,不同的溫度可作為非質子溶劑、路易氏酸、還原劑、氧化劑、氧化還原試劑等各種作用。液態二氧化硫還可作自由基接受體。如在偶氮二異丁腈自由基引發劑存在下與乙烯化合物反應得到聚碸。液態二氧化硫在光照下,可與氯和烷烴進行氯磺化反應,在氧存在下生成磺酸。液態二氧化硫在低溫表現出還原作用,但在300℃以上表現出氧化作用。
二氧化硫可以使品紅溶液褪色,加熱後顏色還原,因為二氧化硫的漂白原理是二氧化硫與被漂白物反應生成無色的不穩定的化合物,破壞了起到品紅中起發色作用的對醌式,加熱時,該化合物分解,恢復原來顏色,所以二氧化硫的漂白又叫暫時性漂白。
能使酸性高錳酸鉀溶液褪色。
二氧化硫可以在硫磺燃燒的條件下生成: 二氧化硫漂白品紅溶液
二氧化硫漂白品紅溶液
 二氧化硫漂白品紅溶液
二氧化硫漂白品紅溶液S(s) + (g) =點燃=
(g) =點燃= (g)
(g)


硫化氫可以燃燒生成二氧化硫:
2 (g) + 3
(g) + 3 (g) ==點燃= 2
(g) ==點燃= 2 (g) + 2
(g) + 2 (g)
(g)




4FeS2(s) + 11O2(g) === 2Fe2O3(s) + 8SO2(g)
2ZnS(s) + 3O2(g) === 2ZnO(s) + 2SO2(g)
HgS(s) + O2(g) === Hg(l) + SO2(g)
二氧化硫具有漂白性。工業上常用二氧化硫來漂白紙漿、毛、絲、草帽等。二氧化硫的漂白作用是由於它(亞硫酸)能與某些有色物質生成不穩定的無色物質。這種無色物質容易分解而使有色物質恢復原來的顏色,因此用二氧化硫漂白過的草帽辮日久又變成黃色。二氧化硫和某些含硫化合物的漂白作用也被一些不法廠商非法用來加工食品,以使食品增白等。食用這類食品,對人體的肝、腎臟等有嚴重損傷,並有致癌作用。
此外二氧化硫還能夠抑制黴菌和細菌的滋生,可以用作食物和乾果的防腐劑。但必須嚴格按照國家有關範圍和標準使用。
化學方程式
SO2+H2O=(可逆)=H2SO3(亞硫酸) 實驗步驟
實驗步驟
 實驗步驟
實驗步驟SO2可以自偶電離:2SO2===(可逆)===SO2++SO32-
2SO2+O2 === 2SO3(加熱,五氧化二釩做催化劑,可逆;在自然中,也可由空氣中塵埃催化)
2H2S+SO2 === 3S↓+2H2O(歸中反應)
SO2+Cl2+2H2O === 2HCl+H2SO4
SO2+2NaOH === Na2SO3+H2O(SO2少量)
SO2+NaOH === NaHSO3(SO2過量)
Na2SO3+SO2+H2O === 2NaHSO3
CaO+SO2====CaSO3 ,2CaSO3+O2====2CaSO4(加熱)
SO2+2FeCl3+2H2O===2FeCl2+H2SO4+2HCl
SO2+H2O2===H2SO4
SO2+Na2O===Na2SO3
5SO2+2KMnO4+2H2O===2MnSO4+K2SO4+2H2SO4
3SO2+2NaNO3+2H2O===Na2SO4+2NO↑+2H2SO4
使用限量
GB 2760-96:可用於葡萄酒、果酒作為防腐劑,0.25g/kg。二氧化硫殘留量不得超過0.05g/kg。
以熏硫法漂白果乾、果脯、乾菜、冬粉、蜜餞類允許殘留量參照“硫黃”。熏硫就是燃燒硫黃產生二氧化硫,可使果片表面細胞破壞,促進乾燥,同時由於其還原作用,可破壞酶的氧化系統,阻止氧化作用。使果實中的單寧物質不致被氧化而變成棕褐色。尚可保存果實中的維生素C。熏硫室中二氧化硫濃度一般為1%~2%,最高可達3%。熏硫時間30~50min,最長可達3h。
以熏硫法漂白果乾、果脯、乾菜、冬粉、蜜餞類允許殘留量參照“硫黃”。熏硫就是燃燒硫黃產生二氧化硫,可使果片表面細胞破壞,促進乾燥,同時由於其還原作用,可破壞酶的氧化系統,阻止氧化作用。使果實中的單寧物質不致被氧化而變成棕褐色。尚可保存果實中的維生素C。熏硫室中二氧化硫濃度一般為1%~2%,最高可達3%。熏硫時間30~50min,最長可達3h。
FAO/WHO(1984;mg/kg):白砂糖20(規格A)、70(規格B);糖粉、果糖、葡萄糖粉20(帶入量);綿白糖40;無水葡萄糖、一水葡萄糖20;葡萄糖漿40;用於製造糖果時400;高濃度葡萄糖漿40,用於製造糖果時150;漂白葡萄乾1500;果醬、果凍、橘皮果凍100,帶入量;杏乾2000;酸黃瓜50,由初製品帶入;帶防腐劑的鳳梨濃汁500(僅用於製造)。
EEC(1990;mg/k):椰子乾50;啤酒70;蜜餞和罐裝花椰素100;蘋果汁200;大部分果乾2000;千番木瓜酶和木瓜蛋白酶30000。
EEC-HACSG建議不能用於兒童食品。
FDA,182.3862(2000):不得用於肉類及維生素B。源食品。
按日本規定的最高用量參照“連二亞硫酸鈉”。
按日本規定的最高用量參照“連二亞硫酸鈉”。
套用領域
風險解析
食品藥品監管部門抽檢發現部分蔬菜、水果製品、白砂糖等二氧化硫含量超標。那么,二氧化硫究竟是什麼?如何套用於食品工業中?對人體健康是否有危害?是否可以套用於果蔬製品、白砂糖及相關製品中?國內外對此有哪些相關的法規標準?日前,國家食品藥品監督管理總局發布2016年第14期《食品安全風險解析》,組織有關專家解讀。
一、二氧化硫是國內外允許使用的一種食品添加劑,在食品工業中發揮著護色、防腐、漂白和抗氧化的作用
二氧化硫是國內外允許使用的一種食品添加劑,通常情況下該物質以焦亞硫酸鉀、焦亞硫酸鈉、亞硫酸鈉、亞硫酸氫鈉、低亞硫酸鈉等亞硫酸鹽的形式添加於食品中,或採用硫磺熏蒸的方式用於食品處理,發揮護色、防腐、漂白和抗氧化的作用。比如在水果、蔬菜乾制,蜜餞、涼果生產,白砂糖加工及鮮食用菌和藻類在貯藏和加工過程中可以防止氧化褐變或微生物污染。利用二氧化硫氣體熏蒸果蔬原料,可抑制原料中氧化酶的活性,使製品色澤明亮美觀。在白砂糖加工中,二氧化硫能與有色物質結合達到漂白的效果。
二、按照標準規定合理使用二氧化硫不會對人體健康造成危害,但長期超限量接觸二氧化硫可能導致人類呼吸系統疾病及多組織損傷
每一個食品添加劑在列入標準之前,均需經過嚴格的風險評估。只要通過風險評估,獲得批准並按照標準規定和相應質量規格要求規範使用就是安全的。《食品安全國家標準 食品添加劑使用標準》(GB2760-2014)中允許使用的食品添加劑都是經過安全評估的,在符合標準情況下使用的二氧化硫,不會給消費者的健康帶來損害。
以食糖加工為例,食糖中的二氧化硫殘留主要是由於製糖過程中使用硫磺作為加工助劑產生的二氧化硫用於澄清和脫色,製糖原料及其他加工助劑可能含硫也是導致食糖中存在二氧化硫殘留的原因之一。少量二氧化硫進入體內後最終生成硫酸鹽,可通過正常解毒後由尿液排出體外,不會產生毒性作用。但如果人體過量攝入二氧化硫,則容易產生過敏,可能會引發呼吸困難、腹瀉、嘔吐等症狀,對腦及其它組織也可能產生不同程度損傷。
三、國際多個國家和地區二氧化硫的使用限量及殘留量均有明確規定
國際上多個國家和地區對二氧化硫的使用均有明確的規定。國際食品法典委員會(CAC)、歐盟、美國、澳大利亞紐西蘭、加拿大等國際組織、國家和地區的法規和標準中均允許二氧化硫用於相應食品類別。聯合國糧農組織/世界衛生組織食品添加劑聯合專家委員會(JECFA)對二氧化硫進行了安全性評估,並制定了每日允許攝入量(ADI)為0-0.7mg/kg bw。國際食品法典(CODEX STAN 212-1999)對食糖中的二氧化硫也做了限量要求,白砂糖中二氧化硫殘留量應≤15 mg/kg。
四、我國相關標準和法規明確了可以使用二氧化硫的食品類別及相應的使用限量和殘留量
我國《食品安全國家標準 食品添加劑使用標準》(GB2760-2014)明確規定了二氧化硫作為漂白劑、防腐劑、抗氧化劑用於經表面處理的鮮水果、水果乾類、蜜餞涼果、乾制蔬菜、醃漬的蔬菜、蔬菜罐頭(僅限竹筍、酸菜)、乾制的食用菌和藻類、食用菌和藻類罐頭(僅限蘑菇罐頭)、腐竹類(包括腐竹、油皮等)、堅果與籽類罐頭、可可製品、朱古力和朱古力製品(包括代可可脂朱古力及製品)以及糖果、生濕麵製品(如麵條、餃子皮、餛飩皮、燒麥皮)(僅限拉麵)、食用澱粉、冷凍米麵製品(僅限風味派)、餅乾、食糖、澱粉糖(果糖,葡萄糖、飴糖、部分轉化糖等)、調味糖漿、半固體複合調味料、果蔬(漿)、果蔬汁(漿)類飲料、甜型葡萄酒及果酒、啤酒和麥芽飲料。
同時,為了保證其安全使用,參考聯合國糧農組織/世界衛生組織食品添加劑聯合專家委員會(JECFA),我國原衛生部2011年第6號公告指定了食品添加劑二氧化硫的質量規格要求。另外,按照《食品安全國家標準 預包裝食品標識通則》(GB7718)的規定,只要在食品中使用了二氧化硫就必須在食品標籤上進行標識。
因此,專家建議:一是食品生產企業要嚴格遵守相關標準法規。相關食品生產企業應嚴格遵守GB2760的要求,在達到預期效果的前提下儘可能降低二氧化硫在食品中的使用量,不可超範圍、超限量使用,更不可違規添加。積極通過革新工藝,採用新技術,從技術、工藝上控制褐變、有害微生物的污染和繁殖,減少含硫食品添加劑的使用量。如果在食品中添加了二氧化硫,生產企業應按照GB7718的規定進行規範標識。二是監管部門需進一步加強對食品添加劑使用的監管。建議相關監管部門進一步加強對食品添加劑使用標準等相關規定的宣傳力度,同時加大監管力度,對於超限量、超範圍使用二氧化硫的企業應給予嚴厲處罰。三是消費者應樹立正確的消費觀,認真研讀食品標籤。消費者要以正確心態選購食品,避免過度追求食品的外觀,如色澤過分鮮亮的黃花菜、雪白的銀耳等。此外,食品標籤體現了該食品的名稱、配料、食品添加劑等信息,按照GB7718的規定,生產企業如果在食品中添加了二氧化硫就應該在食品標籤上標識。消費者在選擇食品之前,可以通過研讀食品標籤辨認該食品中是否添加了二氧化硫。
相關術語
風險術語
R23:Toxic by inhalation. 吸入有毒。
R34:Causes burns. 引起灼傷。
安全術語
S9:Keep container in a well-ventilated place. 保持容器置於良好通風處。
S26:In case of contact with eyes, rinse immediately with plenty of water and seek medical advice.不慎與眼睛接觸後,請立即用大量清水沖洗並徵求醫生意見。
S36/37/39:Wear suitable protective clothing, gloves and eye/face protection.穿戴適當的防護服、手套和護目鏡或面具。
S45:In case of accident or if you feel unwell, seek medical advice immediately (show the label whenever possible.) 若發生事故或感不適,立即就醫(可能的話,出示其標籤)。
接觸控制
監測方法:鹽酸副玫瑰苯胺比色法;甲醛緩衝液-鹽酸副玫瑰苯胺分光光度法 生成二氧化硫
生成二氧化硫
 生成二氧化硫
生成二氧化硫工程控制:嚴加密閉,提供充分的局部排風和全面通風。提供安全淋浴和洗眼設備。
呼吸系統防護:空氣中濃度超標時,佩戴自吸過濾式防毒面具(全面罩)。緊急事態搶救或撤離時,建議佩戴正壓自給式呼吸器。
眼睛防護:呼吸系統防護中已作防護。
身體防護:穿聚乙烯防毒服。
手防護:配戴橡膠手套。
其他防護:工作現場禁止吸菸、進食和飲水。工作完畢,淋浴更衣。保持良好的衛生習慣。
注意事項
危害健康
在大氣中,二氧化硫會氧化而成硫酸霧或硫酸鹽氣溶膠,是環境酸化的重要前驅物。大氣中二氧化硫濃度在0.5ppm以上對人體已有潛在影響;在1~3ppm時多數人開始感到刺激;在400~500ppm時人會出現潰瘍和肺水腫直至窒息死亡。二氧化硫與大氣中的煙塵有協同作用。當大氣中二氧化硫濃度為0.21ppm,煙塵濃度大於0.3mg/L,可使呼吸道疾病發病率增高,慢性病患者的病情迅速惡化。如倫敦煙霧事件、馬斯河谷事件和多諾拉等煙霧事件,都是這種協同作用造成的危害。 酸雨腐蝕後的森林
酸雨腐蝕後的森林
 酸雨腐蝕後的森林
酸雨腐蝕後的森林急救措施
皮膚接觸:立即脫去污染的衣著,用大量流動清水沖洗。就醫。
眼睛接觸:提起眼瞼,用流動清水或生理鹽水沖洗。就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
如發生中毒,應立即將患者移至有新鮮空氣的地方,解開緊身衣服,迅速吸氧,沖洗眼睛和鼻腔,用2%蘇打溶液漱口。如不慎濺人眼內,應速用大量溫水沖洗。嚴重者應速送醫院治療。
消防措施
危險特性:不燃。若遇高熱,容器內壓增大,有開裂和爆炸的危險。
有害燃燒產物:氧化硫。
滅火方法:該品不燃。消防人員必須佩戴過濾式防毒面具(全面罩)或隔離式呼吸器、穿全身防火防毒服,在上風向滅火。切斷氣源。噴水冷卻容器,可能的話將容器從火場移至空曠處。滅火劑:霧狀水、泡沫、二氧化碳。
泄漏處理
迅速撤離泄漏污染區人員至上風處,並立即進行隔離,小泄漏時隔離150m,大泄漏時隔離450m,嚴格限制出入。建議應急處理人員戴自給正壓式呼吸器,穿防毒服。從上風處進入現場。儘可能切斷泄漏源。用工業覆蓋層或吸附/ 吸收劑蓋住泄漏點附近的下水道等地方,防止氣體進入。合理通風,加速擴散。噴霧狀水稀釋、溶解。構築圍堤或挖坑收容產生的大量廢水。如有可能,用一捉捕器使氣體通過次氯酸鈉溶液。漏氣容器要妥善處理,修復、檢驗後再用。
操作處置
操作注意事項:嚴加密閉,提供充分的局部排風和全面通風。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴自吸過濾式防毒面具(全面罩),穿聚乙烯防毒服,戴橡膠手套。遠離易燃、可燃物。防止氣體泄漏到工作場所空氣中。避免與氧化劑、還原劑接觸。搬運時輕裝輕卸,防止鋼瓶及附屬檔案破損。配備泄漏應急處理設備。
儲存注意事項:儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不宜超過30℃。應與易(可)燃物、氧化劑、還原劑、食用化學品分開存放,切忌混儲。儲區應備有泄漏應急處理設備。
運輸信息
運輸注意事項:該品鐵路運輸時限使用耐壓液化氣企業自備罐車裝運,裝運前需報有關部門批准。鐵路運輸時應嚴格按照鐵道部《危險貨物運輸規則》中的危險貨物配裝表進行配裝。採用剛瓶運輸時必須戴好鋼瓶上的安全帽。鋼瓶一般平放,並應將瓶口朝同一方向,不可交叉;高度不得超過車輛的防護欄板,並用三角木墊卡牢,防止滾動。嚴禁與易燃物或可燃物、氧化劑、還原劑、食用化學品等混裝混運。夏季應早晚運輸,防止日光曝曬。公路運輸時要按規定路線行駛,禁止在居民區和人口稠密區停留。鐵路運輸時要禁止溜放。
法律法規
《化學危險物品安全管理條例》 (1987年2月17日國務院發布),《化學危險物品安全管理條例實施細則》 (化勞發[1992] 677號),《工作場所安全使用化學品規定》 ([1996]勞部發423號)等法規,針對化學危險品的安全使用、生產、儲存、運輸、裝卸等方面均作了相應規定;常用危險化學品的分類及標誌 (GB 13690-92)將該物質劃為第2.3 類有毒氣體;劇毒物品分級、分類與品名編號(GA 57-93)中,該物質的液化或壓縮品被劃為第一類 A級無機劇毒品。
危害防範
常規處理SO2 方法:在注意工人個人防護的同時,應採取有效措施處理SO2 煙氣。從五十年代開始,中國對有色冶煉煙氣中低濃度SO2 的回收利用開展了一系列的試驗研究工作,並取得了一定的進展。
亞銨法:採用亞銨法處理SO2 是用氨水吸收SO2,副產品亞銨。雖然亞銨法技術較成熟,但產生的副產品是液體狀態的亞銨,產品的貯存運輸都較困難,只適用於有氨源的小型冶煉廠。
亞硫酸鈉法:中小型的冶煉廠可採用亞硫酸鈉法進行煙氣脫硫。亞硫酸鈉法是利用燒鹼或純鹼吸收SO2,同時產生副產品亞硫酸鈉。例如,上海冶煉廠就採用此法處理煙氣。亞硫酸鈉法工藝簡單,操作方便,系統阻力小,投資和操作費用低。脫硫效率高達95 %左右。但需消耗純鹼和燒鹼,每噸無水亞硫酸鈉消耗純鹼0. 8 t,燒鹼0. 1 t。副產品亞硫酸鈉用途有限,因此不能普遍採用。
氧化鋅法:對於鉛鋅冶煉廠可採用氧化鋅法處理SO2。如湖南水口山礦務局第四冶煉廠就是採用此法。氧化鋅法是以氧化鋅為吸收劑,生成的亞硫酸鋅渣全部返回鋅精礦沸騰爐焙燒,分解出SO2 氣體可用於製取濃SO2。
V2O5 氧化法:有色金屬冶煉過程中產生的SO2 濃度一般低於315 %,不適合直接回收製造SO2。瀋陽冶煉廠為了實現SO2 的治理。對生產工藝進行了改革,採用密閉式鼓風爐,同時改造了排煙系統,嚴格控制爐口和煙道的負壓,降低了漏風率,從而提高了SO2 的濃度(4 %~5 %),達到了制酸的要求。利用V2O5 作催化劑,使SO2 氧化為SO3,利用稀硫酸吸收SO3,製造H2SO4,反應如下:
2SO2 + O2——SO3
SO3 + H2O——H2SO4
由於煙氣中含有As2O3,致使催化劑中毒,降低了SO2的轉化率。
活性炭吸咐法處理SO2:針對以上處理方法存在的問題,系統地研究了利用活性碳吸附法處理有色金屬冶煉過程中產生的SO2,克服了以上治理方法的缺點和局限性。
當含SO2 的廢氣與活性炭接觸時,SO2 即被吸附,當有O2 和水蒸汽存在時,伴隨著物理吸附同時發生化學吸附。
當活性炭上吸附了一定量的H2SO4 後,用水洗法再生活性炭,並得到副產品H2SO4。
SO2 轉化為SO3 是在活性炭的催化作用下完成的,傳統的活性炭吸附法只是利用了活性炭本身的催化劑性能,催化活性低,反應速度緩慢,設備龐大。而此種活性炭處理法是利用活性炭是催化劑載體的特性,在活性炭上載有某種活性成分,構成了更高活性的活性炭催化劑,使SO2 轉化為SO3 的反應速度大大加快,在此基礎又研究了影響活性炭吸附法處理SO2 的其它影響因素。
從實驗結果看, 在25 ℃時脫硫效果最好,100 ℃次之。雖然25 ℃脫硫效率最高,但脫硫後的煙氣溫度較低,煙氣的熱浮力降低,不利於煙氣擴散,煙氣易返回地面,造成附近地面污染。若採用100 ℃時脫硫,雖然脫硫效果不如25 ℃的好,但脫硫效率已經達到較高的數值,並且脫硫後,煙氣溫度較高,易於排煙,因此,應採用100 ℃溫度下脫硫。
影響脫硫效率的各種因素相互制約,當脫硫溫度取100 ℃時,H2O/ SO2 = 1~2,O2/ SO2 = 10~14,空速為3 600 h-1時,脫硫效率可達96%。
在有色金屬冶煉過程中產生的SOx,是對操作工人身體健康影響最大的有毒氣體,必須採取有效的防治措施,以保證工人的身體健康。用活性炭處理有色金屬冶煉過程中產生的SO2,具有脫硫效率高、工藝簡單、操作易控制、活性炭可再生重複利用、無二次污染等特點,克服了亞銨法,亞硫酸鈉法和氧化鋅法在套用上的局限性和缺點,也避免了用V2O5氧化法的催化劑中毒問題,是一種行之有效且套用前景廣泛的方法。
檢測方法
作為食品添加劑外源性添加
二氧化硫作為一種食品添加劑,被廣泛地用 於食品加工中,一些不法商販在利益的驅使下, 在食品中大量地添加二氧化硫及其鹽類是導致二 氧化硫超標的主要來源。
二氧化硫和亞硫酸鹽添加到食品中有以下用 途:在食品加工過程中,利用二氧化硫和亞硫酸 鹽類的氧化性,能有效地抑制食品加工過程中的 非酶褐變;利用其還原性和漂白性,也可作為防 腐劑,抑制黴菌和細菌的生長。所以在食品的生 產加工過程中,經常加入二氧化硫、亞硫酸鹽等, 使食品褪色和免於褐變,改善外觀品質,延長保 質期。常用的二氧化硫添加劑有亞硫酸鈉、亞硫 酸氫鈉、低亞硫酸鈉和焦亞硫酸鈉等。
例如一般 在水果、蔬菜等新鮮植物性食物中,亞硫酸鹽由 於可以抑制多酚氧化酶的活性,防止蘋果、馬鈴 薯、蘑菇等的褐變,因此乾制食品時常用於控制 果蔬的褐變。葡萄酒在發酵過程中有充二氧化硫 或用溶有二氧化硫的水來做防腐劑。啤酒生產過 程中為了保持風味穩定性,往往採取在灌裝前添 加二氧化硫作為抗氧化劑。 但是,二氧化硫及亞硫酸鹽易與食品中的糖、 蛋白質、色素、酶、維生素、醛、酮等發生作用, 並以游離型和結合型的二氧化硫殘留在食品中。
一旦這些添加劑使用過量,並且無後序的二氧化 硫清除技術,必然會導致二氧化硫殘留超標。這 不僅會破壞食品的品質,而且會嚴重影響消費者 的健康。
食品內源性生成
雖然二氧化硫及其鹽類的殘留超標主要是人 為過量添加導致,但食品自身產生的二氧化硫也 是不可忽視的另一重要來源。
研究發現,人為未添加任何亞硫酸鹽等添加 劑的情況下,某些食品在發酵過程中也會產生亞 硫酸鹽。葡萄酒和果酒類發酵過程自然產生的亞 硫酸鹽含量最高可達到 300 mg/kg,即使在一般情 況下也會達到 40 mg/kg,這一指標也遠遠超出了美國 FDA 規定的食品中亞硫酸鹽含量的安全範圍要 求。
另外,本實驗室在大量的研究基礎上發現香 菇在采後由於自身代謝也會產生二氧化硫,並且 嚴重地超出了許多國家規定的殘留標準,導致其 出口嚴重受阻。
另一方面,由於食品中有相當大的一部分是 植物體,在植物體的生長過程中,大氣中的二氧 化硫會通過植物體的葉面氣孔進入植物體內,其 他土壤或水中的結合態的二氧化硫也會通過植物 的吸收作用進入到植物體內。進入植物體的二氧 化硫,很容易和植物體內的醛酮類化合物特別是 糖類化合物等發生反應生成結合態的亞硫酸,所 以植物體內都有一定含量的游離態的和結合態的 二氧化硫。
動物在生長過程中,由於進食植物, 體內也會積累一定量的二氧化硫。所以動物食品 和植物食品都含有一定量的天然來源的二氧化硫。
食品中二氧化硫的限量標準
鑒於二氧化硫對人體的嚴重危害性,為避免 食品中二氧化硫殘留量超標而引起食用者中毒等 不良反應,各國都制定了一系列標準來嚴格控制 二氧化硫使用量和殘留量。
美國 FDA 要求亞硫酸 鹽使用量高於 10 mg/kg 的食品要予以標明,日本 對鹽漬蔬菜、澱粉等食品中二氧化硫限量為 30 mg/kg,德國對大蒜製品限量為 50 mg/kg。鑒於亞 硫酸鹽在啤酒中使用,許多國家對啤酒中的二氧 化硫殘留限量也作了規定。
我國 《發酵酒衛生標 準》(GB2758- 1981)規定了以游離 SO2 計的殘留 SO2 的限量。 我國《食品添加劑使用衛生標準》對二氧化硫 類物質在各類食品中的使用範圍、使用量及允許 最大殘留量做出了明確的規定。如硫磺只限於熏 蒸蜜餞、乾果、乾菜、冬粉和食糖;低亞硫酸鈉 可用於蜜餞、乾果、乾菜、冬粉、葡萄糖、食糖、 冰糖、飴糖、糖果、液體葡萄糖、竹筍、蘑菇及 蘑菇罐頭,最大使用量為 0.40 g/kg;二氧化硫可用 於葡萄酒、果酒等,最大使用量不應超過 0.25 g/kg,二氧化硫殘留量均不得超過 0.05 g/kg;對芝 麻、乳、豆類、蔬菜以及生食用鮮魚貝類則禁止 使用。
FAO 和 WHO 聯 合 食 品 添 加 劑 專 家 委 員 會 (JECFA)對二氧化硫類物質作為食品添加劑的危險 性評估為:二氧化硫的日容許攝入量(ADI)為 0~ 0.7 mg/kg 體重,即一個 60 kg 體重的成人,每天二氧化硫的攝入量不超過 42 mg。
食品中二氧化硫的檢測方法
由於食品基質的差異性,使二氧化硫檢測需 要不同的方法,且檢測原理也各不相同。目前, 套用於食品中二氧化硫檢測方法有比色法、滴定 法和色譜法等。
比色法
國標 GB/T5009.34- 2003 中規定用鹽酸副玫瑰 苯胺法檢測食品中二氧化硫含量,其主要原理是 利用亞硫酸鹽與四氯汞的反應生成穩定的絡合物, 再與甲醛及鹽酸副玫瑰苯胺作用生成紫紅色絡合 物,在波長 550 nm 處測定溶液吸光度,與標準系 列比較定量。
滴定法作為測定食品中微量二氧化硫的主要 方法,具有操作簡單、靈敏度高、再現性好的優 點,是實際檢測中最常用方法。但是該方法的線 性範圍窄,對於亞硫酸鹽含量高的樣品,需對樣 品稀釋後測定;其次,在該方法中使用了有毒試 劑四氯汞鈉,且用量大,易對環境造成汞的污染。
另外,對於某些本身有紅色或玫瑰紅色的樣品, 如葡萄酒等,則在 550 nm 測定波長產生干擾,並 且因偏差無任何規律可循,使干擾無法扣除。 為減少有毒試劑四氯汞鈉對環境的污染,消 除這一不足,往往採用其他毒性較低的物質代替 四氯汞鈉溶液作為二氧化硫的吸收液。用 甲醛溶液吸收 - 鹽酸副玫瑰苯胺分光光度法測定了 白砂糖中的二氧化硫。用 EDTA 二鈉緩衝 液代替四氯汞鈉吸收液對食品中的二氧化硫進行了 測定,結果與國標方法一致。
為了避免某些樣品自 身顏色很深,對 550 nm 處的測定波長產生干擾, 往往採用蒸餾法對樣品進行前處理。日本食品衛生 協會方法中“蒸餾 - 比色法”是將樣品酸化後在氮 氣流中加熱蒸餾,以氫氧化鈉溶液接收,接收液 與鹼性品紅和甲醛混合液進行顯色反應。
滴定法
滴定法常見的有直接滴定碘量法、蒸餾 - 碘 量法、蒸餾 - 鹼滴定法。
直接滴定法
直接滴定碘量法原理是樣品中 的被測成分(包括游離和化合二氧化硫)在鹼液中失 去結合力,被固定為亞硫酸鹽,在硫酸的作用下, 又使其游離出來,並用碘標準溶液進行滴定。當 達到滴定終點時,過量的碘與澱粉指示劑作用, 生成藍色的碘 - 澱粉複合物。由碘標準溶液的滴定量計算出總二氧化硫的含量。直接滴定碘量法 操作簡便、快速,特別適用於測定葡萄酒中的亞 硫酸鹽。但是對於脫水大蒜、姜製品等,由於含 有較多的揮發性芳香物質,往往導致滴定終點的 顏色不穩定,易褪色,不能保持 30 s 不消失,終 點難以判定。
蒸餾 - 碘量法 GB/T5009134- 1996(2)
採用 “蒸餾 - 碘量法”是對樣品酸化並加以蒸餾,樣品 中二氧化硫逸出,通過乙酸鉛溶液接收,並用濃 鹽酸酸化,以碘標準溶液滴定。採用蒸餾法對樣 品進行前處理,可以有效地避免樣品本底的干擾, 但是需要的時間較長,一般蒸餾一份樣品大約需 一個多小時,不適合大批量樣品檢測。
蒸餾 - 鹼滴定法
該方法利用酸鹼中和滴定 的原理,樣品酸化後在氮氣流中加熱蒸餾,以過 量氫氧化鈉接收,然後將接收液酸化並氧化為硫 酸,用標準氫氧化鈉溶液滴定即可測定樣品中亞 硫酸鹽總量。該方法屬於快速測定方法,廣泛用 於各類食品的檢測。日本食品衛生協會方法(A), IS05522(1981)和國際葡萄酒總局常規法均為此類。 其蒸餾時間短,溶液沸騰後蒸餾 10~15 min 即可 對接收液以鹼標準溶液滴定,終點易判斷。取樣 量可從 1 g 至 100 g 靈活掌握,檢測範圍寬,可以 避免樣品中因亞硫酸鹽分布不均所致結果重複性 差的現象。但該方法需要定製一套按規定尺寸的 全玻璃蒸餾裝置,容易損壞。操作中需用脫氣的 水,充入的氮氣也需是高純度的。對於有機酸含 量高的樣品,產生揮發性有機酸,測定時會產生 誤差。
色譜法
氣相色譜法
將食品中的游離亞硫酸和總亞 硫酸分別用酒石酸提取液提取後,取出一定量在 密封容器中使之成為酸性揮發亞硫酸,取頂空氣 體,注入附有火焰光度檢測器(FPD)的氣相色譜儀 中進行定量。王曉雲等[13]通過將膨化大棗中的結合 態二氧化硫在酸性條件下轉化為二氧化硫氣體, 取頂空氣體進行氣相色譜分析。通過測定氣相中 二氧化硫的含量,間接測定樣品中的二氧化硫含 量,實驗結果的相對標準偏差為 1.65%。
本方法具 有操作簡便、快速、準確、靈敏度高等優點。
離子色譜法
離子色譜法具有操作簡單、靈 敏,是分析食品中二氧化硫的研究熱點。其原理 是:試樣中的亞硫酸在 20%磷酸酸性條件下,於 90 ℃水浴中通氮氣分離,收集在三乙醇胺溶液中,用 IC(離子色譜)法測定。離子色譜法適用於食品中 殘留亞硫酸鹽和天然亞硫酸鹽的測定。 其包括 ICE- 脈衝安培檢測法、ICE- 單電位 或脈衝安培檢測法、ICE- 間接紫外光度檢測法和 離子交換 - 紫外檢測法等。但食品樣品成分複雜, 含較多的蛋白質、油脂、色素、纖維素等有機大 分子,這些組份與分離柱的填料發生作用,影響 柱子的性能和壽命。
部分亞硫酸鹽在食品中以結 合狀態存在,如直接測定,樣品處理過程中樣品 溶液放置時間對測定結果影響較大。但是在酸性 條件下蒸餾樣品可以避免該誤差的出現。
其他檢測方法
化學發光法
化學發光法因化學發光法靈敏 度高、操作簡便,受到了重視。二氧化硫的化學 發光分析早有報導。有人提出了 SO3 2- 化學發光反 應機制,在酸性介質中,某些氧化劑可氧化 SO3 2- 產生髮光,當某些化合物存在時可使化學發光增 強。因此,人們便將化學發光法用於測定亞硫酸 鹽。Balasubramanian 等報導了一種簡便、靈 敏的萃取光度法,即用甲醛溶液固定二氧化硫, 在 pH4.76 乙酸鹽介質中,二氧化硫與碘酸鹽反應 生成 I2,I2 與過量 Cl- 形成穩定的 ICl- 後,與 2,7- 二氯螢光素反應,生成易被有機溶劑萃取的碘代 二氯螢光素。
電化學法及感測器
將塗有石墨 / 環氧樹脂 / 固化劑的銅或金電極浸泡在飽和 4- 甲基哌啶二硫 代氨基甲酸鉀水溶液和飽和硝酸汞水溶液中各 1 h。然後用此電極來測定 SO3 2-,其線性範圍為 5× 10- 6~0.1 mol/L。用 恆 流 庫 侖 計 產 生 的 碘 來 氧 化 SO3 2-,通過檢測過量的碘來間接測 SO3 2-,其線性 範圍為 0.015~25 mg/L。二氧化硫感測器主要用電 化學方法。還有用壓電晶體感測器同時測定二氧 化硫及相對濕度,用表面聲波感測器測定二氧化 硫等。電化學感測器具有靈敏度高,使用方便等 優點。
酶光度分析法
用酶光度 分析法測定亞硫酸鹽。其原理是 :在 pH3.6 的 NaAC- HAC 介質和亞硫酸鹽氧化酶存在下,亞硫 酸鹽被氧化成 SO4 2-,在過氧化氫酶作用下,用 3,3,5,5- 四甲基聯苯胺(TMB)顯色,在 650 nm 波長 下間接測定亞硫酸鹽的含量。該法靈敏度高,可 以檢測痕量的二氧化硫,但是樣品前處理較為 繁瑣。 4.4.4 快速檢測試劑盒 目前市場上還出現了食品二氧化硫現場快速檢測試劑盒、儀器,其原理是 食品中的二氧化硫與顯色劑反應生成有色化合物, 採用目視比色分析方法,直接在二氧化硫快速檢 測色階卡上讀出食品中二氧化硫的含量。該儀器 具有操作簡單、使用方便、可隨身攜帶、即時現 場檢測、檢測速度快(10~15 min)、樣品和試劑用量 少、無污染等優點,具有廣闊的套用前景。
常見謠言
謠言:二氧化硫對人體有害,不可以做食品漂白劑。
駁斥:過量二氧化硫確實對人體有害,但是二氧化硫按照國家標可以作為某些食品的添加劑使用,出自衛生部公告2011年第19號指定標準,該標準中序號3即為二氧化硫。

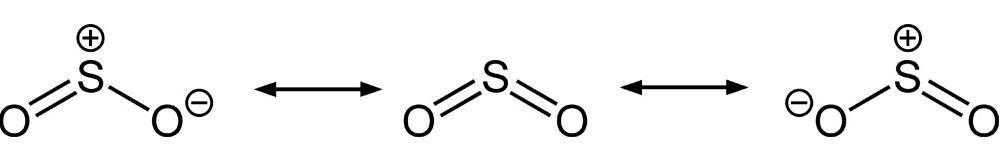 二氧化硫的三種共振結構
二氧化硫的三種共振結構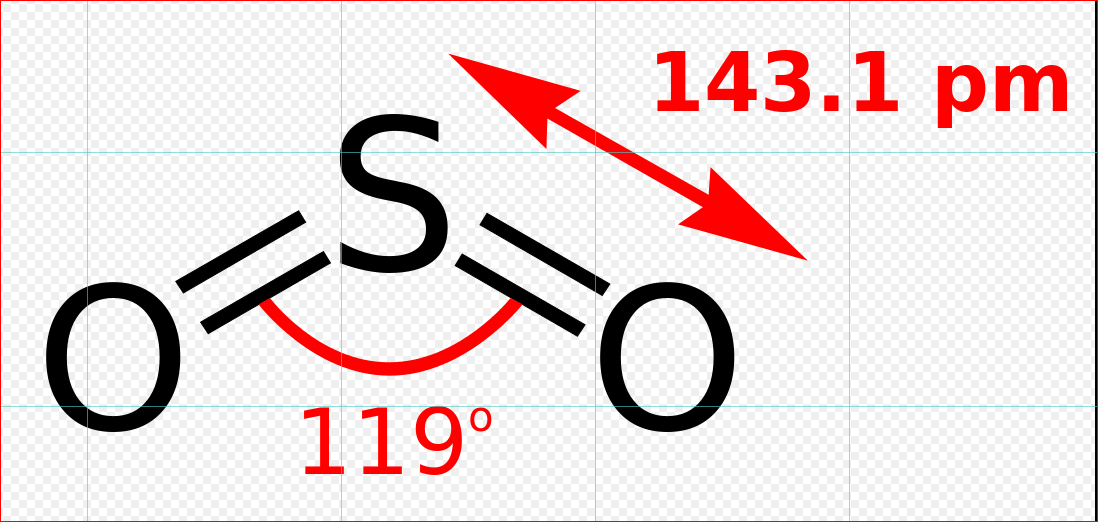 二氧化硫結構式
二氧化硫結構式
 二氧化硫檢測儀
二氧化硫檢測儀