基本介紹
- 中文名:1,3-偶極加成
- 外文名:1,3-dipolar cycloaddition
- 別名:1,3-偶極環加成
- 套用:合成雜環化合物的重要方法
- 特點:反應模組化,高產率,反應條件簡單,有立體選擇性,後處理簡單
- 產物:五元環化合物
定義
環加成反應
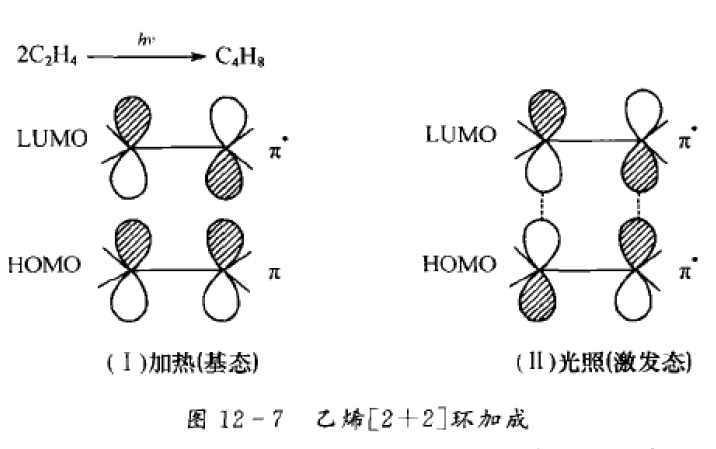
[2+2]環加成
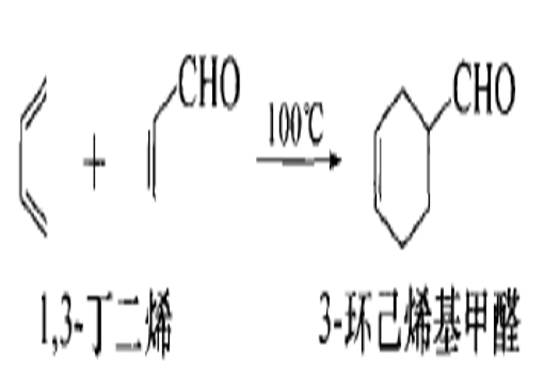
[2+4]環加成
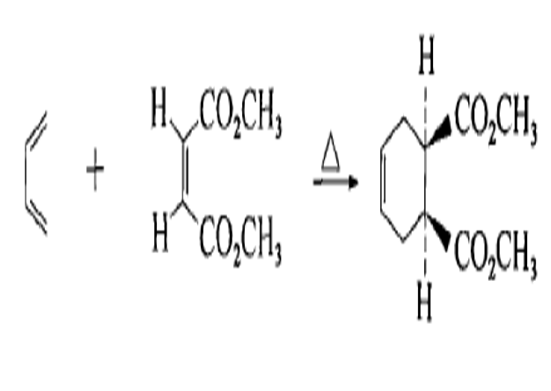
特點
典型反應
亞甲胺葉立德與貧電烯
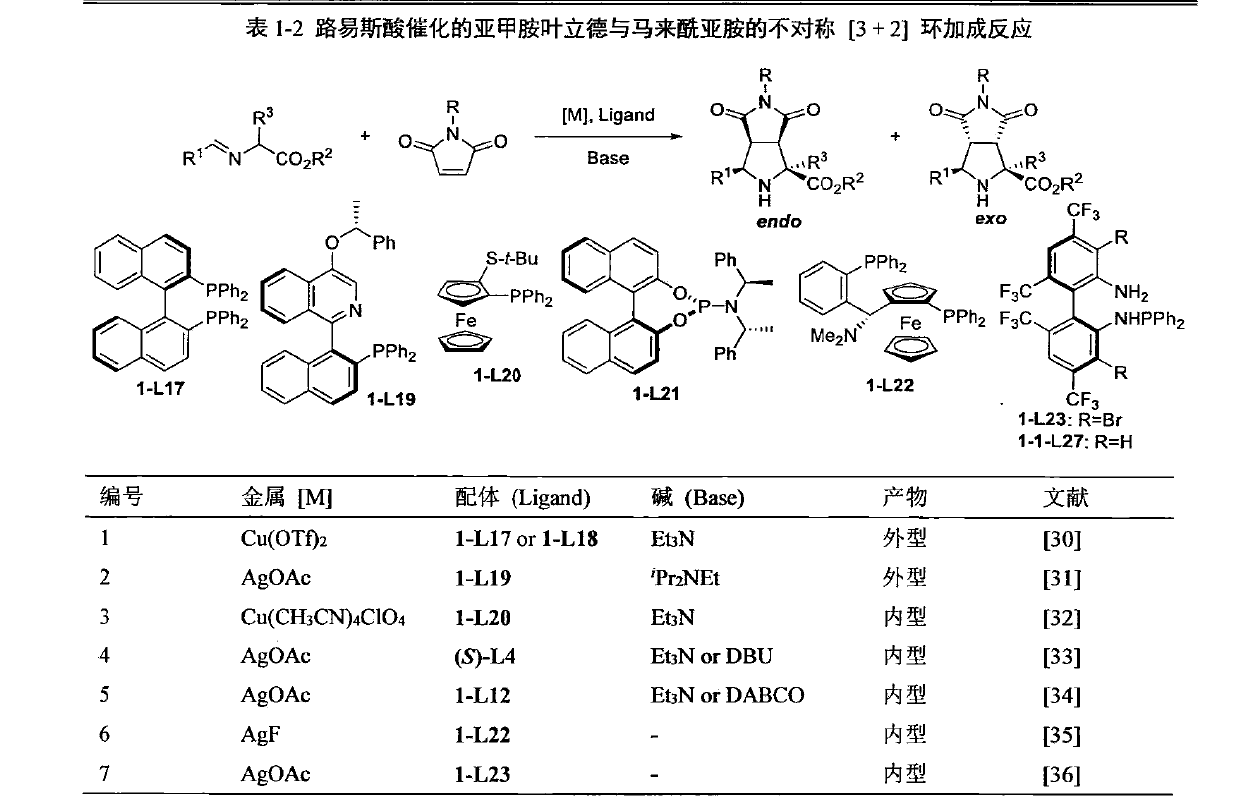
α-亞胺酯與α,β-不飽和烯酮
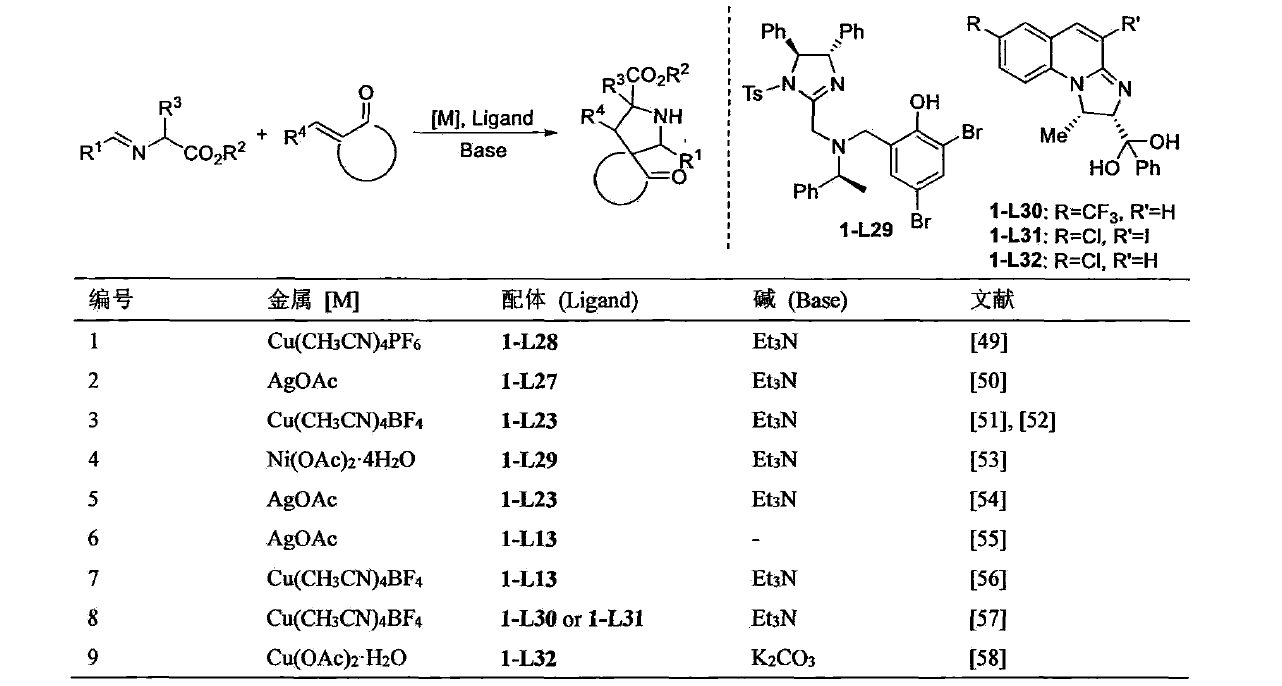
α-亞胺酯與硝基烯
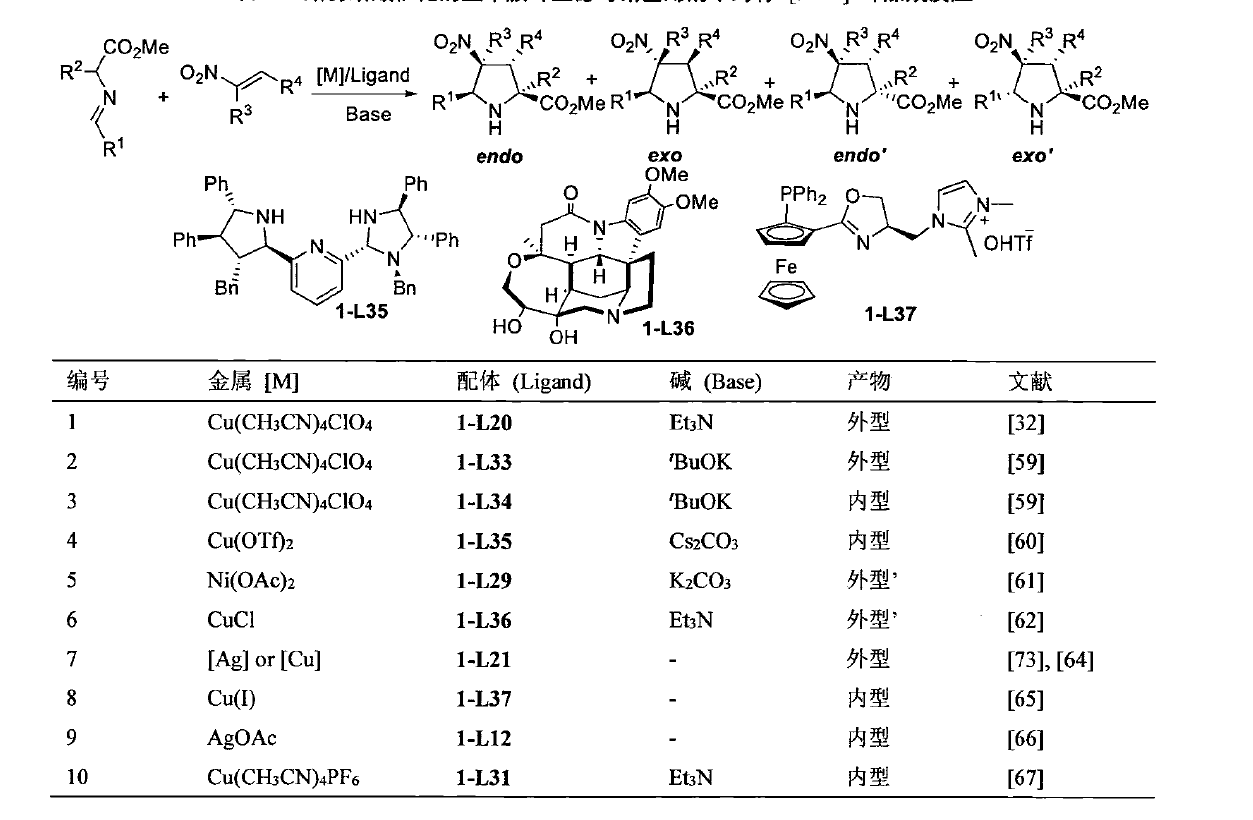
α-亞胺酯與碸基烯
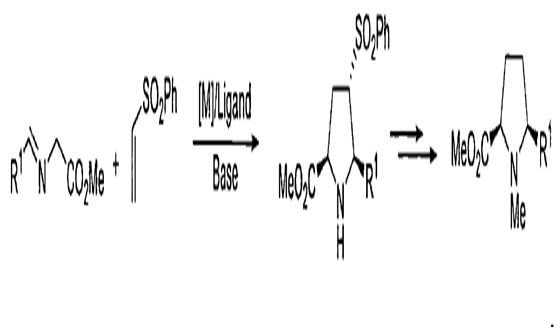
α-亞胺酯與含氟烯烴
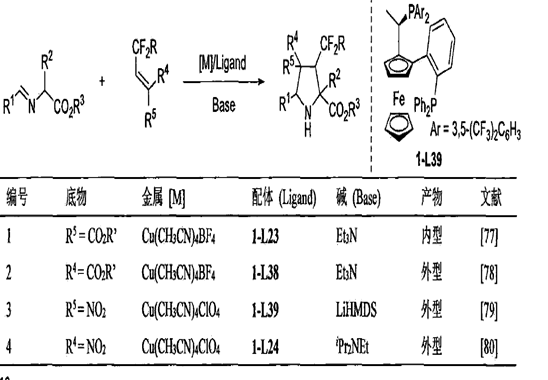
α-亞胺酯與富勒烯
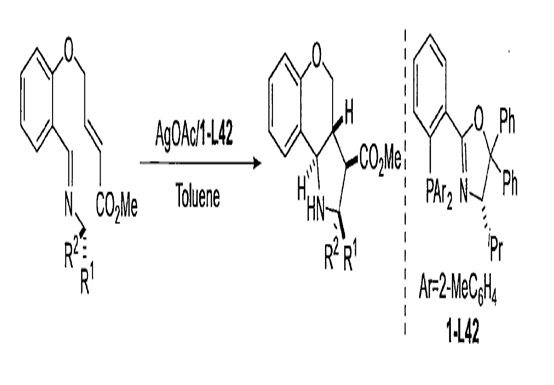
亞甲胺葉立德的分子內不對稱反應
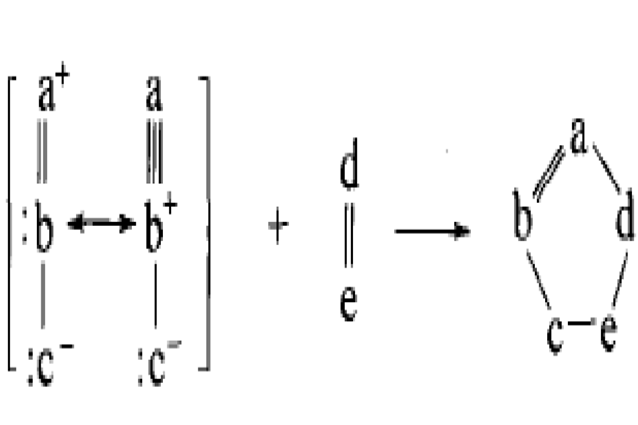










1,3偶極化合物和偶極親和物進行環化加成生成五元環化合物的反應,叫做1,3-偶極加成,是環加成反應的一種。1,3偶極化合物簡稱1,3偶極體,其分子中含有一個三原子四電子的共軛體系。1,3-偶極加成反套用於點擊化學,為通過...
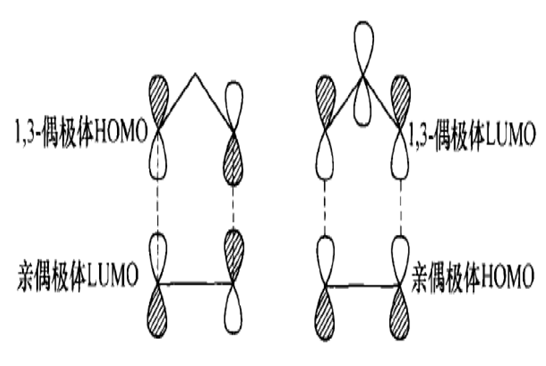
1,3-偶極環加成反應與狄爾斯-阿爾德反應有些相似。根據前線軌道理論,基態時1,3-偶極體的LUMO和親偶極體的HOMO,以及基態時1,3-偶極體的HOMO和親偶極體的LUMO,都是為分子軌道對稱守恆原理所允許的,因此反應可以發生。[1]1,3-偶極環加成反應因此也分為三類:一類是由1,3-偶極體出HOMO,稱為HOMO控制的反應;...
偶極[環]加成 偶極[環]加成是2016年全國科學技術名詞審定委員會公布的化學名詞。定義 由1,3-偶極組分作為4π電子體系參與的環加成反應。出處 《化學名詞》第二版
《疊氮和炔基1,3-偶極環加成反應及其偶聯套用的研究》是依託華中師範大學,由郭軍擔任項目負責人的面上項目。項目摘要 點擊化學作為一類新型的偶聯方法,是當前研究的前沿和熱點,已經在有機合成、生物學和功能材料等領域有著十分廣泛的套用。但是由於原有點擊化學反應的缺點和實際套用中的更高要求,目前仍然需要開發...
環加成聚合 環加成聚合是2016年公布的化學名詞。定義 通過第爾斯-阿爾德(Diels-Alder)反應或1,3-偶極環化加成反應,生成含有環狀結構聚合物的反應。出處 《化學名詞》。
加成反應通常具有極高的原子經濟性。催化的不對稱環加成反應可以從非手性的原料合成手性的環狀分子,並且在一步反應中同時引入多個連續的手性中心。迄今為止,國內外成功報導的不對稱環加成反應多是內式選擇性的Diels-Alder反應和1,3-偶極環加成反應。本項目旨在套用手性Lewis或Bronsted酸作為催化劑,對新型[3 + 2]...
(E)-1-苯基-1-丁烯 (E)-1-苯基-1-丁烯是一種有機化合物,分子式是C₁₀H₁₂
《金屬催化的亞甲胺葉立德的不對稱[3+3]環加成反應》是依託中國農業大學,由郭紅超擔任項目負責人的面上項目。項目摘要 本項目擬發展金屬催化的亞甲胺葉立德與偶氮次甲基亞胺及其它1,3-偶極子的新型不對稱[3+3]環加成反應。前期研究已實現了手性銀催化劑催化的亞甲胺葉立德與N,N'-環狀偶氮次甲基亞胺的不對稱[3...
普拉托反應(英語:Prato reaction)是發生在富勒烯或碳納米管與亞甲胺쭩內鹽之間的1,3-偶極環加成反應。歷史 普拉托反應(英語:Prato reaction)是發生在富勒烯或碳納米管與亞甲胺𬭩內鹽之間的1,3-偶極環加成反應。此反應以其研究者,義大利化學家毛里奇奧·普拉托(Maurizio prato)的名字命名。利用此反應是製取...
克里吉臭氧化反應(Criegee臭氧化反應),首先由Criegee,R發現,於1975年發表。反應中烯烴在臭氧作用下,經2次環加成,重排得到3氧橋化合物。烯烴經臭氧作用下得到1,2,4-三氧橋。反應機理 臭氧先對烯烴進行1,3-偶極環加成得到初級臭氧化物,重排得到兩性離子過氧化物,再一次1,3-偶極環加成生成最終的臭氧化物。...
從所周知,氧化腈與烯烴的1,3-偶極環加成反應在有機合成中具有重要意義,也是合成2-異噁唑啉環的典型的方法,異噁唑和異噁唑啉作為多功能結構單元。氧化腈是一般不可分離的反應活性中間體,在通常情況下,通過兩步反應產生氧化腈,第一步肟的氯化反應獲得α-氯代肟,第二步α-氯代肟與親偶極體共存時,鹼作用...
這些反應包括:分子間和分子內的硝酮形成/1,3-偶極環加成/重拍串聯反應、分子內的硝酮形成/1,3-偶極環加成反應、銨葉立德形成/親核加成反應和銨葉立德形成/[2,3]-Sigmatropic重排反應。這些反應可以從簡單原料高效快捷地構建多取代的氮雜環丙烷、多元稠環、α、β-二氨基磷酸酯、多取代的吲哚啉、α-胺基酸化合物...
疊氮化物發生[3,3]σ遷移反應,轉化為疊氮丙二烯的衍生物,接下來發生重排,經過分子內1,3-偶極環加成反應得到三氮雜富烯的衍生物。這個取代三氮雜富烯的環外烯烴雙鍵受三唑環強吸電子效應的影響,親電性非常強,很容易受另一疊氮根離子的親核進攻,經過雙鍵重排和質子化,最終得到另一疊氮甲基取代的1,2,3-三...
本項目以具有複雜多環體系的單吲哚類生物鹼Aspidofractinine和Kopsane為研究對象,從它們共有的螺[氧化吲哚-3,1'-八氫化吲嗪]母核結構出發,設計了以縮合/環化/分子間不對稱1,3-偶極環加成連續反應為關鍵步驟的簡潔的合成策略,其中對於有機分子催化的環狀亞胺葉立德與亞甲基氧化吲哚間的不對稱1,3-偶極環加...
對於螺異噁唑化合物,在已有的合成中來說,是一種比較新型的化合物,並且於1997年馮亞青和張曉東等,利用氧化腈與4,4-亞甲基-1-甲基哌啶的1,3-偶極環加成反應生成了雜螺(4,5)葵烷化合物,產物經LiAlH₄還原成了γ-氨基醇,最後經插入C-1單元擴環生產了新的雜螺(5,5)十一烷化合物。其氧化腈為...
通過設計一些新型的1,3-偶極環加成反應,高效率的引入氮原子和膦酸基,隨後進行化合物庫的設計,合成,以及活性化合物的結構最佳化等,以期發現高活性的抗禽流感新藥。同時,利用這些偶極加成的策略,發展高效的藥物Relenza和膦酸取代Relenza的合成方法。現今本小組已經完成部分前期工作,實現了一些關鍵反應的嘗試,為本...
慕尼黑酮可以與烯烴、炔烴等多重鍵發生偶極環加成反應,利用這個反應化學家可以製得一些雜環化合物。2009年,Yli-Kauhaluoma等人合成了連有吡啶基的慕尼黑酮的底物,用其原位產生慕尼黑酮,並與炔烴進行環加成反應,得到吡啶基吡咯。此外,慕尼黑酮也有其他的化學性質。例如2003年Grassi等研究了環狀的1,3-二羰基化合物...
將詳細研究新的手性催化劑體系和不對稱反應,主要包括設計和合成一系列手性雙磷酸催化劑,通過調節連結體的類型改變分子內氫鍵的強度,實現雙磷酸催化活性的調控,並研究其催化的1,3-偶極環加成反應、Povarov反應和Pictet-Spengler反應;設計和合成手性雙內鹽鹼催化劑,研究其催化的3-取代吲哚參與的不對稱加成反應;設計...
重氮化合物最早套用於多組分反應的例子,應該是經由金屬卡賓實現的1,3-偶極環加成反應。在此類反應中,重氮化合物首先被金屬催化劑分解生成金屬卡賓,金屬卡賓隨後與羰基或亞胺化合物上的氧/氮孤對電子反應生成羰基葉立德或亞甲胺葉立德中間體,該類中間體是很好的1,3-偶極體,可以和不同類型的親偶極體發生環加成...
4-Triazole sodium derivative; 1,2,4-Triazole sodium salt; 1,2,4-Triazolylsodium; Sodium 1,2,4-triazolide~1,2,4-Triazolyl sodium; 1,2,4-1Na-Triazole; 1-Na-1,2,4- Triazole ; 1H-1,2,4-Triazole sodium salt; sodium 1,2,4-triazole; sodium 1,2,4-triazol-4-ide; 1H-1,2,3-...
賓格反應也是重要的富勒烯環加成反應,形成亞甲基富勒烯。富勒烯在氯苯和三氯化鋁的作用下可以發生富氏烷基化反應,該氫化芳化作用的產物是1,2加成的(Ar-CC-H)。周環反應 富勒烯的[6,6]鍵可以與雙烯體或親雙烯體反應,如D-A反應。[2+2]環加成可以形成四元環,如苯炔。1,3-偶極環加成反應可以生成五元環,...
本項目以天然單糖為起始原料,利用Staudinger/Aza-Wittig/環合以及Staudinger/Aza-Wittig/還原等一鍋法反應,設計合成了多個系列的新型噻唑烷酮連假二糖(核)苷衍生物、噻唑(嗪)烷酮並氮雜糖、噻唑烷酮基類核苷和5'-N-芳基類核苷等衍生物;並利用糖基硝酮或糖類氰基氧化物的親核加成或1,3-偶極環加成反應合成了...
7.21,3-偶極環加成反應(266)7.3DielsAlder反應(267)7.4Fischer吲哚合成(272)7.5Friedlander 喹啉合成(273)7.6Haworth反應(275)7.7PictetGams異喹啉合成(277)7.8RobinsonSchoph反應(279)7.9Robinson關環反應(280)7.10SimmonsSmith反應(283)7.11Skraup喹啉合成(286)7.12電環化反應...
除了Wittig反應之外,很多葉立德還是1,3-偶極體,可以進行1,3-偶極環加成反應。如亞甲胺葉立德與富勒烯進行Prato反應。某些磷葉立德也可以進行[3,3]-σ遷移反應。研究表明,Wittig試劑在SN2反應中是親核試劑,消除反應發生於加成反應後。Wittig-Horner反應 雖然Wittig反應在製備含雙鍵化合物方面具有很大的優越性,但它...
7.1 環加成反應 7.1.1 [4+2]環加成 7.1.2 [2+2]環加成 7.1.3 1,3-偶極加成 7.2 電環化反應 7.2.1 含4m個π-電子的體系 7.2.2 含4m+2個π-邑子的體系 7.2.3 電環化反應的選擇規律 7.2.4 在合成中的套用 7.3 α-遷移反應 7.3.1 [1,j]遷移 7.3.2 [i...
最近我們小組成功地通過在環氧化合物中引入活化或導向基團(羰基或炔烴)實現了環氧化合物中碳-碳鍵的選擇性斷裂,得到1,3-和1,4-偶極子。本研究基於這些工作基礎,擬通過現代有機合成設計策略,進一步研究這些偶極子與亞胺,硝酮,烯烴,炔烴等親偶極體的環加成反應,以及重排反應等。通過催化劑的篩選和反應條件的...
