蛋白復性
如果
變性條件劇烈持久,
蛋白質的變性是不可逆的。如果變性條件不劇烈,這種
變性作用是可逆的,說明蛋白質分子內部結構的變化不大。例如
胃蛋白酶加熱至80~90℃時,失去溶解性,也無消化蛋白質的能力,如將溫度再降低到37℃,則又可恢復溶解性和消化蛋白質的能力。
分離步驟
分離
包涵體並復性蛋白質的操作步驟並不複雜,從破碎細胞開始,然後將細胞勻漿
離心,回收包涵體後,加入
變性劑溶解包涵體,使之成為可溶性伸展態,再通過透析等除去變性劑使表達產物摺疊恢復天然構象及活性。
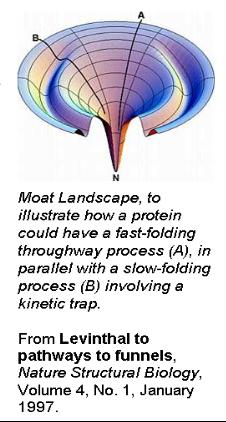
但在實際研究中發現,在體外摺疊時,蛋白質分子間由於存在大量錯誤摺疊和聚合,復性效率往往很低。究其原因,蛋白質的
立體結構雖然由其胺基酸順序決定,然而伸展
肽鏈摺疊為天然活性結構的過程還受到周圍環境的影響。
摺疊機制
為了有的放矢地開發輔助蛋白質復性的技術,研究工作者紛紛開展了對
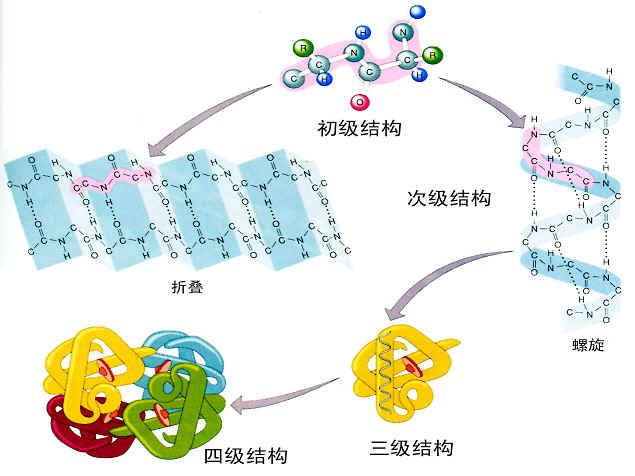
蛋白質摺疊機制的探討。有兩種不同的假設:一種假設認為,
肽鏈中的局部肽段先形成一些
構象單元,如
α螺旋、
β摺疊、
β轉角等
二級結構,然後再由二級結構單元的組合、排列,形成
蛋白質三級結構;另一種假設認為,首先是由肽鏈內部的
疏水相互作用導致一個塌陷過程,然後經逐步調整,形成不同層次的結構。儘管是不同的假設,但很多學者都認為有一個所謂‘
熔球態’的中間狀態。在熔球態中,蛋白質的二級結構已基本形成,其整體
空間結構也初具規模。此後,分子
立體結構再做一些局部調整,最終形成正確的立體結構[2]。總之,蛋白質摺疊的具體步驟可用下式描述:
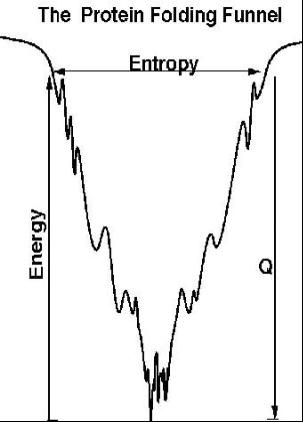
U→I→N
↓
A
即伸展態U經過早期變化成為中間體I,然後由中間體過渡到最後的天然態N。但是從
中間體摺疊為天然態的同時,另有一條旁路,即中間體相互聚集為凝聚物A(
包涵體)。在摺疊反應中,從伸展態到中間體的形成是非常快速的,一般在毫秒範圍內完成,但從中間體轉變為天然態的過程比較緩慢,是反應的限速步驟。當溶液中
離子強度或變性劑濃度很低,又無其它輔助手段存在時,聚集趨勢占主導地位,導致蛋白質的自發復性效率極低。
一般認為,蛋白質在復性過程中,涉及兩種
疏水相互作用,一是分子內的疏水相互作用,二是部分摺疊的
肽鏈分子間的疏水相互作用。前者促使蛋白質正確摺疊,後者導致蛋白質聚集而無活性,兩者互相競爭,影響蛋白質復性收率[3]。因此,在復性過程中,抑制肽鏈間的疏水相互作用以防止聚集,是提高復性收率的關鍵。
初期成果
80年代後期,人們開展了廣泛的蛋白質復性研究。例如,Carlson等發現,單克隆抗體具有協助蛋白質復性的作用[4];Cleland等發現,向稀釋的
變性蛋白質溶液中加入適當濃度的
聚乙二醇,可抑制蛋白質復性過程中的
凝聚沉澱,使蛋白質復性收率提高兩倍[5];Hagen等利用
反膠團萃取人工變性的蛋白質後去除
變性劑進行復性,復性率可達100%[6](但由於變性劑的存在,萃取率很低);Batas等利用
凝膠過濾色譜介質的
分子篩作用可防止變性蛋白質間的接觸和凝聚,輔助其正確摺疊[7];Zardeneta等利用
去污劑及混合膠團,成功地輔助了脲變性
硫氰酸酶復性[8]。
復性研究
1999年,
Sundari等報導了用直鏈
糊精輔助胰島素、
碳酸酐酶和雞蛋白
溶菌酶復性[11],發現直鏈糊精基本上能夠模擬環糊精在輔助蛋白質復性方面的作用,而且具有這樣一些優點:直鏈糊精的
螺旋結構形成一個疏水性空管,可以結合更多的蛋白質分子;在水中溶解度較高,有利於提高復性酶濃度和實驗操作;價格比環糊精便宜,實際套用前景更廣闊。
分子伴侶
性質
近來,越來越多的有關
蛋白質摺疊的研究已轉向利用
分子伴侶GroE家族。有些學者已成功地利用分子伴侶在體內和體外輔助蛋白質復性[12、13]。但分子伴侶在實際套用中尚存在費用高並需要與復性
蛋白質分離等缺點,因此研究開發分子伴侶的重複利用性及穩定性是實現其套用的關鍵。
GroEL具有
結合蛋白質的作用,相當於
變性蛋白質的親和
配基。
固定化GroEL柱(
固定床)相當於變性蛋白質的
親和吸附層析柱,從而可提高樣品的處理量,並使蛋白質在復性的同時得到濃縮和純化。其特點在於:①不僅可以解決分子伴侶的重複利用問題,而且由於固定床的利用(近於平推流),可提高分子伴侶的利用效率;②由於採用連續操作,原料處理量大,產品可以得到濃縮、純化;③易於建立相關的模型,對於放大生產具有重要的指導作用。Teshima等利用固定化
分子伴侶,在體外輔助了
澱粉酶、
碳酸酐酶、
DNA酶的摺疊復性[14]。
還有報導利用“小分子伴侶”對目標蛋白質進行復性[15、16]。“小分子伴侶”是指GroEL的一個片段,而這個片段並不是GroEL的水解產物,而是由基因重組後包括GroEL191-345
胺基酸殘基片段(16.7kD)或191-376胺基酸殘基片段(21kD)密碼的基因片段在大腸桿菌中的表達產物。它們能有效地促進
親環蛋白A、硫氰酸酶以及
芽孢桿菌RNA酶的復性。由於“小
分子伴侶”分子較小,更適合於
固定化,且不需另加復性輔助因子(如GroES和
ATP等),因此具有很大的套用前景。
人工分子伴侶
受蛋白質分子伴侶輔助蛋白質復性的啟發,Rozema和Gellman對人工分子伴侶體系(
去污劑+
環糊精)輔助
碳酸酐酶和雞蛋白
溶菌酶復性進行了研究[17、18]。與分子伴侶GroEL+ATP輔助復性的作用機制相似,其復性過程分為兩步進行:第一步捕獲階段,在
變性蛋白質溶液中加入去污劑,去污劑分子通過
疏水相互作用與蛋白質的疏水位點結合形成複合體,抑制
肽鏈間的相互聚集;第二步剝離階段,加入環糊精,由於環糊精分子對去污劑分子有競爭性
吸附作用,
去污劑分子被剝離下來,從而使
多肽鏈在此過程中正確摺疊為
活性蛋白質[17、18]。其反應機制可用下式表示:
U→U-dn→→→U-dn-m→→→F→N
即伸展態U首先與去污劑d形成複合物U-dn,加入
環糊精後,小分子去污劑被逐次剝離下來,變為部分摺疊、不含去污劑分子的非活性狀態F,進而摺疊為天然活性蛋白質N。
與GroE等蛋白質
分子伴侶相比,聯合使用去污劑和環糊精作為人工分子伴侶輔助蛋白質復性具有明顯的優點:①人工分子伴侶不屬於蛋白質,不易受環境影響而失活,操作條件較為寬鬆;②去污劑和環糊精均可直接購買,省去
分離純化的步驟;③去污劑與環糊精的分子量較小,容易與
蛋白質分離,有利於提高工業生產效率。?
冷凍結晶脫鹽
冷凍結晶
脫鹽在蛋白質復性研究方面的一些提示(集中精力在和緩的降低變性鹽濃度上,之前的所有方法基本都是用稀釋液體去增大體積,這個方法是讓變性鹽脫離溶液……)。
通常意義上人們普遍認為冷凍是一種
變性因素,原因是在溶液的凍結過程中會伴隨發生物態的巨大變化,進而導致蛋白質分子表面的離子氛圍、pH、水化狀態等各種因素的改變,因此變性也就是自然而然的結果。不過從事生物領域的多半都有凍存細胞的經歷,由此可以得出結論,在合適的防凍劑存在的條件下,蛋白是可以耐受低溫的。或者至少能有相當的蛋白能在低溫下保持活性。況且在變性液體中也不存在有活性的蛋白質,本身都是以
自由肽鏈的形式存在,因此冷凍對肽鏈的損傷似乎可以不用考慮(對此還需要進一步的研究)。
換個角度從物理學方面看,“冰”是一種
單礦岩,其生成過程中會自動排除其中的雜質。這也就是為何海上的冰山都是淡水的緣故。通常人們用於溶解
包涵體肽鏈的液體是高濃度的變性鹽(一般是8M的尿素,或者6M的
鹽酸胍,兩種鹽的密度都在1.3左右),而這種
溶質的溶解度受溫度影響很大。隨著溫度的降低,會發生飽和、
過飽和、結晶析出現象。溶質結晶析出自然也就意味著溶液濃度的下降,進而使變性能力的下降。下降到一定程度時,肽鏈其內在的塌縮的趨勢逐漸占據優勢,引導肽鏈進行自行復性至其活性狀態,即
能級最低狀態。也就是說,
肽鏈摺疊的
動力是由肽鏈的
一級結構(胺基酸序列)決定的,
人類直到所能做的復性過程其實質不過就是提供了一個變性能力和緩下降的變性體系(由尿素或者鹽酸胍的濃度下降來實現)。在這個過程中最需要防止的就是肽鏈之間的錯誤摺疊(鏈間形成
次級鍵),這會產生“雪崩樣”的效果,導致大量多聚體沉澱(密度也是1.3左右)。
冷凍優勢
冷凍方式用於蛋白復性可能的優勢有幾個方面。一、這種方式的簡單易行,只需要冷凍設備即可;二、此方法的運用可以導致溶液體積的減少,很大程度上對蛋白進行濃縮,方便下一步的處理;三、變性鹽以結晶沉澱方式脫離溶液,防止大量高污染復性尾液的產生;四、此方法的體系完全開放,可以很好的對接其他復性方式。至少冷凍一下降低一些初始變性鹽濃度也是相當有價值的;五、此方法即便失敗也幾乎沒有任何損失,體系可以很方便的復原,這一點是其他任何方法都不具備的,極其適合科研探索。
如果把蛋白復性僅只理解為肽鏈在不同變性鹽溶液濃度中的存在狀態。那么蛋白復性就沒什麼難的,無非是把尿素濃度從4M平緩的降低到2M即可。冷結晶析出無疑找到了一條行之有效的途徑。
但是之前的冷結晶方法似乎有個硬傷,也就是2M尿素時的溶解度,有可能相對的溫度在零下——液體凍結對蛋白活性的實質傷害。解決辦法可以加入
甘油之類的
防凍劑降低水的冰點。另外如果將結晶物理學的一些原理加於其中應該即可解決這個問題。
在
物態的固液汽三相變化中,水是種異類。其在零上4度的液體時擁有最大密度。固體變為冰時,其體積反倒變大,密度變小。在高壓強下,水的冰點下降。冰雪踩上去打滑就是冰在高壓強下融化的日常例子。而尿素之類的變性鹽其固體密度大,高壓強更能促進它們結晶析出。

只是還不知道能以何種的壓強達到目的,希望不會有太高的要求。更有可能的是輔助以防凍劑來達到所需效果。