概述
萃取
蒸餾是在有一種易溶、高
沸點,並且不揮發的組分存在下的蒸餾,而這種
溶劑本身並不與
混合物中的其他組分形成
恆沸物。萃取蒸餾通常用來分離一些具有很低的甚至相等的
相對揮發度的
物系。由於混合物中兩
組分的
揮發度接近相等,使到他們在接近相同的溫度下蒸發,而且蒸發的程度也相近,從而使分離變得困難。因此,相對揮發度很低的物系通常很難被簡單的
蒸餾過程所分離。
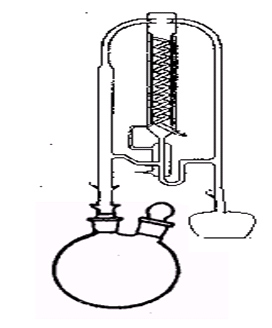 裝置簡圖
裝置簡圖這種蒸餾方法的一個重要部分就是溶劑的選擇。溶劑在把兩組分分離開的過程中扮演著重要的角色。值得注意的是,在選擇溶劑時,溶劑需要能顯著改變相對揮發度,否則便會是徒勞的嘗試。同時還要注意溶劑的經濟性(需要使用的量、其本身的價格和其可用性)。還要容易在塔釜中分離開來。並且不能與各
組分或
混合物發生
化學反應;也不能在設備中引起腐蝕。一個典型的例子就是用
苯胺或其他合適的替代品作為
溶劑,萃取蒸餾
苯和
環己烷形成的
恆沸物。
儀器
萃取
概述
固-液萃取,也叫浸取,用溶劑分離固體混合物中的組分,如用水浸取甜菜中的
糖類;用
酒精浸取黃豆中的豆油以提高油產量;用水從中藥中浸取有效成分以製取流浸膏叫“滲瀝”或“浸瀝”。
雖然萃取經常被用在化學試驗中,但它的操作過程並不造成被萃取物質化學成分的改變(或說
化學反應),所以萃取操作是一個物理過程。
萃取是有機化學實驗室中用來提純和純化
化合物的手段之一。通過萃取,能從固體或液體
混合物中提取出所需要的化合物。這裡介紹常用的液-液萃取。
原理
利用
化合物在兩種互不相溶(或
微溶)的
溶劑中
溶解度或
分配係數的不同,使化合物從一種溶劑內轉移到另外一種溶劑中。經過反覆多次萃取,將絕大部分的化合物提取出來。
分配定律是萃取方法理論的主要依據,物質對不同的溶劑有著不同的溶解度。同時,在兩種互不相溶的溶劑中,加入某種可溶性的物質時,它能分別
溶解於兩種溶劑中,實驗證明,在一定溫度下,該化合物與此兩種溶劑不發生分解、
電解、
締合和
溶劑化等作用時,此化合物在兩液層中之比是一個定值。不論所加物質的量是多少,都是如此。屬於
物理變化。用公式表示。
CA/CB=K
CA.CB分別表示一種化合物在兩種互不相溶地
溶劑中的量濃度。K是一個常數,稱為“
分配係數”。
有機化合物在
有機溶劑中一般比在
水中
溶解度大。用有機溶劑提取溶解於水的
化合物是萃取的典型實例。在萃取時,若在
水溶液中加入一定量的
電解質(如氯化鈉),利用“
鹽析效應”以降低有機物和萃取溶劑在水溶液中的溶解度,常可提高萃取效果。
要把所需要的化合物從溶液中完全萃取出來,通常萃取一次是不夠的,必須重複萃取數次。利用
分配定律的關係,可以算出經過萃取後化合物的剩餘量。
設:V為原溶液的體積
w0為萃取前化合物的總量
w1為萃取一次後化合物的剩餘量
w3為萃取n次後化合物的剩餘量
S為萃取溶液的體積
經一次萃取,原溶液中該化合物的濃度為w1/V;而萃取
溶劑中該化合物的濃度為(w0-w1)/S;兩者之比等於K,即:
w1/V =K w1=w0 KV
(w0-w1)/S KV+S
同理,經二次萃取後,則有
w2/V =K 即
(w1-w2)/S
w2=w1 KV =w0 KV
KV+S KV+S
因此,經n次提取後:
wn=w0 ( KV )
KV+S
當用一定量
溶劑時,希望在水中的剩餘量越少越好。而上式KV/(KV+S)總是小於1,所以n越大,wn就越小。也就是說把溶劑分成數次作多次
萃取比用全部量的溶劑作一次萃取為好。但應該注意,上面的公式適用於幾乎和水不相溶地溶劑,例如
苯,
四氯化碳等。而與水有少量互溶地溶劑
乙醚等,上面公式只是近似的。但還是可以定性地指出預期的結果。
audislee簡單點說給你聽:萃取是利用兩者的溶解度不同。萃取,
溶解原理,比如說現在A跟B混在一塊,有一種溶劑C,它與A相溶,但不與B相溶,那么我們可以在AB的
混合液中加入C,此時A溶入於C,與B分離,化學裡邊講的"分層"。
沿革
1842年 E.-M.佩利若研究了用
乙醚從
硝酸溶液中萃取
硝酸鈾醯。1903年L.埃迪蘭努用
液態二氧化硫從
煤油中萃取芳烴,這是萃取的第一次工業套用。20世紀40年代後期,生產核燃料的需要促進了萃取的研究開發。現今萃取已套用於
石油餾分的分離和精製,鈾、釷、鈽的提取和純化,有色金屬、稀有金屬、貴重金屬的提取和分離,抗菌素、
有機酸、生物鹼的提取,以及
廢水處理等。
方法
向待分離溶液(料液)中加入與之不相互
溶解(至多是部分互溶)的
萃取劑,形成共存的兩個液相。利用原
溶劑與萃取劑對各組分的
溶解度(包括經
化學反應後的溶解)的差別,使它們不等同地分配在兩液相中,然後通過兩液相的分離,實現組分間的分離。如碘的
水溶液用
四氯化碳萃取,幾乎所有的碘都移到四氯化碳中,碘得以與大量的水分開。
最基本的操作是單級萃取。它是使料液與萃取劑在
混合過程中密切接觸,讓被萃
組分通過相際界面進入萃取劑中,直到組分在兩相間的分配基本達到平衡。然後靜置
沉降,分離成為兩層液體,即由萃取劑轉變成的萃取液和由料液轉變成的萃余液。單級萃取達到
相平衡時,被萃組分B的相平衡比,稱為
分配係數K,即:
K=yB/xB
式中
yB和
xB分別為B組分在萃取液中和萃余液中的濃度。濃度的表示方法需考慮組分的各種存在形式,按同一
化學式計算。
若料液中另一
組分D也被萃取,則組分B的分配係數對組分D的分配係數的比值,即B對D的
分離因子,稱為
選擇性係數α,即:
α=KB·KD=yB·xD/(xB·yD)
α》1時,組分B被優先萃取;α=1表明兩組分在兩相中的分配相同,不能用此
萃取劑實現此兩組分的分離。
單級萃取對給定組分所能達到的萃取率(被萃組分在萃取液中的量與原料液中的初始量的比值)較低,往往不能滿足工藝要求,為了提高萃取率,可以採用多種方法:①多級
錯流萃取。料液和各級萃余液都與新鮮的萃取劑接觸,可達較高萃取率。但萃取劑用量大,萃取液平均濃度低。②多級
逆流萃取。料液與萃取劑分別從
級聯(或
板式塔)的兩端加入,在級間作逆向流動,最後成為萃余液和萃取液,各自從另一端離去。料液和萃取劑各自經過多次萃取,因而萃取率較高,萃取液中被萃
組分的濃度也較高,這是工業萃取常用的流程。③連續逆流萃取。在
微分接觸式
萃取塔(見
萃取設備)中,料液與
萃取劑在逆向流動的過程中進行接觸
傳質,也是常用的工業萃取方法。料液與萃取劑之中,密度大的稱為重相,密度小的稱為輕相。輕相自塔底進入,從塔頂溢出;重相自塔頂加入,從塔底導出。萃取塔操作時,一種充滿全塔的液相,稱
連續相;另一液相通常以
液滴形式分散於其中,稱分散相。分散相液體進塔時即行分散,在離塔前凝聚分層後導出。料液和萃取劑兩者之中以何者為分散相,須兼顧塔的操作和工藝要求來選定。此外,還有能達到更高分離程度的
回流萃取和
分部萃取。
套用
萃取與其他分離溶液
組分的方法相比,優點在於
常溫操作,節省能源,不涉及固體、氣體,操作方便。萃取在如下幾種情況下套用,通常是有利的:①料液各組分的
沸點相近,甚至形成
共沸物,為
精餾所不易奏效的場合,如
石油餾分中烷烴與芳烴的分離,
煤焦油的脫酚;②低濃度高沸組分的分離,用精餾能耗很大,如稀醋酸的脫水;③多種離子的分離,如礦物
浸取液的分離和淨制,若加入化學品作分部沉澱,不但分離質量差,又有
過濾操作,損耗也大;④不穩定物質(如熱敏性物質)的分離,如從發酵液製取青黴素。萃取的套用,目前仍在發展中。
元素周期表中絕大多數的元素,都可用
萃取法提取和分離。
萃取劑的選擇和研製,工藝和操作條件的確定,以及流程和設備的設計計算,都是開發萃取操作的課題。
蒸餾
蒸餾是一種
熱力學的分離工藝,它利用
混合液體或液-固體系中各
組分沸點不同,使低沸點組分蒸發,再冷凝以分離整個組分的
單元操作過程,是蒸發和冷凝兩種單元操作的聯合。與其它的分離手段,如萃取、Absorption等相比,它的優點在於不需使用系統組分以外的其它
溶劑,從而保證不會引入新的
雜質。
定義
指利用液體
混合物中各
組分揮發性的差異而將組分分離的
傳質過程。將液體沸騰產生的
蒸氣導入
冷凝管,使之冷卻凝結成液體的一種蒸發、冷凝的過程。
蒸餾是分離混合物的一種重要的操作技術,尤其是對於液體混合物的分離有重要的實用意義。
特點
1、通過
蒸餾操作,可以直接獲得所需要的產品,而吸收和萃取還需要如其它
組分。
3、能耗大,在生產過程中產生大量的氣相或液相。
分類
4、按操作方式分:間歇蒸餾、連續蒸餾
主要儀器
歷史
在
古希臘時代,Aristotle曾經寫到:“通過
蒸餾,先使水變成蒸汽繼而使之變成液體狀,可使
海水變成可飲用水”。這說明當時人們發現了蒸餾的原理。古埃及人曾用蒸餾術製造香料。在中世紀早期,
阿拉伯人發明了酒的蒸餾。在十世紀, 一位名叫Avicenna的哲學家曾對蒸餾器進行過詳細的描述。
原理
其原理以分離雙組分
混合液為例。將料液加熱使它部分汽化,易揮發
組分在
蒸氣中得到增濃,難揮發組分在剩餘液中也得到增濃,這在一定程度上實現了兩組分的分離。兩組分的揮發能力相差越大,則上述的增濃程度也越大。在工業
精餾設備中,使部分汽化的液相與部分冷凝的氣相直接接觸,以進行汽液相際傳質,結果是氣相中的難揮發組分部分轉入液相,
液相中的易揮發組分部分轉入
氣相,也即同時實現了液相的部分汽化和汽相的部分冷凝。
液體的分子由於
分子運動有從表面溢出的傾向。這種傾向隨著溫度的升高而增大。如果把液體置於密閉的真空體系中,液體分子繼續不斷地溢出而在液面上部形成
蒸氣,最後使得分子由液體逸出的速度與分子由蒸氣中回到液體的速度相等,蒸氣保持一定的壓力。此時液面上的蒸氣達到飽和,稱為
飽和蒸氣,它對液面所施的壓力稱為
飽和蒸氣壓。實驗證明,液體的飽和蒸氣壓只與溫度有關,即液體在一定溫度下具有一定的
蒸氣壓。這是指液體與它的蒸氣平衡時的壓力,與體系中液體和蒸氣的絕對量無關。
將液體加熱至沸騰,使液體變為蒸氣,然後使蒸氣冷卻再凝結為液體,這兩個過程的聯合操作稱為
蒸餾。很明顯,蒸餾可將易揮發和不易揮發的物質分離開來,也可將
沸點不同的液體
混合物分離開來。但液體混合物各組分的沸點必須相差很大(至少30℃以上)才能得到較好的分離效果。在
常壓下進行蒸餾時,由於大氣壓往往不是恰好為0.1MPa,因而嚴格說來,應對觀察到的沸點加上
校正值,但由於
偏差一般都很小,即使大氣壓相差2.7KPa,這項校正值也不過±1℃左右,因此可以忽略不計。
將盛有液體的
燒瓶放在
石棉網上,下面用
煤氣燈加熱,在液體底部和玻璃受熱的接觸面上就有蒸氣的
氣泡形成。
溶解在液體內的空氣或以薄膜形式吸附在瓶壁上的空氣有助於這種氣泡的形成,玻璃的粗糙面也起促進作用。這樣的小氣泡(稱為
氣化中心)即可作為大的蒸氣氣泡的核心。在
沸點時,液體釋放大量
蒸氣至小氣泡中,待氣泡的總壓力增加到超過大氣壓,並足夠克服由
於液柱所產生的壓力時,蒸氣的氣泡就上升逸出液面。因此,假如在液體中有許多小空氣或其它的氣化中心時,液體就可平穩地沸騰,如果液體中幾乎不存在空氣,瓶壁又非常潔淨光滑,形成氣泡就非常困難。這樣加熱時,液體的溫度可能上升到超過沸點很多而不沸騰,這種現象稱為“
過熱”。一旦有一個
氣泡形成,由於液體在此溫度時的
蒸氣壓遠遠超過大氣壓和液柱壓力之和,因此上升的氣泡增大得非常快,甚至將液體沖溢出瓶外,這種不正常沸騰的現象稱為“
暴沸”。因此在加熱前應加入助沸物以期引入
氣化中心,保證沸騰平穩。助沸物一般是表面疏鬆多孔、吸附有空氣的物體,如碎瓷片、
沸石等。另外也可用幾根一端封閉的
毛細管以引入氣化中心(注意毛細管有足夠的長度,使其上端可擱在
蒸餾瓶的頸部,開口的一端朝下)。在任何情況下,切忌將助沸物加至已受熱接近沸騰的液體中,否則常因突然放出大量蒸氣而將大量液體從蒸餾瓶口噴出造成危險。如果加熱前忘了加入助沸物,補加時必須先移去
熱源,待加熱液體冷至
沸點以下後方可加入。如果沸騰中途停止過,則在重新加熱前應加入新的助沸物。因為起初加入的助沸物在加熱時逐出了部分空氣,再冷卻時吸附了液體,因而可能已經失效。另外,如果採用浴液間接加熱,保持浴溫不要超過蒸餾液沸點20ºC,這種加熱方式不但可以大大減少瓶內蒸餾液中各部分之間的溫差,而且可使蒸氣的
氣泡不單從
燒瓶的底部上升,也可沿著液體的邊沿上升,因而可大大減少過熱的可能。
純粹的液體有機
化合物在一定的壓力下具有一定的沸點,但是具有固定沸點的液體不一定都是純粹的化合物,因為某些有機化合物常和其它
組分形成二元或三元
共沸混和物,它們也有一定的
沸點。不
純物質的沸點則要取決於雜質的物理性質以及它和純物質間的相互作用。假如雜質是不揮發的,則溶液的沸點比純物質的沸點略有提高(但在
蒸餾時,實際上測量的並不是不純溶液的沸點,而是逸出
蒸氣與其
冷凝平衡時的溫度,即是
餾出液的沸點而不是瓶中蒸餾液的沸點)。若雜質是揮發性的,則蒸餾時液體的沸點會逐漸升高或者由於兩種或多種物質組成了
共沸點混合物,在蒸餾過程中溫度可保持不變,停留在某一範圍內。因此,沸點的恆定,並不意味著它是純粹的化合物。
蒸餾沸點差別較大的
混合液體時,沸點較低者先蒸出,沸點較高的隨後蒸出,不揮發的留在
蒸餾器內,這樣,可達到分離和提純的目的。故蒸餾是分離和提純
液態化合物常用的方法之一,是重要的基本操作,必須熟練掌握。但在蒸餾
沸點比較接近的混合物時,各種物質的
蒸氣將同時蒸出,只不過低沸點的多一些,故難於達到分離和提純的目的,只好藉助於
分餾。純液態化合物在蒸餾過程中
沸程範圍很小(0.5~1℃)。所以,
蒸餾可以利用來測定沸點。用
蒸餾法測定沸點的方法為常量法,此法樣品用量較大,要10 mL以上,若樣品不多時,應採用微量法。
分餾實驗原理
定義:分餾是利用
分餾柱將多次氣化—
冷凝過程在一次操作中完成的方法。因此,分餾實際上是多次蒸餾。它更適合於
分離提純沸點相差不大的液體有機
混合物。
進行分餾的必要性:⑴蒸餾分離不徹底。⑵多次
蒸餾操作繁瑣,費時,浪費極大。
混合液沸騰後
蒸氣進入分餾柱中被部分冷凝,
冷凝液在下降途中與繼續上升的 蒸氣接觸,二者進行
熱交換,
蒸汽中高
沸點組分被冷凝,低沸點組分仍呈蒸氣上升,而冷凝液中低沸點組分受熱氣化,高沸點組分仍呈液態下降。結果是上升的蒸汽中低沸點組分增多,下降的冷凝液中高沸點組分增多。如此經過多次熱交換,就相當於連續多次的普通蒸餾。以致低沸點組分的蒸氣不斷上升,而被蒸餾出來;高沸點組分則不斷流回蒸餾瓶中,從而將它們分離。
溶液蒸餾
p溶劑=po溶劑x溶劑
式中p溶劑、po溶劑分別是溶液中溶劑的蒸氣壓和純溶劑的蒸氣壓;
由於溶液中x溶劑<1,溶液中溶劑的蒸氣壓總比純溶劑的
蒸氣壓低一些。
蔗糖水溶液的蒸餾曲線。曲線1和曲線2分別表示水和蔗糖水溶液的溫度-蒸氣壓曲線。溶液中蔗糖分子的存在會降低溶液表面上
水分子的
密集度,從而降低溶液的
蒸氣壓。因此在相同的溫度下溶液的蒸氣
壓(B點)低於水的蒸氣壓(A點)。在100oC時水會沸騰(在1個大氣壓下),而溶液還不會沸騰。只有在更高的溫度下(B′點)溶液才會沸騰。對於這一類溶液,
蒸餾操作或者是用來回收純
溶劑,或者是用來得到
固體溶質。
方法分類
②簡單蒸餾。使
混合液逐漸汽化並使蒸氣及時冷凝以分段收集的分離操作。
實驗室蒸餾操作
⑴分離液體
混合物,僅對混合物中各成分的
沸點有較大的差別時才能達到較有效的分離;
⑶提純,通過蒸餾含有少量雜質的物質,提高其純度;
加料:將待蒸餾液通過玻璃漏斗小心倒入
蒸餾瓶中,要注意不使液體從支管流出。加入幾粒助沸物,安好溫度計,
溫度計應安裝在通向冷凝管的側口部位。再一次檢查儀器的各部分連線是否緊密和妥善。
加熱:用水冷凝管時,
先由冷凝管下口緩緩通入冷水,自上口流出引至
水槽中,然後開始加熱。加熱時可以看見
蒸餾瓶中的液體逐漸沸騰,
蒸氣逐漸上升。溫度計的讀數也略有上升。當蒸氣的頂端到達溫度計
水銀球部位時,溫度計讀數就急劇上升。這時應適當調小
煤氣燈的火焰或降低加熱電爐或
電熱套的電壓,使加熱速度略為減慢,蒸氣頂端停留在原處,使瓶頸上部和溫度計受熱,讓水銀球上
液滴和蒸氣溫度達到平衡。然後再稍稍加大火焰,進行蒸餾。控制加熱溫度,調節蒸餾速度,通常以每秒1~2滴為宜。在整個蒸餾過程中,應使溫度計水銀球上常有被
冷凝的液滴。此時
蒸餾
的溫度即為液體與
蒸氣平衡時的溫度,溫度計的讀數就是液體(餾出物)的
沸點。
蒸餾時加熱的火焰不能太大,否則會在
蒸餾瓶的頸部造成過熱現象,使一部分液體的蒸氣直接受到火焰的熱量,這樣由溫度計讀得的沸點就會偏高;另一方面,蒸餾也不能進行得太慢,否則由於溫度計的水銀球不能被
餾出液蒸氣充分浸潤使溫度計上所讀得的沸點偏低或不規範。
觀察沸點及收集餾液:進行蒸餾前,至少要準備兩個接受瓶。因為在達到預期物質的沸點之前,帶有沸點較低的液體先蒸出。這部
分餾液稱為“前餾分”或“餾頭”。前餾分蒸完,溫度趨於穩定後,蒸出的就是較純的物質,這時應更換一個潔淨乾燥的接受瓶接受,記下這部分液體開始餾出時和最後一滴時溫度計的讀數,即是該餾分的
沸程(
沸點範圍)。一般液體中或多或少地含有一些高沸點雜質,在所需要的餾分蒸出後,若再繼續升高加熱溫度,溫度計的讀數會顯著升高,若維持原來的加熱溫度,就不會再有餾液蒸出,溫度會突然下降。這時就應停止
蒸餾。即使雜質含量極少,也不要蒸乾,以免蒸餾瓶破裂及發生其他意外事故。
蒸餾完畢,應先停止加熱,然後停止通水,拆下儀器。拆除儀器的順序和裝配的順序相反,先取下接受器,然後拆下尾接管、
冷凝管、
蒸餾頭和
蒸餾瓶等。
操作時要注意:⑴在蒸餾燒瓶中放少量碎瓷片,防止液體
暴沸。⑵溫度計水銀球的位置應與支管口下緣位於同一水平線上。⑶
蒸餾燒瓶中所盛放液體不能超過其容積的2/3,也不能少於1/3。⑷冷凝管中冷卻水從下口進,上口出。⑸加熱溫度不能超過
混合物中
沸點最高物質的沸點。
最早的蒸餾器
考古人員在西安市
張家堡廣場東側發掘出四百四十餘座漢代墓葬,其中一處規格較高的西漢王莽時期墓葬中,發現一盅工藝奇特的銅
蒸餾器,可能是歷史上最早的
蒸餾器。
這盅銅蒸餾器通高三十六厘米,由筒形器、
銅鍑和豆形蓋組成。其中筒形器底部有一米格形箅,為
古代炊具中用作隔層的器具。底邊有一小管狀流,銅鍑三蹄形足,豆形器蓋上部呈盤形,相合處為榫鉚結構,可在一定範圍內自由活動。出土時放置有序,銅鍑置於筒形器內,豆形蓋置於銅鍑之上。這樣組合的蒸餾器此前從未發現,儘管其工作原理尚不明確,但從構造看來,應是用作蒸餾藥、酒。
據了解,此前中國曾出土東漢時期的青銅
蒸餾器,而西安張家堡
漢墓發現的銅
蒸餾器則較其更早。西安文物保護考古所副所長程林泉表示,其出土為漢代飲食和醫藥技術的研究提供了十分珍貴的實物資料。
另外,在蒸餾器出土所在的編號M115墓葬中,考古人員還發掘出二百多件器物,其中包括五件大型
銅鼎和四件大型
釉陶鼎。據《周禮》記載,西周時天子用九鼎隨葬。M115的墓主追慕周代禮制,使用九鼎隨葬,可見其特殊身份地位。九鼎和另一件
隨葬品仿銅釉陶鼎是王莽
托古改制的真實物證,具有極為重要的學術價值和歷史意義。
是次發掘的四百四十餘座漢墓群位於
漢長安城東側,距長安城僅二千五百米,共出土陶、銅、鐵、鉛、玉石、骨等各類文物近三千件。這批墓葬以小型
漢墓為主,其中三座西漢晚期至
新莽時期的中型墓葬最為重要,不僅出土了西漢時期墓葬常見的器物,如紅彩陶器、
釉陶器、鼎、盒、壺、倉、奩、灶等,在M110號墓葬中,還出土了玉衣殘片。而M114號墓葬中出土的大型精美釉陶器,在西安地區兩漢墓葬中亦十分罕見。專家表示,是次發掘對於研究漢代社會生活、漢長安城布局等方面提供了重要的材料,並有助進一步解讀漢文化的形成與發展。
 裝置簡圖
裝置簡圖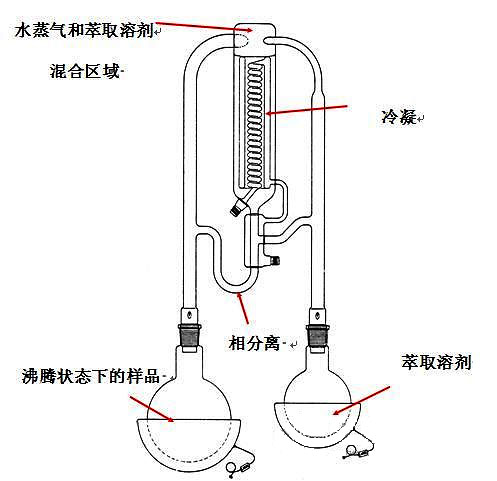
 裝置簡圖
裝置簡圖