名詞釋義
(1) [seawater]∶海中或來自海中的水。明
趙振元《為袁氏祭袁石寓憲副》:“嗚呼!海水群立,舊鬼煩冤,石寓(
袁可立子)之目其瞑焉,否耶!”
海水浴
(3) [the sea]∶海
海水成分
海水是一種非常複雜的多組分水溶液。海水中各種元素都以一定的物理化學形態存在。在海水中銅的存在形式較為複雜,大部分是
有機化合物形式存在的。在自由離子中僅有一小部分以二價正離子形式存在大部分都是以負離子絡合物出現。所以自由
銅離子僅占全部溶解銅的一小部分。海水中有含量極為豐富的鈉,但其化學行為非常簡單,它幾乎全部以Na+離子形式存在。
海水中的溶解
有機物十分複雜,主要是一種叫做“海洋腐殖質”的物質,它的性質與土壤中植被分解生成的腐殖酸和富敏酸類似。海洋腐殖質的分子結構還沒有完全確定,但是它與金屬能形成強化合物。
海水中的成分可以劃分為五類
1.主要成分(大量、常量元素):指海水中濃度大於1mg/kg的成分。屬於此類的有陽離子
、
、
、
和
五種,陰離子
、
、B
、
、
、
六種,還有以分子形式存在的H3BO3,其總和占海水鹽分的99.9%。所以稱為主要成分。
由於這些成分在海水中的含量較大,各成分的濃度比例近似恆定,生物活動和總鹽度變化對其影響都不大,所以稱為保守元素。
海水中的Si含量有時也大於1mg/kg,但是由於其濃度受生物活動影響較大,性質不穩定,屬於非保守元素,因此討論主要成分時不包括Si。
2.溶于海水的氣體成分,如氧、氮及惰性氣體等。
3.營養元素(營養鹽、生源要素):主要是與海洋植物生長有關的要素,通常是指N、P及Si等。這些要素在海水中的含量經常受到植物活動的影響,其含量很低時,會限制植物的正常生長,所以這些要素對生物有重要意義。
4.微量元素:在海水中含量很低,但又不屬於營養元素者。
5.海水中的有機物質:如胺基酸、腐殖質、葉綠素等
海水的主要成份
海水中溶解有各種鹽分,海水鹽分的成因是一個複雜的問題,與地球的起源、海洋的形成及演變過程有關。一般認為鹽分主要來源於地殼岩石風化產物及海底火山噴出的可溶化合物。另外,全球的河流每年向海洋輸送5.5×1015g溶解鹽,這也是海水鹽分來源之一。從其來源看,海水中似乎應該含有地球上的所有元素,但是,由於分析水平所限,已經測定的僅有80多種。現將其中重要的一些元素列於下表。
海水中最重要的溶解元素的化學形態和濃度
元素 | 平均濃度 | 單位(kg/海水) | 元素 | 平均濃度 | 單位(kg/海水) |
Li | 174 | μg | As | 1.7 | μg |
Fe | 55 | ng | Na | 10.77 | g |
B | 4.5 | mg | Br | 67 | mg |
Ni | 0.50 | μg | Mg | 1.29 | g |
C | 27.6 | mg | Rb | 120 | μg |
Cu | 0.25 | μg | Al | 540 | ng |
N | 420 | μg | Sr | 7.9 | mg |
Zn | 0.40 | μg | Si | 2.8 | mg |
F | 1.3 | mg | Cd | 80 | ng |
P | 70 | μg | I | 50 | ng |
S | 0.904 | g | Cs | 0.29 | μg |
Cl | 19.354 | g | Ba | 14 | μg |
K | 0.399 | g | Hg | 1 | ng |
Ca | 0.412 | g | Pb | 2 | ng |
Mn | 14 | ng | U | 3.3 | μg |
表中較高濃度的組分基本上代表了其在海水中的平均濃度,一些低含量成分由於測定困難,測定過的樣本不多,難以代表其平均濃度。許多感興趣的金屬在海水中含量極低,只有用靈敏的測試儀器和技術並避免
樣品採集和分析過程中的污染才能夠測定。
海水污染
污水、廢渣、廢油和化學物質源源不斷地流入大海。在許多海域,傾倒混有石油的污水是非法的,但這種事仍時有發生,而真正的石油災難是在巨型
油輪泄漏或沉沒時發生的。如今我們設法用化學品使水中石油沉澱以達到清除石油的目的。
向海洋傾倒化學和放射性廢物的做法已持續多年。容器總有一天會腐蝕掉,有害物質便將進入海水中。我們對
深層水與
表層水的循環情況還了解不多,其過程或許比我們以前所想的要快。
因此有害物質就會擴散到生物活動的水層中去。
相關問題
為什麼是鹹的
斯堪的那維亞半島有一個民間故事說,海水之所以總是鹹的,是因為在海底有一個神仙,它有一盤磨鹽的磨子在不停地轉動,所以海水一直是鹹的。
海水是鹽的“故鄉”,海水中含有各種鹽類,其中百分之90左右是
氯化鈉,也就是食鹽。另外還含有
氯化鎂、
硫酸鎂、碳酸鎂及含鉀、碘、鈉、溴等各種元素的其他鹽類。氯化鎂是點豆腐用的
滷水的主要成分,味道是苦的,因此,含鹽類比重很大的海水喝起來就又鹹又苦了。
 海水
海水如果把海水中的鹽全部提取出來平鋪在陸地上,陸地的高度可以增加153米;假如把世界海洋的水都蒸發乾了,海底就會積上60米厚的鹽層。
站在海邊,極目遠望,大海是藍色的。然而,當你舀起一盆海水觀察,你會發現海水是無色透明的。大海的藍色是從何而來的呢?
選擇吸收是物體呈現顏色的主要原因。在一定的波長範圍內,若物質對通過它的各種波長的光都作等量(指能量)吸收,且吸收量很小,則稱這種物質為一般吸收;若物質吸收某種波長的
光能比較顯著,則稱這種物質具有
選擇吸收性。太陽光照射到海面時,一部分光被反射回來,另一部分光折射進入水中。進入水中的光線在傳播過程中會被水吸收。水對光的吸收與光的波長有關,即水具有選擇吸收性。水對波長較長的
光吸收顯著,對波長較短的吸收不明顯。紅光、橙光和黃光在不同的深度時均被吸收了,並使海水的溫度升高。到一定的深度
綠光也被吸收了。而波長較短的藍光和紫光遇到水分子或其他微粒會四面散開,或反射回來。所以當海水明淨清澈時,目光中被海水吸收最少的藍光和紫光就反射和散射到我們眼裡,我們看見的大海就呈現出藍色。
人們自然會提出這樣一個問題,紫光波長最短,散射和反射應當最強烈,為什麼海水不帶紫色呢?實驗表明,人眼對紫光很不敏感,因此對海水反射的紫光視而不見。所以海水不呈現紫色,完全是因為人眼沒有如實反映情況的緣故。
水分子對於可見光中各種波長不同的光線(指紅、橙、黃、綠、青、藍、紫)散射作用(指光束在媒質中前進時,部分光線離原來方向而分散傳播的現象)的強弱不同,對於波長短的(如綠、青、藍等)其散射作用遠比波長長的光(如紅、橙色)的散射作用強。再加上散射作用的強弱與
光程的長短也有關。在水層較淺時,可見光中各種波長的光幾乎都能透過,散射作用也不顯著。因此,水是無色透明的。當水較深時,由於散射作用顯著,水就顯出淺藍綠色。水中溶有空氣越多越偏綠色。水更深時會出現深藍色甚至顯黑色。海水較深時顯藍色,就是這個緣故。
為什麼不能喝
海水中含有大量鹽類和多種元素,其中許多元素是人體所需要的。但海水中各種物質濃度太高,遠遠超過飲用水衛生標準,如果大量飲用,會導致某些元素過量進入人體,影響人體正常的生理功能,還會導致人體脫水,嚴重的還會引起中毒。
如果喝了海水,可以採取大量飲用淡水的辦法補救。大量淡水可以稀釋人體攝入過多的礦物質和元素,將其通過汗液排出體外。
傳說
有一個美麗的傳說
從前有一個愛海的人,每天跑到海邊去看海,可是海對他還是很冷淡。這個人就對海說,我這樣對你,每天來看你,可是你對我總是平平淡淡,難道你不能把你的激情展現給我嗎?讓你的愛來的更猛烈一些。海聽了他的話就問他,你能接受我翻江倒海的愛嗎?他回答說:可以,讓你的愛來的更猛烈些吧!海被他的話語而感動.頃刻間巨浪翻滾,狂風大做巨浪一波接一波向岸邊而來,他從沒有見過海這樣,當浪快到他的身旁的時候,他轉身就跑,這時的海很傷心。
經過這次以後,海不敢輕易的把愛給予別人。過了很長一段時間,又有一個愛海的人,他不但每天來看海,還把自己的家搬到了海邊,要以海為伴,終生守護在海的身邊。海終於被他的舉動感化,並把溫馨的愛和猛烈的愛都給了他,他沒有跑,就這樣他們結合了。可是過了很長時間,他就有些厭煩了,總覺得海給予他的不是風平浪靜,就是波濤翻滾。覺得海再也不能給予他別的什麼愛了,就這樣他也悄悄的離開了海。
海十分傷心,這些都被藍天看在了眼裡。他對海說:請你不要傷心難過了,其實他們都不懂你。他們看到的只是你的表面,其實海底的世界更加豐富多彩,那裡有五色的魚類,豐富的礦產,美麗的珊瑚。這些才是你為他們準備的,可惜他們不懂。藍天說:只有我知道這些。
後來藍天就和大海相愛了。大海和藍天相愛後,可是因為他們相距遙遠,加上世俗的偏見,他們始終不能牽手,天各一方,彼此思念,隨著時間的推移,思念更加的濃厚。就這樣日復一日,年復一年,當思念難以忍受的時候,藍天就以淚洗面,藍天的淚水滴落到了海的心裡,不知道留了多少淚水,把整個海水染成了藍色,那都是藍天的淚水呀,所以海天一色。
主要溶解成分
海水中含量大於1毫克/千克的11種化學成分。它們包括:①鈉、鎂、鈣、鉀和鍶等5種陽離子;②
氯根、
硫酸根、
碳酸氫根(包括
碳酸根)、溴根和氟根等5種
陰離子;③硼酸分子。這些成分的總量占海水中所有溶解成分的99.9%以上。被河川搬運入海的岩石
風化產物和火山等的噴發物,是海水主要溶解成分的主要來源。
自從地球表面出現海洋之後,在漫長的地質年代中,不但經歷了海陸變遷,而且海水中的溶解成分,曾有過組成的演變。儘管各大洋海水的含鹽量隨海域和深度而異,但海水主要溶解成分的含量間有恆定的比例,就稱海水的組成是恆定的,並稱這些成分是保守成分。
18世紀以來,人們對海水主要溶解成分進行了許多研究工作。1819年,A.M.馬賽特分析了取自大西洋、北冰洋、 波羅的海、黑海和黃海的14個水樣,發現雖然Mg2+、Ca2+、Na+、Cl-、SO娺-等5種成分在不同水樣中的含量都各不相同,但它們之間在每一份水樣中的比值是近似守恆的,即這些溶解成分的組成有近似的恆比關係。1884年,W.迪特馬爾分析了英國“挑戰者”號調查船從主要大洋和海區的不同深度採樣的77個海水樣品,根據(Cl-+Br-)、
-、CO2、Ca2+、Mg2+、K+和Na+等7 種成分的含量,證實了海水主要溶解成分的恆比關係。20世紀60年代中期,為了深入研究海水中主要溶解成分的含量及其
保守性,英國國立海洋研究所和利物浦大學通過
海洋調查,收集了世界各大洋及某些海區不同深度的海水樣品,分別測定過表層水、中層水和深層水中主要溶解成分的含量,討論了某些成分變化的情況。1975年,T.R.S.威爾孫對海水主要溶解成分進行了全面的總結。
海水主要溶解成分之間,所以具有恆比關係這一特點,是因為海水中的含鹽量相當穩定,加上海水的不停運動,使各成分充分混合的緣故。但由於生物的作用,海底熱泉和大陸徑流等的影響,局部海區的某些主要溶解成分的含量並不嚴格遵守恆比關係。例如
深層海水中Ca2+的相對含量大約比表層水高千分之五。因此,不同的主要溶解成分的
保守性(相對含量的守恆性)略有差異。要研究溶解成分的保守性,考慮的不是它的濃度大小,而應考慮其相對含量,即濃度與含鹽量之比。由於通常以
氯度或鹽度表示含鹽量的大小,故引用濃度(克/千克)與氯度或鹽度之比為參量,稱為氯度比值或鹽度比值。直接用氯度比值或鹽度比值的恆定性和變化範圍說明海水中溶解成分的保守性。
海洋中主要溶解成分的氯度比值,基本上保持恆量。但由於上述原因,氯度比值會產生變化,主要表現為:
① 生物的影響。上層海水中的生物在生長繁殖過程中,吸收Ca2+和Sr2+等溶解成分,其殘體在下沉和在分解過程中逐漸將Ca2+和Sr2+釋放於水中,其循環與
海水營養鹽類似。因此在深層和中層的水中,Ca2+和Sr2+的氯度比值大於表層水。
② 徑流的影響。河水的溶解成分及其含量和海水不同。例如:
海水中溶解成分的含量:
Na+>Mg2+>Ca2+
Cl->SO4->HCO3-(包括CO3 2-)
全世界河水中溶解成分的平均含量:
Ca2+>Na+>Mg2+
HCO3(包括CO32->SO4->Cl-因此,河口區的海水受河水的影響,溶解成分的氯度比值發生變化,特別是低鹽海水更加明顯。這些區域的海水中,Ca2+、SO42-和HCO3-的氯度比值常常比較高。
③ 結冰和融凍的影響。海水在高緯度海區結冰時,Na+SO7會進入冰晶之中,故結冰後的海水的
氯度比值降低;融冰時適相反。
④ 溶解氧的影響。在缺氧或無氧海域,由於硫酸鹽還原菌滋生,可將一些 SO4-還原成H2S,使 SO4 的氯度比值變小。例如黑海表層水中,SO-的氯度比值為0.1400,但在其深2000米的水層中,降低為0.1361。
⑤
海底熱泉的影響。在海底斷裂帶的裂縫處,常有海底熱泉,其含鹽量很高。例如紅海海盆中心區2000米深處的熱泉,水溫為45~48°C,鹽度為255~326,使附近海水中溶解成分的氯度比值和一般的海水差別很大。
中國沿海的海水中,主要溶解成分的氯度比值和大洋海水基本上一致。 海水的主要溶解成分,不僅以自由離子形式存在,還會由於締合作用而形成各種離子對,從而影響著海水的化學性質和物理性質。例如CaCO3在海水中溶解度較大,MgSO4對
聲波有較強的吸收作用。這方面的研究工作,主要是測定各種
離子對的
締合常數,計算出主要溶解成分存在形式的分配比例模型(見
海洋物理化學)。
統計數據
據統計,在海上遇難的人員中,飲海水的人比不飲海水的死亡率高12倍。這是為什麼呢?原來,人體為了要排出100克海水中含有的鹽類,就要排出150克左右的水分。所以,飲用了海水的人不僅補充不到人體需要的水分,反而脫水加快,最後造成死亡。
海水經過淡化處理後是可以飲用的。海水淡化的方法有幾十種,最主要的有
蒸餾法、
電滲法、冷凍法、
膜分離法等。蒸餾法是日前套用最多的方法,這種方法是先把水加熱、煮沸,使海水產生蒸氣,再把蒸氣冷凝下來變成蒸餾水。
在用蒸餾法製得的淡水中最好摻入少量(2%)潔淨海水或適量
礦化劑,這樣水味可口,還補充了蒸餾水中缺少而人體必需的無機鹽。
在海上遇險、救生等特殊情況下,為了節約淡水,可用部分海水與淡水混合飲用。有人做過試驗,人在短期內飲用海水與淡水各半的混合水,一般對人體是無害的,所以海水也是可以喝的。
淡化技術
海水淡化技術:非加壓吸附滲透海水淡化法
上個世紀90年代《美國化學文摘》收錄
攝取海洋甘泉
水是生命之源。不久以前,人類還沉迷於淡水是自然界取之不盡的無償賜品的神話,然而,工業化的蓬勃發展與人口的急劇增加無情地粉碎了這個神話。淡水危機甚至比糧食危機、石油危機還要來勢洶洶,解決
淡水資源問題已提到了人類的議事日程。在這種背景下,把海水、苦鹹水等含高鹽量的水轉化為生產、生活用水的海水淡化技術得到空前迅猛的發展。
淡化海水的方法已有十種之多,下面介紹的是其中最為主要的幾種。
蒸餾法
蒸餾法雖然是一種古老的方法,但由於技術不斷地改進與發展,該方法至今仍占統治地位。蒸餾淡化過程的實質就是
水蒸氣的形成過程,其原理如同海水受熱蒸發形成雲,雲在一定條件下遇冷形成雨,而雨是不帶的鹹味的。根據設備蒸餾法、蒸汽壓縮蒸餾法、
多級閃急蒸餾法等。此外,以上方法的組合也日益受到重視。
電滲析法
電滲析法亦換膜電滲析法。
該法的技術關鍵是新型離子交換膜的研製。
離子交換膜是0.5-1.0mm厚度的功能性膜片,按其
選擇透過性區分為正離子交換膜(陽膜)與負離子交換膜(陰膜)。電滲析法是將具有選擇透過性的陽膜與陰膜交替排列,組成多個相互獨立的隔室海水被淡化,而相鄰隔室海水濃縮,淡水與濃縮水得以分離。
電滲析法不僅可以
淡化海水,也可以做為水質處理的手段,為污水再利用做出貢獻。此外,這種方法也越來越多地套用於化工、醫藥、食品等行業的濃縮、分離與提純。
反滲透法
是1953年才開始採用的一種膜分離淡化法。該方法是利用只允許溶劑透過、不允許溶質透過的
半透膜,將海水與淡水分隔開的。在通常情況下,淡水通過半透膜擴散到海水一側,從而使海水一側的液面逐升高,直至一定的高度才停止,這個過程為滲透。此時,海水一側高出的水柱靜壓稱為
滲透壓。如果對海水一側施加一大于海水滲透壓的外壓,那么海水中的純水將反滲透到淡水中。反滲透法的最大優點是節能。它的能耗僅為電滲析法的1/2,蒸餾法的1/40。因此,從1974年起,美日等已開發國家先後把發展重轉向反滲透法。超過濾法,
宏大構想
尋找海水淡化新技術
隨著科技的飛速發展,壓力驅動反滲透膜分離技術(RO)在膜、膜組器、設備和工藝等方面都有了較大創新和改進,但人們也越來越意識到RO技術在節能、環保領域存在的局限,而且就脫鹽來講,RO技術可認為已接近發展的頂峰。因此,國外已經開展了“
正向滲透膜分離技術(FO)”的相關研究,並取得了一定的成果,在海水淡化、污水處理、食品加工、醫藥等領域得到了套用,特別是“
壓力延緩滲透(FRO)海水發電”,更是一項極具前景的清潔再生能源開發技術J。但是國內對正向滲透膜分離技術關注得很少,相關研究和論文也不多。雖然,上個世紀90年代我國有了創造性的發明“
非加壓吸附滲透法海水淡化”(CN92110710.2)。
正向滲透分離技術很早就得到了套用。很久以前,人們就採用食鹽來長期貯存食物,因為在高鹽環境下多數細菌、黴菌和病原菌由於
滲透作用會脫水死亡或暫時失去活性。如今,人們已經開始利用正向滲透
膜分離技術進行
海水淡化、工業廢水處理、垃圾滲透液處理等研究;食品工業在實驗室利用正向滲透膜分離來濃縮飲料;緊急救援時的
生命支持系統利用正向滲透膜分離技術製取淡水。隨著材料科學的發展,正向滲透技術已經套用於人體的藥物控制釋放。
非加壓滲透吸附法(90年代)
非加壓吸附滲透海水淡化法,或稱為“正向滲透法”,讓水通過多孔膜正向滲透進入一種超強吸水的吸附劑或鹽濃度甚至超過海水的溶液或固態物,不需要外界加壓,但溶液里的特殊鹽分"提取液"很容易蒸發,不需要加太多的熱(加熱能與反滲透加壓的能量比)。分固態鹽、液態鹽方向。固態鹽解吸附耗能更小。
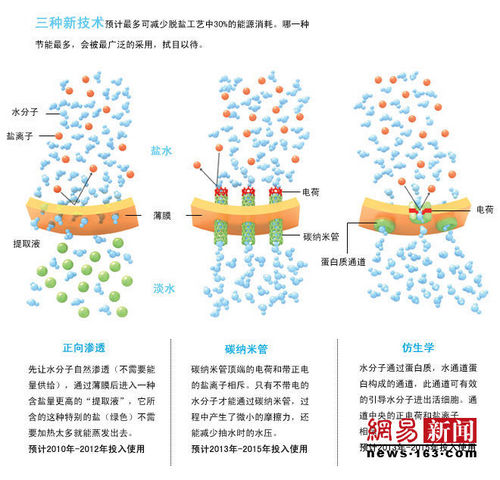
海水淡化技術:非加壓吸附滲透海水淡化法(CN92110710.2)1992年:《美國化學文摘》收錄。另外兩種方法都在薄膜結構上有了創新和改進
碳納米管薄膜
一種用碳納米管來做薄膜的小孔,另一種滲透用的薄膜。
活細胞蛋白質膜
薄膜的孔用引導水分子通過活細胞的細胞膜的蛋白質來構成。
反滲透機理
統一的“乾閉濕開”反滲透機理模型
有幾個經典模型
1.優先吸附毛細孔模型:弱點乾態電鏡下,沒發現孔。濕態膜標本不是電鏡的樣品。
2.溶解擴散模型:不認為有孔。
3.
乾閉濕開模型:上個世紀80,90年代能夠解釋1和2模型的統一的現代最貼切的逆滲透機理模型。既“乾閉濕開”
反滲透模型,統一了兩個最經典的反滲透機制模型,細孔模型,溶解擴散模型。
膜乾時,膜收縮緻密,孔隙閉合,電鏡下看不到
膜濕時,膜材料溶脹,膜的孔隙被溶劑溶脹,孔打開。合併就是“乾閉濕開”脫鹽模型。
海水來源
起初,科學家們堅信,海水是地球固有的。它們開始以
結構水、結晶水等形式貯存在礦物和岩石之中。以後,隨著地球的不斷演化,它們便從礦物、岩石中釋放出來,成為海水的來源。然而,一些科學家卻有不同看法。他們認為,這些“
初生水”就是從地面滲入的。近代興起的天體地質研究表明,在地球的近鄰中,無論是距太陽最近的金星、水星,還是距太陽更遠一些的火星,都是貧水的,唯有地球得天獨厚,擁有如此大量的水。所有這些,都讓科學家倍感奇怪,紛紛探討地球水的真正來源。其實,所有這些觀點還都是猜測,離真正揭開地球水源之謎的日子還很遙遠。
隨著
海洋化學的發展,人們逐漸認識了海水,已經確定海水含有80多種元素。這些元素在海水中的含量差別很大。
根據其含量的多少,大體上分為三類:每升海水中含有100毫克以上的常量元素;含有1毫克-100毫克的微量元素;含有1毫克以下的痕量元素。
海水作用
海水制食鹽
我國海鹽生產發展很快,沿海11個省、自治區、直轄市都有鹽田,鹽田面積比建國初期有了大幅度增長。所生產的海鹽質量也不斷提高,品種越來越多。除
原鹽外,已投入批量生產的有
洗滌鹽、粉碎洗滌鹽、精製鹽、
加碘鹽、餐桌鹽、腸衣鹽、蛋黃鹽和灘曬
細鹽,並在試製調味鹽、飼畜用鹽磚等。
海水變肥料
鉀元素在海水中占第六位,共有600萬億噸。
氯化鉀,是我們從海水中提取的肥料。鉀肥肥效快,易被植物吸收,不易流失。鉀肥能使農作物莖稈長得強壯,防止倒伏,促進開花結實,增強抗寒、抗病蟲害能力。海水中提鉀主要用來製造鉀肥。此外,鉀在工業上可用於製造含鉀玻璃,這種玻璃不易受化學藥品腐蝕,常用於製造化學儀器和裝飾品。鉀還可以製造肥皂,可用作洗滌劑。鉀
鋁礬(明礬)可用作淨水劑。
海水提溴
茫茫大海是化學
元素溴的“故鄉”,地球上99%以上的溴都在海水中,可謂源源溴素海中來。海水中溴含量約為65毫克/升,總量達100萬億噸。
我國1967年開始用“空氣吹出法”進行海水直接提溴,1968年獲得成功。青島、連雲港、廣西的
北海等地相繼建立了提溴工廠,進行試驗生產。“樹脂吸附法”
海水提溴也於1972年試驗成功。
為什麼不從海水中過濾掉鹽分獲得飲用水?
為什麼不從海水中過濾掉鹽分獲得飲用水?
淡化的能源
考慮到地球海洋中蘊含的廣袤的水資源,通過淡化海水也只能滿足人類飲用水總需求的不到0.5%。人類每年需要新鮮淡水總量960立方英里(4000立方公里),總體上地表的淡水足夠滿足需要。但是卻存在區域性的飲水匱乏問題。因此,為什麼我們不通過淡化更多的海水來緩解用水短缺和因用水發生的衝突?
問題在於,淡化海水需要大量的能源。鹽分在水裡溶化非常容易,形成的
化學鍵很難將之斷開。能源和海水淡化技術都是非常昂貴的,這意味著
淡化海水將是費用昂貴的技術途徑。
實際上,要對海水淡化產生的費用進行估算卻也不太容易--這個數字與所在地區、勞動力價格、能源費用、土地成本、金融融資成本密切相關,甚至與海水中含鹽分也相關。淡化1立方米(264加侖)海水的成本從1美元以下到2美元以上都有可能。
而如果從江河或者地下采水,所需費用會直線下滑到10-20%,農夫通常在用水上所費甚少。
這意味著用當地的淡水總是比海水淡化要便宜的多。雖然從趨勢上看,價格之間的差距在不斷減小。比如,通過尋找新水源或者築壩來滿足類似加州這種地方的飲用水需求,每立方米的成本相當于海水淡化成本的60%。
遺憾的是有時候這種傳統的獲取飲用水的辦法不再有效。而且,獲取水源的費用也在不斷上升,以至於加州這種地方開始嚴肅考慮是否通過
淡化海水來獲取飲用水,而類似佛羅里達州Tampa這種地方已經決定建造全美最大的海水淡化廠了。
國際海水淡化協會提供的數據表明,2007年全球有大約13000座海水淡化廠在工作。這些工廠每天的產出大約147億加侖(556億升)可飲用的淡水。大部分工廠都分布在沙特這種水比油貴的地方。
能源在淡化海水技術中的作用
有兩種辦法來斷裂海水中的鹽水化學鍵:熱蒸溜方法和薄膜滲透方法。熱蒸溜方法需要熱量:把海水煮沸,水分蒸發留下鹽分,然後將水蒸氣冷卻獲得液態淡水。
使用最普遍的薄膜滲透方法稱為
反滲透法。用半透膜將海水裡面的水分和鹽分分開。因為這種技術比提溜法便宜,因此大多數的淡化廠都採用這種方法,比如Tampa的淡化廠就是採用反滲透法
淡化海水。
需要注意的是,淡化海水也會產生環境成本。海洋生物隨著海水進入淡化廠後將被消滅殆盡,一些海洋生物比如小魚和浮游生物被消滅後會擾亂海洋里的食物鏈。另外,海水淡化產生的高純度鹽分如何處理也是個頭疼的問題。如果把這些高含鹽的廢水排入大海,那么本地的水生作物會受到嚴重傷害。處理這些環保問題難度不大,但是會增加淡化成本。
即便存在著經濟和環保上的種種問題,但如今人類耗盡其他水源的形勢下,海水淡化開始展現出吸引人的優勢。人類已經過度開採地表水,大地上遍布各種超出經濟和環境所能承受的大小水壩,只要是可資利用的江河,人類都將之堵塞。
雖然在有效合理利用現有水源上還有許多工作需要做,但是隨著世界人口的增長和水供應的縮減,海水淡化會越來越受到人們的青睞。


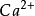





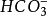

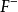
 海水
海水


