簡介
相平衡是熱力學在化學領域中的重要套用之一。研究多相體系的平衡在化學、化工的科研和生產中有重要的意義,例如:溶解、蒸餾、重結晶、萃取、提純及金相分析等方面都要用到相平衡的知識。一個系統可以是多組分的並含有許多相。當相與相間達到物理的和化學的
平衡時,則稱系統達到了相平衡。相平衡的
熱力學條件是各相的溫度和
壓力相等,任一組分在各相的化學勢相等。
相關概念
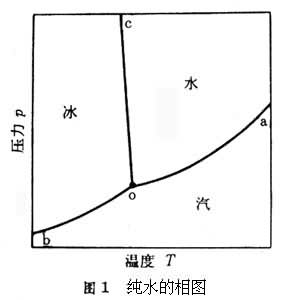
相圖
表示
平衡系統的
相態及相組成與系統的溫度、
壓力、總組成等變數之間的關係的圖形。
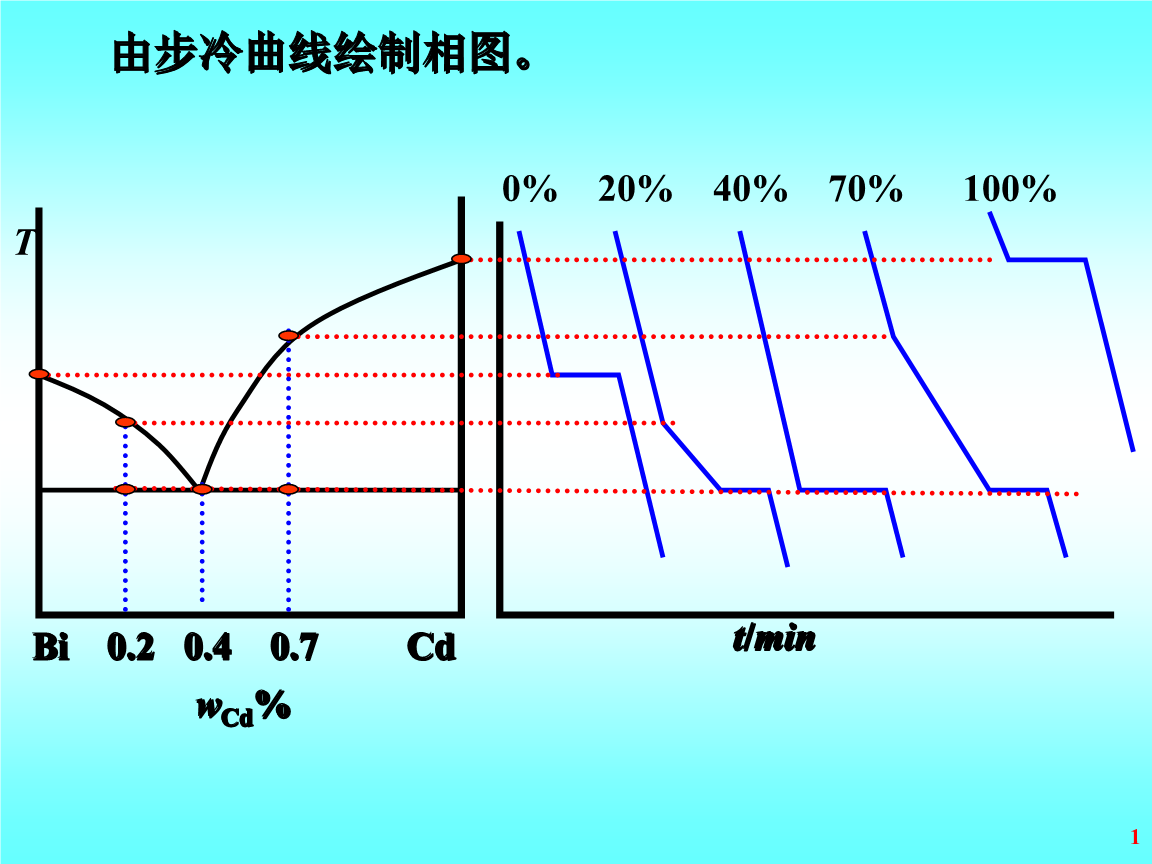
相圖都是根據實驗測定結果而繪製的。
 相平衡
相平衡相
體系內部物理和化學性質完全均勻的部分稱為相。相與相之間在指定條件下有明顯的界面,在界面上巨觀性質的改變是飛躍式的。體系中相的總數稱為相數,用Φ表示。
氣體:不論有多少種氣體混合,只有一個氣相。
液體:按互溶程度可組成一相、兩相或三相共存。
固體:一般有一種固體便有一個相。兩種固體粉末無論混合得多么均勻,仍是兩個相(固體溶除外,它是單相)
自由度
確定平衡體系的狀態所必須的獨立強度變數的數目稱為自由度,用字母f表示。這些強度變數通常是壓力、溫度和濃度等。
獨立組分數
在平衡體系所處的條件下,能夠確保各相組成所需的最少獨立物種數稱為獨立組分數。
類型及特點
化工熱力學研究的兩相系統的
平衡,有
氣液平衡、
氣固平衡、
汽液平衡、
汽固平衡、
液液平衡、
液固平衡和固固平衡;相數多於二的系統,有氣液固平衡、汽液液平衡等。系統處於相
平衡狀態時,各相的溫度、
壓力都相同,它們的組成一般不相同。相平衡的研究主要是通過實驗測定有關數據,並套用
相平衡關聯的方法,以探討平衡時溫度
T、
壓力p和各相組成(
摩爾分率
x、
y)之間的關係,藉以判斷一定條件下相變化過程的方向,並根據偏離相平衡的程度來估計過程推動力的大小。相平衡是
傳質分離過程和熱質
傳遞過程的理論基礎之一。例如:
蒸餾和吸收利用相
平衡時汽液或氣液兩相組成不同,通過相際
物質傳遞來實現混合物的分離;
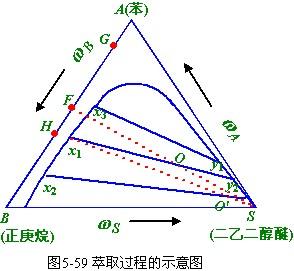
萃取根據物質在兩個不互溶或部分互溶的液相中溶解度的不同來實現混合物的分離;結晶利用固體在液體中溶解度的限制,從溶液中析出固體。這些過程都涉及物質在相際的傳遞。研究相平衡可為選擇合適的分離方法提供依據。在傳質設備(如
精餾設備、
萃取設備)的計算中,可用相平衡數據來計算設備的平衡級數或
傳質單元數。此外,相平衡研究還用於探討諸如
玻璃、陶瓷、
耐火材料、合金等材料的形成條件。 系統中
強度性質完全相同的部分稱為一相。相與相之間有明顯的界面 。一個相可以是連續的 ,也可以是不連續的(如分散的
液滴或
晶粒)。只有一相存在的系統稱為
單相或均相系統,有兩個以上的相存在的系統一般稱為
多相或非均相系統。
相律
f=C-p+2
式中f、C、p分別為系統的
自由度數、獨立
組分數和相數。f是確定系統的
平衡狀態所需的獨立的
強度性質的數目,這些獨立的強度性質可在一定的範圍內任意變化而不會引起相數的改變。系統的獨立組分數C可由下式確定:
C=S-R-R′
式中S為系統中的化學物質數目;R為系統中實際存在的獨立的化學反應數目;R′為除相平衡、化學平衡和各相中Σxi=1的條件之外,存在於各物質濃度之間的其他限制條件。
相平衡條件
在一個封閉的多相體系中,相與相之間可以有熱的交換、功的傳遞和物質的交流。對具有個相體系的熱力學平衡,實際上包含了如下四個平衡條件:
(1)熱平衡條件::設體系有α、β、‥‥‥、Φ個相,達到平衡時,各相具有相同溫度
Tα=Tβ=‥‥‥=TΦ
(2)壓力平衡條件::達到平衡時各相的壓力相等
pα=pβ=‥‥‥=pΦ
(3)相平衡條件:任一物質B在各相中的化學勢相等,相變達到平衡
μBα=μBβ=‥‥‥=μBΦ
(4)化學平衡條件:化學變化達到平衡
ΣνBμB=0

 相平衡
相平衡