原理
利用物質在兩種互不相溶(或微溶)的
溶劑中
溶解度或
分配係數的不同,使物質從一種溶劑內轉移到另外一種溶劑中。經過反覆多次萃取,將絕大部分的化合物提取出來。
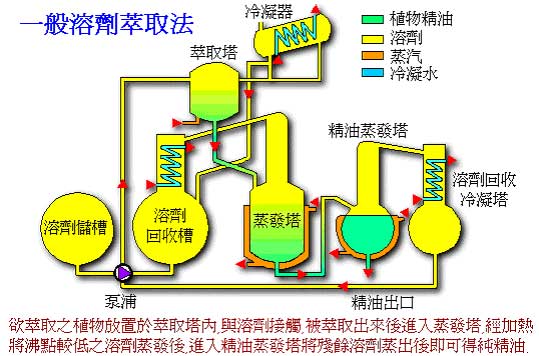 原理示意圖
原理示意圖溶劑萃取工藝過程一般由萃取、洗滌和反萃取組成。一般將有機相提取水相中溶質的過程稱為萃取(extraction),水相去除負載有機相中其他溶質或者包含物的過程稱為洗滌(scrubbing),水相解析有機相中溶質的過程稱為反萃取(stripping)。
分配定律是萃取方法理論的主要依據,物質對不同的溶劑有著不同的
溶解度。同時,在兩種互不相溶的溶劑中,加入某種可溶性的物質時,它能分別溶解於兩種溶劑中,實驗證明,在一定溫度下,該化合物與此兩種溶劑不發生分解、
電解、
締合和
溶劑化等作用時,此化合物在兩液層中之比是一個定值。不論所加物質的量是多少,都是如此。屬於
物理變化。用公式表示。
CA/CB=K
CA.CB分別表示一種
物質在兩種互不相溶地
溶劑中的量濃度。K是一個常數,稱為“
分配係數”。
有機化合物在
有機溶劑中一般比在
水中
溶解度大。用有機溶劑提取
溶解於
水的
化合物是萃取的典型實例。在萃取時,若在
水溶液中加入一定量的
電解質(如氯化鈉),利用“鹽析效應”以降低有機物和萃取溶劑在水溶液中的溶解度,常可提高萃取效果。
 分液漏斗
分液漏斗要把所需要的
溶質從溶液中完全萃取出來,通常萃取一次是不夠的,必須重複萃取數次。利用分配定律的關係,可以算出經過萃取後化合物的剩餘量。
設:V為原溶液的體積
w0為萃取前化合物的總量
w1為萃取一次後化合物的剩餘量
w2為萃取二次後化合物的剩餘量
wn為萃取n次後化合物的剩餘量
S為萃取溶液的體積
經一次萃取,原溶液中該化合物的濃度為w1/V;而萃取溶劑中該化合物的濃度為(w0-w1)/S;兩者之比等於K,即:
w1/V =K w1=w0 KV
(w0-w1)/S KV+S
同理,經二次萃取後,則有
w2/V =K 即
(w1-w2)/S
w2=w1 KV =w0 KV
KV+S KV+S
因此,經n次提取後:
wn=w0 ( KV )
KV+S
當用一定量
溶劑時,希望在水中的剩餘量越少越好。而上式KV/(KV+S)總是小於1,所以n越大,wn就越小。也就是說把溶劑分成數次作多次
萃取比用全部量的溶劑作一次萃取為好。但應該注意,上面的公式適用於幾乎和水不相溶地溶劑,例如
苯,
四氯化碳等。而與水有少量互溶地溶劑
乙醚等,上面公式只是近似的。但還是可以定性地指出預期的結果。
萃取劑和溶質互不發生反應 。
溶質在萃取劑中的溶解度遠大於在原溶劑中的
溶解度 。
沿革
1842年 E.-M.佩利若研究了用乙醚從硝酸溶液中萃取硝酸鈾醯。1903年L.埃迪蘭努用液態二氧化硫從
煤油中萃取
芳烴,這是
萃取的第一次工業套用。
20世紀40年代後期,生產
核燃料的需要促進了
萃取的研究開發。
方法
向待分離
溶液(料液)中加入與之不相互溶解(至多是部分互溶)的萃取劑,形成共存的兩個
液相。利用原溶劑與萃取劑對各組分的溶解度(包括經化學反應後的溶解)的差別,使它們不等同地分配在兩液相中,然後通過兩液相的分離,實現組分間的分離。如碘的水溶液用四氯化碳萃取,幾乎所有的碘都移到四氯化碳中,碘得以與大量的水分開。
最基本的操作是單級萃取。它是使料液與萃取劑在
混合過程中密切接觸,讓被萃組分通過相際界面進入萃取劑中,直到組分在兩相間的分配基本達到平衡。然後靜置
沉降,分離成為兩層液體,即由萃取劑轉變成的萃取液和由料液轉變成的萃余液。單級萃取達到
相平衡時,被萃組分B的相平衡比,稱為
分配係數K,即:
K=yB/xB
式中yB和xB分別為B組分在萃取液中和萃余液中的濃度。濃度的表示方法需考慮組分的各種存在形式,按同一化學式計算。
若料液中另一組分D也被萃取,則組分B的
分配係數對組分D的分配係數的比值,即B對D的分離因子,稱為選擇性係數α,即:
α=KB·KD=yB·xD/(xB·yD)
α>1時,組分B被優先萃取;α=1表明兩組分在兩相中的分配相同,不能用此萃取劑實現此兩組分的分離。
單級萃取對給定組分所能達到的萃取率(被萃組分在萃取液中的量與原料液中的初始量的比值)較低,往往不能滿足工藝要求,為了提高萃取率,可以採用多種方法:①多級錯流萃取。料液和各級萃余液都與新鮮的萃取劑接觸,可達較高萃取率。但萃取劑用量大,萃取液平均濃度低。②多級
逆流萃取。料液與萃取劑分別從
級聯(或
板式塔)的兩端加入,在級間作逆向流動,最後成為萃余液和萃取液,各自從另一端離去。料液和萃取劑各自經過多次萃取,因而萃取率較高,萃取液中被萃組分的濃度也較高,這是工業萃取常用的流程。③連續逆流萃取。在
微分接觸式萃取塔(見
萃取設備)中,料液與萃取劑在逆向流動的過程中進行接觸傳質,也是常用的工業萃取方法。料液與萃取劑之中,密度大的稱為重相,密度小的稱為輕相。輕相自塔底進入,從塔頂溢出;重相自塔頂加入,從塔底導出。萃取塔操作時,一種充滿全塔的液相,稱
連續相;另一液相通常以
液滴形式分散於其中,稱
分散相。分散相液體進塔時即行分散,在離塔前凝聚分層後導出。料液和萃取劑兩者之中以何者為分散相,須兼顧塔的操作和工藝要求來選定。此外,還有能達到更高分離程度的
回流萃取和
分部萃取。
套用
萃取與其他分離溶液組分的方法相比,優點在於常溫操作,節省能源,不涉及固體、氣體,操作方便。萃取在如下幾種情況下套用,通常是有利的:①料液各組分的沸點相近,甚至形成
共沸物,為
精餾所不易奏效的場合,如石油餾分中
烷烴與芳烴的分離,煤焦油的脫酚;②低濃度高沸組分的分離,用精餾能耗很大,如稀醋酸的脫水;③多種離子的分離,如礦物浸取液的分離和淨制,若加入化學品作分部沉澱,不但分離質量差,又有
過濾操作,損耗也大;④不穩定物質(如熱敏性物質)的分離,如從發酵液製取青黴素。
 多級液液萃取器
多級液液萃取器萃取的套用,目前仍在發展中。
元素周期表中絕大多數的元素,都可用
萃取法提取和分離。萃取劑的選擇和研製,工藝和操作條件的確定,以及流程和設備的設計計算,都是開發萃取操作的課題。
 分液漏斗
分液漏斗 用四氯化碳萃取碘水中的碘
用四氯化碳萃取碘水中的碘
 原理示意圖
原理示意圖 多級液液萃取器
多級液液萃取器