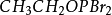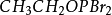分類
根據羥基所連羥基的種類,分為脂肪醇、脂環醇和芳香醇。脂肪醇又根據烴基部分是否含有不飽和鍵而分為飽和醇和不飽和醇。
根據分子中所含
羥基數目的不同,分為一元醇、
二元醇和三元醇等。含兩個或兩個以上羥基的醇統稱為
多元醇。
羥基連在雙鍵碳上的醇稱為
烯醇,烯醇結構一般不穩定,易
異構化為穩定的羰基化合物。
命名
習慣命名法
簡單醇常採用習慣命名法,即在與羥基相連的烴基名稱後加一個"醇"字.例如:甲醇、乙醇、丙醇等。
系統命名法
結構比較複雜的醇,採用系統命名法.
飽和醇的命名 選擇含有羥基的最長碳鏈為主鏈,從離羥基最近的一端開始編號,按照主鏈所含 的碳原子數目稱為"某醇".
不飽和醇的命名 不飽和醇的命名是選擇含羥基及不飽和鍵的最長碳鏈作為主鏈,從離羥基最近的 一端開始編號.根據主鏈上碳原子的數目稱為"某烯醇"或"某炔醇",羥基的位置 用阿拉伯數字表示,放在醇字前面.表示不飽和鍵位置的數字放在烯字或炔字的 前面,這樣得到母體的名稱,再在母體名稱前面加取代基的名稱和位置.
多元醇的命名選擇含-OH 儘可能多的碳鏈為主鏈,羥基的數目寫在醇字的前面,羥基的位次.
物理性質
醇類化合物受羥基的影響,存在分子間的氫鍵,在水中還有醇分子和水分子間的氫鍵。所以,它們的物理性質與相應的烴差異較大。主要表現在熔沸點比較高,在水中有一定的溶解度等。一般而言,低級的醇類水溶性較好,甲醇、乙醇和丙醇能與水以任意比例混溶。4~11個碳原子的醇為油狀液體,部分溶於水,以後隨著碳原子數增加,烴基對分子的影響越來越大,使高級醇的物理性質更接近於相應的烴。另外,低級的醇具有特殊的氣味和辛辣的味道,而高級的醇則無嗅、無味。
一些醇的物理性質如下圖。
結構
低級醇的熔點和沸點比碳原子數相同的碳氫化合物的熔點和沸點高得多,這是由於醇分子間有氫鍵締合作用的結果。實驗結果顯示,氫鍵的斷裂約需要21~30KJ/mo1,這表明它比原子間弱得多(105~418KJ/mol)。醇在固態時,締合較為牢固;液態時,氫鍵斷開後,還會再形成;但在氣相或非極性溶劑的稀溶液中,醇分子彼此相距甚遠,各個醇分子可以單獨存在。多元醇分子中有兩個以上位置可以形成氫鍵,因此沸點更高,如乙二醇沸點197℃。分子間的氫鍵隨著濃度增高而增加,分子內氫鍵卻不受濃度的影響。
以甲醇為例說明醇的結構。在甲醇分子中,碳氧鍵的鍵長為143pm,∠COH鍵角為108.9°顧一般認為醇羥基中氧原子為sp
3不等性雜化,氧原子的最外層的6個電子分布在4個sp
3雜化軌道上,其中2個含單電子的sp
3軌道分別與碳原子和氫原子形成碳氧鍵個氫氧鍵,剩下的兩對未共用電子分別占據另兩個sp
3軌道。氫氧鍵和氧上兩對未共用電子則與甲基的三個碳氫鍵呈交叉式優勢構象。甲醇的
鍵長、
鍵角以及甲醇和乙醇的
球棍模型如下所示。
 甲醇的鍵長,鍵角
甲醇的鍵長,鍵角 乙醇的球棍模型
乙醇的球棍模型 甲醇的球棍模型
甲醇的球棍模型由於碳和氧的
電負性不同,所以碳氧鍵是
極性鍵,醇是一個極性分子。一般情況下,醇的
偶極矩為5.7*10^-30Cm。但當羥基與雙鍵或三鍵碳相連時,氧的sp3雜化軌道則與碳的sp雜化軌道形成
σ鍵。
一般條件下,相鄰兩個碳原子上最大的兩個基團出於對交叉構象最為穩定,是優勢構象,但當這兩個基團可能以氫鍵締合時,由於形成氫鍵可以增加分子的穩定性(氫鍵的鍵能約為21~30KJ/mol)。兩個基團處於鄰交叉構象成為優勢構象。
有機醇結構推斷方法
實驗證明有機醇化合物的結構與其色譜保留指數有很好的相關性,當預測或預報某一醇時,首先計算其結構的拓撲指數,然後根據拓撲指數值通過回歸方程便可計算出其色譜保留指數I,進而在色譜相同條件下進行定性分析。同時也可以根據色譜保留指數推斷其結構式。
重要的醇
甲醇(木醇),製備甲醇是用合成氣(CO 和H2)在加熱、加壓和催化劑存 在下合成。
乙醇,俗稱酒精,套用最廣泛的一類醇。
乙二醇,是最簡單和重要的二元醇,為帶有甜味的黏稠狀無色液體。
丙三醇,俗稱甘油,是無色具有甜味的黏稠性液體,能與水 混合,不溶於有機溶劑,有強烈的吸水性。
化學性質
醇的酸性和鹼性
醇羥基的氧上有兩對孤對電子,氧能利用孤對電子與質子結合。所以醇具有鹼性。在醇羥基中,由於氧的電負性大於氫的
電負性,因此氧和氫共用的電子對偏向於氧,氫表現出一定的活性,所以醇也具有酸性。醇的酸性和鹼性與和氧相連的烴基的電子效應相關,烴基的吸電子能力越強,醇的鹼性越弱,酸性越強。相反,烴基的給電子能力越強,醇的鹼性越強,酸性越弱。烴基的空間位阻對醇的酸鹼性也有影響,因此分析烴基的電子效應和空間位阻影響是十分重要的。
醇羥基中氫的反應
由於醇羥基中的氫具有一定的活性,因此醇可以和金屬鈉反應,氫氧鍵斷裂,形成醇鈉和放出氫氣。
由於在液相中,水的酸性比醇強,所以醇與金屬鈉的反應沒有水和金屬鈉的反應強烈。若將醇鈉放入水中,醇鈉會全部水解,生成醇和氫氧化鈉。雖然如此,在工業上制
甲醇鈉或
乙醇鈉還是用醇與氫氧化鈉反應,然後設法把水除去,使平衡有利於醇鈉一方。常用的方法是利用形成
共沸混合物將水帶走轉移平衡。所沸共合物是指幾種沸點不同而又完全互溶的液體混合物,由於分子間的作用力,它們在蒸餾過程中因氣相和液相組成相同而不能分開,得到具最低沸點(比所有組分沸點都低)或最高沸點(比所有組分沸點都高)的餾出物。這些餾出物的組成與溶液的組成相同,直到蒸完沸點一直恆定,如乙醇一苯一水組成三元共沸混合物,其沸點為64.9℃(乙醇18. 5%,苯74%,水7.5%),苯一乙醇組成二元共沸混合物,其沸點為68.3℃(乙醇32.4%,苯67. 6%)。由於乙醇一水形成共沸混合物,其沸點為78℃(乙醇95. 57%,水4. 43%),所以乙醇中含有少量的水不能通過蒸餾方法除去,可計算加入比形成乙醇苯一水三元共沸混合物稍過量的苯,先將水除去,然後過量苯與乙醇形成二元共沸混合物除去,剩下為無水乙醇。醇鈉的醇溶液,可通過上述去水方法得到。醇鈉及其類似物在有機合成中是一類重要的試劑,並常作為鹼使用。
醇與含氧無機酸的反應
醇與含氧無機酸反應失去一分子水,生成無機酸酯。

醇與硝酸的反應過程如下:醇分子作為親核試劑進攻酸或其衍生物的帶正電荷部分,氮氧雙鍵打開,而後醇分子的氫氧鍵斷裂,硝酸部分失去一分子水重新形成氮氧雙鍵。
該類反應主要用於無機酸一級醇酯的製備。無機酸三級醇酯的製備不宜用此法,因為三級醇與無機酸反應時易發生消除反應。
醇與含氧無機酸的醯氯和
酸酐反應,也能生成無機酸酯。
含氧無機酸酯有許多用途。
乙二醇二硝酸酯和
甘油三硝酸酯(俗稱
硝化甘油)都是烈性炸藥。硝化甘油還能用於血管舒張、治療心絞痛和膽絞痛。科學家發現:硝化甘油能治療心臟病的原因是它能釋放出信使分子“NO”,並闡明了“NO”在生命活動中的作用機理。為此,他們榮獲了1998年諾貝爾生理學和醫學獎。
生命體的
核苷酸中有磷酸酯,例如
甘油磷酸酯與
鈣離子的反應可用來控制體內鈣離子的濃度,如果這個反應失調,會導致佝僂病。
醇羥基的取代反應
醇中,碳氧鍵是
極性共價鍵,由於氧的電負性大於碳,所以其共用電子對偏向於氧,當
親核試劑進攻正性碳時,碳氧鍵異裂,羥基被親核試劑取代。其中最重要的一個親核取代反應是羥基被鹵原子取代。常採用的方法如下:
1.與氫鹵酸的反應
(1)一般情況
氫鹵酸與醇反應生成鹵代烷,反應中醇羥基被鹵原子取代。
ROH+HX——>RX+H2O
醇羥基不是一個好的離去基團,需要酸的幫助,使羥基質子化後以水的形式離去。各種醇的反應性為3°>2°>1°,三級醇易反應,只需濃鹽酸在室溫振盪即可反應,
氫溴酸在低溫也能與三級醇進行反應。如用
氯化氫、
溴化氫氣體在0℃通過三級醇,反應在幾分鐘內就可完成,這是制三級鹵代烷的常用方法。
2.與鹵化磷反應
醇與鹵化磷反應生成鹵代烷。
醇羥基是一個不好的離去基團,與
三溴化磷作用形成
,Br進攻烷基的碳原子,-OPBr2作為離去基團離去。- OPBr2中還有兩個溴原子,可繼續與醇發生反應。
碘代烷可由三碘化磷與醇製備,但通常
三碘化磷是用
紅磷與碘代替,將醇、紅磷和碘放在一起加熱,先生成三碘化磷,再與醇進行反應。
上述方法中,最常用的是三溴化磷與一級醇、β位有支鏈的一級醇、二級醇生成相應溴代烷,在用二級醇及有些易發生重排反應的一級醇時溫度須低於0℃,以避免重排。紅磷與碘常用於一級醇制相應碘代烷。
3.與亞硫醯氯反應
若用
亞硫醯氯和醇反應,可直接得到氯代烷,同時生成二氧化硫和
氯化氫兩種氣體,在反應過程中這些氣體都離開了反應體系,這有利於反應向生成產物的方向進行,該反應不僅速率快,反應條件溫和,產率高,而且不生成其它副產物。一般用過量的亞硫醯氯並保持微沸,是一個很好的制氧代烷的方法。
4.經醇與磺醯氯反應為中間階段來製備鹵代烴
醇羥基必須在質子酸或路易斯酸催化下才可進行取代反應,而苯磺酸酯中酸根部分是很好的離去基團,因此這類酯比醇容易進行親核取代反應。
這樣將一級或二級醇通過與
苯磺醯氯反應形成磺酸酯,再轉為鹵代烷,純度很好。
磺醯氯可以由相應的
磺酸與五氯化磷反應來製備。
醇的氧化
一級醇及二級醇與醇羥基相連的碳原子上有氫,可以被氧化成醛、酮或酸;三級醇與醇羥基相連的碳原子上沒有氫,不易被氧化,如在酸性條件下,易脫水成烯,然後碳碳鍵氧化斷裂,形成小分子化合物。
1.用高錳酸鉀或二氧化錳氧化
醇不為冷、稀、中性的高錳酸鉀的水溶液所氧化,一級醇、二級醇在比較強烈的條件下(如加熱)可被氧化。一級醇生成羧酸鉀鹽,溶於水,並有
二氧化錳沉澱析出,中和後可得羧酸。
二級醇可氧化為酮。但由於二級醇用高錳酸鉀氧化為酮時,易進一步氧化使碳碳鍵斷裂,故很少用於合成酮。
三級醇在中性、鹼性條件下不易為高錳酸鉀氧化,在酸性條件下,則能脫水成烯,再發生碳碳鍵斷裂,生成小分子化合物。
高錳酸鉀與硫酸錳在鹼性條件下可製得二氧化錳,新制的二氧化錳可將β碳上為不飽和鍵的一級醇、二級醇氧化為相應的醛和酮,不飽和鍵可不受影響。
2.用鉻酸氧化
鉻酸可作為氧化劑的形式有:重鉻酸鈉與40%~50%硫酸混合液、鉻酐的
冰醋酸溶液、鉻酐與
吡啶的絡合物等。
一級醇常用重鉻酸鈉與40%~50%硫酸混合液氧化,先得醛,醛進一步氧化為酸。如控制合適的氧化條件,在氧化成醛後立即將其從反應體系中蒸出,可避免醛進一步被氧化為酸,反應需在低於醇的沸點,高於醛的沸點溫度下進行將丙醇滴加到溫度為~75℃的重鉻酸鈉,硫酸,水的溶液中,一旦生成
丙醛,就被蒸餾出來。這種反應產率不高,因為總有一部分醛氧化為酸。醛的沸點低於100℃才能用此法,因此它的用途是非常有限的。
二級醇常用上述幾種鉻酸氧化劑氧化,酮在此條件下比較穩定。因此是比較有用的方法。
用鉻酐與吡啶反應形成的鉻酐一雙吡啶絡合物是吸潮性紅色結晶,稱Sarrett(沙瑞特)試劑,可使一級醇氧化為醛,二級醇氧化為酮,產率很高,因為吡啶是鹼性的,對在酸中不穩定的醇是一種很好的氧化劑,反應一般在二氯甲烷中於25℃左右進行。分子中如有雙鍵、三鍵,氧化時不受影響。
二級醇還可以被Jones(瓊斯)試劑氧化成相應的酮,若反應物是不飽和的二級醇,用Jones試劑氧化時生成相應的酮而雙鍵不受影響,該試劑是把鉻酐溶於稀硫酸中,然後滴加到要被氧化的醇的丙酮溶液中,反應在15~20℃進行,可得較高產率的酮。
3.用硝酸氧化
一級醇能在稀硝酸中氧化為酸。二級醇、三級醇需在較濃的
硝酸中氧化,同時碳碳鍵斷裂,成為小分子的酸。環醇氧化,碳碳鍵斷裂成為二元酸。
4.Oppenauer氧化法
另一種有選擇性的氧化醇的方法叫做Oppenauer(歐芬腦爾)氧化法(oxidation methods),即在鹼如三級丁醇鋁或異丙醇鋁的存在下,二級醇和
丙酮(或
甲乙酮、
環己酮)一起反應(有時需加入
苯或
甲苯做溶劑),醇把兩個氫原子轉移給丙酮,醇變成酮,丙酮被還原成異丙醇。該反應的特點是,只在醇和酮之間發生氫原子的轉移,而不涉及分子的其它部分。所以在分子中含有碳碳雙鍵或其它對酸不穩定的基團時,利用此法較為適宜。因此該法也是由一個不飽和二級醇製備不飽和酮的有效方法。
5.用Pfitzner—Moffatt試劑氧化
一級醇在Pfitzner(費茲納)- Moffatt(莫發特)試劑的作用下,可以得到產率非常高的醛。這個試劑是由二甲亞碸和二環己基碳二亞胺組成。二環己基碳二亞胺英文名叫dicyclohexylcarbodiimide,簡稱為DCC,是二取代脲的失水產物。這是一個非常重要的失水劑(dehydrating agent)。如對硝基苯甲醇在磷酸和這個試劑的作用下,得到92%產率的
對硝基苯甲醛。
在這個反應中,環己基碳二亞胺接受一分子水,變為脲的衍生物,而
二甲亞碸變為
二甲硫醚。這個氧化劑也可用於氧化二級醇。
在進行氧化反應時必須注意:許多有機物與強氧化劑接觸會發生強烈的爆炸,岡此在使用高錳酸鉀、
高氯酸以及類似氧化劑時,一定要在溶劑中進行反應,因為溶劑可使放出的大量熱消散,減緩反應速率。
醇的脫氫
一級醇、二級醇可以在脫氫試劑(dehydrogenating agent)的作用下,失去氫形成羰基化合物,醇的脫氫一般用於工業生產,常用銅或銅鉻氧化物等作脫氫劑,在300℃下使醇蒸氣通過催化劑即可生成醛或酮。此外Pd等也可作脫氫試劑。

3.4醇、酚和醚的鹵素置換反應
3.4.1醇的鹵素置換反應
醇的鹵素置換反應是獲得鹵化物的重要方法,常用的鹵化劑是氫鹵酸和亞硫醯鹵、磷醯鹵及鹵化磷等。實際上,不論是哪種方法,不外乎是先將羥基變成更好的離去基團,然後用鹵素進行親核取代。
(1)氫鹵酸(鹵化氫)作鹵化劑
醇與氫鹵酸的反應一般為親核取代反應。能形成穩定碳正離子的底物可按SN1機理進行,其它反應通常為SN2機理。
醇的活性順序為叔醇>仲醇>伯醇(SN1);氫鹵酸(鹵化氫)的活性順序為HI>HBr>HCl>HF,低活性的鹵化劑可加入Lewis酸催化。
叔胺也可催化這類反應。see RU 2051889, Process for Preparing 2-Ethylhexyl Chloride-1(1993).
(2)亞硫醯鹵(鹵化亞碸)作鹵化劑
亞硫醯鹵與醇反應生成鹵代烷和二氧化硫與鹵化氫,易分離,在醇的鹵化中套用較廣,如頭孢哌酮鈉中間體氧哌嗪甲醯氯的合成。
就氯化亞碸氯化而言,在不同的反應條件下,其反應機理不盡相同。
DMF和HMPA可催化醇與鹵化亞碸的反應。DMF可與SOCl2反應生成氯代烯銨鹽:
該烯銨鹽可作為氯化劑實現醇的氯代。
類似地,HMPA與SOCl2的反應產物也是很好的氯化劑,其機理亦與DMF相同。
反應示例:HMPA催化的某伯醇的氯代。
有機鹼,如
吡啶,可以和鹵化氫成鹽而提高鹵離子濃度,也能提高此類反應速度,該法尤其適用於對酸敏感的底物。
無取代或供電子基取代的芳醛與溴化亞碸共熱,可得二溴苄。反應物中存在的微量的溴化氫對醛羰基的加成是反應的第一步。
在無水DMF中,氯化亞碸可將芳醛轉化為相應的二氯苄。
(3)鹵化磷作鹵化劑
三鹵化磷和五鹵化磷也是轉化醇為鹵代烷的常用試劑。其反應活性較氫鹵酸大,又較少發生重排反應。常用的鹵化磷是三氯化磷和三溴化磷,後者可由溴素與磷原位製備。
三鹵化磷與醇反應可生成亞磷酸單、雙和三酯,之後,鹵離子對上述磷酸酯發生取代,置換掉氧亞磷醯片斷,生成鹵代烷。
與鹵化亞碸類似,鹵化磷與DMF反應也能生成鹵代烯銨鹽,後者是高活性的鹵化劑,與醇反應可生成構型翻轉的鹵代烷。
(4)有機膦鹵化合物作鹵化劑
三苯基膦鹵化物,如Ph3PX2、Ph3PCX3X和(PhO)3POX2等,在對醇進行鹵化時,反應活性高,條件溫和。這些鹵化劑可由三苯基膦或亞磷酸三苯酯與鹵素或鹵代烷原位合成。
以下為其可能的反應機理,其中鹵素取代過程為SN2反應。
上述反應可在DMF或HMPA中進行,可使光學活性的醇轉化為構型翻轉的鹵代烷。也用於對酸敏感的醇的鹵化。
三苯基膦與N-鹵代醯胺(NXS)的反應產物也以類似機理髮生類似反應,適用於對酸不穩定的醇或甾醇的鹵化。
(5)其它鹵化劑
鹵矽烷試劑可在溫和條件下將醇轉化為鹵代烷。
NXS與二甲硫醚反應產物鹵代硫鎓鹽,對烯丙位和苄位羥基的取代有高度的選擇性,反應條件溫和,不影響其它伯、仲羥基。
甲磺酸/碘化鈉可在溫和條件下碘代烯丙位或苄位的羥基,這種選擇性可能與碳正離子的穩定性有關。
四甲基alpha-鹵代烯胺可在溫和條件下將伯、仲羥基以及烯丙位、炔丙位和苄位的羥基轉化為鹵代烴。其大位阻的類似物則可高選擇性地鹵代伯、烯丙位和苄位羥基。
其反應機理與DMF催化鹵化亞碸鹵化反應過程相同。
2-氯-3-乙基-苯並噁唑四氟硼酸鹽也以類似的反應機理成為溫和的鹵化劑。如前列腺素中間體的合成。
3.4.2酚的鹵素置換反應
酚羥基活性低,其鹵置換反應必須使用五鹵化磷或五鹵化磷/氧鹵化磷混合物,在較劇烈的條件下進行。對於某些底物也可單獨使用氧鹵化磷。
三苯基膦鹵化物也是轉化酚為芳鹵化合物的常用試劑。
又例如:
(R)-(+)- and (S)-(-)-2,2'-Bis(diphenyl phosphino)-1,1'-Binaphthyl(BINAP), Organic Syntheses, Coll. Vol. 8, P.57; Vol. 67, P.20.
羥基取代鹵素形成C-O-P結構是反應的第一步,繼之以鹵素對C上O的取代(加成消除)。
3.4.3醚的鹵素置換反應
醚可與氫鹵酸等物質反應生成鹵化物和羥基化合物(醇或酚),如四氫呋喃與甲醇和氯化亞碸反應生成4-氯丁甲醚。
醚氧原子的質子化一般是反應的第一步,然後是親核取代反應。
醚鍵斷開後,哪個片斷生成醇,哪個片斷生成鹵化物,取決於其吸電子能力。
BF3、BBr3等Lewis酸也可以類似機理裂解醚鍵。
see US 4595765, 1986.
三甲基矽鹵化物也是溫和的鹵化劑。
以三甲基氯矽烷/碘化鈉作碘化劑,不生成碘化氫,可高收率地獲得碘化物。
3.5羧酸的鹵素置換反應
常見的羧酸鹵素置換反應是羧羥基的置換和脫羧鹵置換。
3.5.1羧羥基的鹵素置換反應:醯滷的製備
羧酸可在一定條件下與亞硫醯鹵及鹵化磷等鹵化劑反應,生成混酸酐-醯鹵。
(1)鹵化亞碸作鹵化劑
鹵化亞碸是較為常用的羧酸鹵化劑,其優點在於鹵化後生成鹵化氫和二氧化硫,其本身沸點低、易除去,所以反應後易分離。
此反應對底物中的雙鍵、羰基或酯基等影響較小。可在過量的鹵化亞碸中進行,也可以苯或石油醚等作溶劑。
氯化亞碸是由羧酸合成醯氯最常用的氯化劑,它也可與酸酐反應生成醯鹵。
反應機理:
以上反應可被有機鹼(吡啶或DMAP等)和Lewis酸(ZnCl2等)催化。
(2)鹵化磷作鹵化劑
在鹵化磷中,鹵化劑的活性順序為五鹵化磷>三鹵化磷>三鹵氧磷。五氯化磷常用於活性較小的羧酸,尤其是具吸電子基的芳酸或芳香多元酸的醯氯化。
產物應與三氯氧磷有一定的沸點差,以利分離。
三鹵化磷可用於脂肪酸的醯鹵化。
三氯氧磷可與羧酸鹽反應生成醯氯。
反應機理,以三鹵化磷為例。
上述醯鹵化反應中,羧酸的活性順序為脂肪酸>芳香酸(供電子基取代的芳酸>未取代的芳酸>吸電子基取代的芳酸),這說明羧羥基對硫(磷)的親核進攻是控制步驟。
(3)草醯氯作氯化劑
草醯氯可在烴類溶劑中以溫和條件將羧酸轉化為醯氯,此法可避免氯化磷等其它氯化劑對底物中敏感基團的影響。
反應機理:
可見,上例中轉化羧酸為鈉鹽可以避免氯化氫的生成,從而減少對敏感基團的影響。
(4)其它鹵化劑
氰脲醯氯(三聚氯氰)可在三乙胺存在下,以溫和條件將羧酸轉化為醯氯。
與醇的鹵化類似,三苯基膦鹵化物和四甲基alpha-鹵代烯胺也可用於由羧酸制醯滷的反應。
3.5.2羧酸的脫羧鹵素置換反應
羧酸的銀鹽與溴或碘反應,生成比底物少一個碳的鹵代烴,稱為Hunsdiecker反應。
對於2-18個碳的飽和脂肪酸而言,該反應一般可獲得較好結果,同時,該反應也可用於芳香酸的脫羧鹵化。
上述反應中若有水存在則影響收率,甚至導致會失敗。用汞鹽代替不穩定的無水銀鹽,在光照條件下,其收率可高於銀鹽法。實際實施中可用羧酸、過量氧化汞與鹵素直接反應,操作簡單。
與Hunsdiecker反應相似,羧酸與金屬鹵化物(LiCl)、四乙酸鉛在苯或乙醚等溶劑中反應,生成脫羧氯化產物,稱為Kochi改良法。
此反應過程中不發生重排,尤其適用於仲、叔氯代烴及beta-季碳氯代烴的合成。
以下過程可能為其反應機理。
將羧酸與碘、四乙酸鉛在四氯化碳中進行光照,可發生脫羧碘化反應。稱為Barton改良法。伯或仲脂肪酸的反應一般較好,苯甲酸的反應收率一般在60%左右。
3.6其它官能團的鹵素置換反應
3.6.1鹵化物的鹵素交換反應
伯鹵化物與無機鹵化物之間的鹵素交換反應稱為Finkelstein反應。
以上脂肪族鹵化物的反應應為SN2機理。
類似的反應也可發生在芳香族鹵化物上。
其反應機理可能為加成-消除。溶劑可以使用DMF、丙酮或二硫化碳等非質子極性溶劑。
Lewis酸可以通過幫助鹵素離去而活化鹵代烴,所以,加入Lewis酸往往可以促進鹵素交換反應。
氟化可用氟化鈉、氟化鉀、氟化銀和氟化剃等,其中氟化鉀活性較高、價廉,常用。
氟化銻可選擇性地與同一碳原子上的多個鹵素反應,而不與單個鹵素反應。此特性可用來合成三氟甲基化合物。
18-冠-6醚可顯著提高用氟化鉀進行氟交換的收率。
3.6.2磺酸酯的鹵素置換反應
將醇羥基轉化為活性較高的磺酸酯,可在溫和條件下鹵代。此法即可避免醇的鹵化的副反應,也比鹵素交換有效。常用的鹵化劑有鹵化鈉、鹵化鉀、鹵化鎂和鹵化鋰等。
以上飽和碳上的磺酸酯-鹵素置換反應應為SN2機理。以下在不飽和碳上的磺酸酯-鹵素置換反應應為加成消除-機理。
3.6.3芳香重氮鹽的鹵素置換反應
芳香族重氮化合物的鹵素置換反應往往可以將鹵素引入到直接鹵化難以引入的位置。反應是以鹵化亞銅為催化劑,相應的氫鹵酸為鹵化劑進行,稱為Sandmeyer反應。
以上反應被認為是自由基機理。
芳香重氮鹽的碘置換反應中可不加銅催化劑,只需將重氮鹽與碘素直接加熱即可。製備
醇的工業生產
在工業生產上,除甲醇外,多數常用的簡單飽和一元醇是由烯烴做原料生產的,但在石油工業尚未興起之前,有些醇是靠發酵的方法生產的。
1.甲醇
最早是用木材乾餾法生產甲醇,故甲醇也叫木醇,1920年以後逐漸停止使用這個方法。幾乎所有的甲醇均用合成氣( synthesis gas)——一氧化碳和氫氣——催化轉化生產,即
CO+2
——ZnO/Cr2O3,400℃,20~30MPa——>CH3OH ΔH=-92KJ/mol
近20年來用活化的
氧化銅做催化劑,可在250℃,5~10MPa條件下進行反應,比上述條件更經濟。
從水中分餾甲醇,純度可以達到99%左右,要除去其中近1%的水,可加入適量的鎂,甲醇和鎂反應,生成
甲醇鎂,它和水反應生成不溶的
氧化鎂和甲醇,經蒸餾得無水甲醇(99.9%以上)。
目前合成法是製備甲醇最主要的方法。
高壓法是合成甲醇是發展最早、使用最廣的工業合成甲醇技術。高壓工藝流程是指使用鋅鉻催化劑,在300~400℃、30~35MPa高溫高壓下合成甲醇的工藝流程。原料是煤、水、空氣,在制水煤氣的反應中得到氫氣和一氧化碳,經除塵、脫硫、變換、水洗後就可用來合成甲醇。催化劑ZnO、三氧化二鉻,300~400℃、200~300大氣壓,平衡時甲醇蒸氣含量達10%,經冷卻、分離、粗製甲醇進入貯糟,氫氣和一氧化碳可繼續循環利用。粗甲醇的純度為80~93%,主要雜質為水、乙醇、二甲醚、異丁醇,經精製純度可達99%。
低壓法。ICl低壓法、魯奇低壓法;低壓法具有成本低的經濟優勢,採用活性好的銅系催化劑使反應溫度也有所降低。
目前生產甲酵的原料已逐步大規模地轉向石油和天然氣,化工網在天然氣產地可將甲烷和氧氣按9:1的體積比混合,在200℃和100個大氣壓的條件下,通過銅製管道反應製得甲醇。
2.乙醇
工業上生產乙醇的方法有糧食發酵法、木材水解法、亞硫酸鹽法、乙烯間接水合法、乙烯直接水合法、乙醛加氫法、一氧化碳和氫氣羰基合成法等。其中真正具有工業意義的,概括起來可以分為兩大類,即發酵法和乙烯水合法。發酵法是經典的乙醇生產方法,在一個相當長的時期里,它是許多國家乙醇的主要來源。先今世界全部飲用酒和75%的工業用乙醇仍是通過發酵法製得。近四十年來,發酵法被乙烯水合法所取代的趨勢越來越明顯。
乙烯水合法 工業上有兩種方法,一種是以硫酸為吸收劑的間接水合法;另一種是乙烯催化直接水合法。
①間接水合法 也稱硫酸酯法,反應分兩步進行。首先,將乙烯在一定溫度、壓力條件下通入濃硫酸中,生成硫酸酯,再將硫酸酯在水解塔中加熱水解而得乙醇,同時有副產物乙醚生成。間接水合法可用低純度的乙醇作原料、反應條件較溫和,乙烯轉化率高,但設備腐蝕嚴重,生產流程長,已為直接水合法取代。
②直接水合法 在一定條件下,乙烯通過固體酸催化劑直接與水反應生成乙醇:
另一種方法在烯烴酸催化下加水時,用磷酸做催化劑,在300℃和7MPa壓力下,把水蒸氣通人乙烯中,此法步驟簡單,沒有硫酸腐蝕及廢酸的回收利用問題,但需用高濃度的乙烯,且在高壓下操作,生產設備要求很高,且一次轉化成乙醇的量很少,要反覆循環,消耗能量較大。
上述兩法,成本差別不是很大,由於乙烯可大量地從石油加工得到,受到各國重視。
生產乙醇的第三種方法叫做發酵法(fermentation method),
發酵法 將富含澱粉的農產品如穀類、薯類等或野生植物果實經水洗、粉碎後,進行加壓蒸煮,使澱粉糊化,再加入一定量的水,冷卻至60℃左右並加入澱粉酶,使澱粉依次水解為麥芽糖和葡萄糖,然後加入酵母菌進行發酵製得乙醇。
3.正丙醇
工業上生產正丙醇是用
乙烯、一氧化碳和氫在高壓及加熱下,用鈷為催化劑進行反應得到醛,此反應稱羰基合成(oxo synthesis),醛進一步在催化劑作用下還原為醇,這是在工業上生產醛和醇的極為重要的方法。
上法也可用於生產高級醛,不過常生成兩種異構體,醛可進一步還原為醇。
4.乙二醇
最重要的二元醇是乙二醇,或稱1,2-乙二醇,俗名
甘醇。
乙二醇的工業生產方法是由
環氧乙烷加壓水合或酸催化下水合製得。
加壓水合要求用加壓設備及高溫,但後處理方便,因此用得很廣泛;而酸催化水合雖然不需要壓力設備,反應溫度也較低,但從產品中除去硫酸是相當麻煩的。用上述二法製取乙二醇,總產率均超過90%(按環氧乙烷計),同時都有副產品一縮二乙二醇和二縮三乙二醇,前者可作為溶劑,液壓制動設備的工作液體,織物的修飾和染色,後者可作為溶劑及增塑劑。
5.甘油
最重要的三元醇是
1,2,3-丙三醇,俗名甘油,是在嚴格冷卻條件下,將甘油滴入濃硝酸與濃硫酸的混合酸中反應形成的。
甘油的工業生產方法是用丙烯在高溫下氯化,得3-氯丙烯,然後與次氯酸反應,得1,3二氯-2-丙醇及2,3-二氯-1-丙醇的混合物,在鹼性條件下,經環化得3-氯-1,2-環氧丙烷,再水解得甘油。
鹵代烷的水解
鹵代烴和稀氫氧化鈉水溶液進行親核取代反應,可以得到相應的醇。

鹵代烴在NaOH鹼性溶液中易發生消除反應,為避免發生消除反應,可用
氫氧化銀代替氫氧化鈉。
羰基化合物的還原
醛、酮經催化氫化,或在
氫化鋁鋰、
硼氫化鈉、
乙硼烷、
異丙醇鋁和活潑金屬等還原劑的作用下可生成醇。羧酸衍生物經催化氫化或用氫化鋁鋰、硼氫化鈉、乙硼烷、活潑金屬等還原劑還原也能生成醇。