基本介紹
- 中文名:鍵角
- 外文名:bond angle
- 定義:分子內鍵與鍵的夾角
- 套用學科:化學
- 研究:分子
- 同類名詞:鍵能、鍵矩、鍵級
鍵角與分子構型,影響因素,孤對效應,重鍵效應,電負性效應,標示方法,共價單鍵化合物,共價雙鍵化合物,共價叄鍵化合物,彎曲鍵的化合物,
鍵角與分子構型
鍵角是共價鍵方向性的反映,與分子的形狀(空間構型)有密切聯繫。例如,水分子中兩個H—O鍵之間的夾角是104.5°,這就決定了水分子的角形結構。一般知道一個三原子分子中鍵長和鍵角的數值,就能確定這個分子的空間構型。二氧化碳分子中C—O鍵長是116pm,兩個C—O鍵的夾角是180°,二氧化碳是直線型分子。對於4個原子以上的分子,除知道鍵長和鍵角以外,還需知道兩面角,方可確定其空間構型。如甲烷分子中4個C—H鍵等長,每兩個C—H鍵間的夾角都是109°28′,每兩個H—C—H平面之間的兩面角都是120°,甲烷是正四面體型分子。氨分子中兩個N—H鍵間的夾角是 107°18′ ,N—H鍵長是101.9pm,是三角錐形分子。周期表中第VA族元素與鹵素 (X) 或H所形成的AB3型化合物均為氨分子狀結構,僅鍵長、鍵角大小有異。
周期表中,同族非金屬元素的氫化物或鹵化物,組成相似,分子結構相同,例如第ⅣA族元素形成的CH4、CCl4、SiH4、SiF4等,它們的分子均是正四面體結構。又如氧族的氫化物H2O、H2S、H2Se等,它們的分子均是V形結構。還有BF3、BCl3、SO3……鍵角120°只能是平面三角形(正三角),就是三角形頂點各有一個原子,中心原子處於三角形的重心 ,例如正六邊形的每個內角都是120度,苯的結構就是正六邊形。 水分子的鍵角
水分子的鍵角
 水分子的鍵角
水分子的鍵角鍵角會受分子內的結構改變的影響,如在NH3中,鍵角本應為109°28′,但由於N有一個獨立電子對,因此壓迫N原子,使鍵角減小,為107°18′。理論上可用量子力學近似方法算出鍵角,實驗上是用X射線衍射法或分子光譜法精確測定鍵角。
影響因素
鍵角與鍵長是決定分子構型的基本參數,除少數規則構型分子的鍵角與分子中中心原子價層中電子對的排布一致外,絕大多數分子的鍵角偏離標準鍵角。影響分子鍵角偏離的因素很多,但主要因素是中心原子價層中電子對的類型和成鍵原子的電負性。
孤對效應
孤電子對與成鍵電子對的電子云分布不同,成鍵電子又受到兩個成鍵原子核的吸引,電子云比較集中在鍵軸的位置,而孤電子對則只受中心原子核的吸引,在原子周圍占的體積比較“肥大”。孤電子對的這種特性,使它比鍵對更強烈的排斥相鄰電子對,導致孤電子對與相鄰電子對之間平均距離大於成鍵電子對與同一電子對之間的平均距離。因此,對於具有相同價層電子對總數的分子或離子來說,由於互斥作用的強弱不同,若中心原子價層軌道上存在孤電子對,則諸電子對在空間的排布就要偏離標準鍵角。孤電子對越多,鍵角愈小。
重鍵效應
分子中存在重鍵時,雖然  鍵電子不影響分子骨架,但由於重鍵中包含的電子數比單鍵中的電子數多,所占據的空間大於單鍵中的兩個電子所占據的空間,所以排斥力強。這樣多重鍵的存在,將進一步影響分子的鍵角,使得分子中含有重健的鍵角較大,而單鍵之間的鍵角較小。例如,X2C=O型分子,由於存在雙鍵,雙鍵一單鍵排斥大於單鍵—單鍵排斥,使鍵角<X一C一O大於1200,而鍵角<X一C一X的則小於1200。
鍵電子不影響分子骨架,但由於重鍵中包含的電子數比單鍵中的電子數多,所占據的空間大於單鍵中的兩個電子所占據的空間,所以排斥力強。這樣多重鍵的存在,將進一步影響分子的鍵角,使得分子中含有重健的鍵角較大,而單鍵之間的鍵角較小。例如,X2C=O型分子,由於存在雙鍵,雙鍵一單鍵排斥大於單鍵—單鍵排斥,使鍵角<X一C一O大於1200,而鍵角<X一C一X的則小於1200。

電負性效應
一中心原子和配位原子的電負性,也將影響分子的鍵角。當與中心原子鍵合的配位原子電負性增大時,成鍵電子對將向配位體方向移動,離中心原子較遠,使鍵對間的斥力減小,從而鍵角也隨之減小。即鍵角隨配位原子電負性的增加而減小。同理,當配位原子相同,中心原子不同時,隨中心原子電負性增大,價電子對偏向中心原子,電子對之間斥力增加,從而使生成的鍵角增大,即鍵角隨中心原子電負性增加增大。
標示方法
共價單鍵化合物
在只含共價單鍵的化合物中,如果中心原子的價態是兩價或兩價以上的,分子中就存在鍵角。中學教材中是用兩成鍵原子核間的連線表示共價鍵,用兩連線之間的夾角表示鍵角。例如,在水分子中,兩個H一O鍵之間的夾角為104.50。

在中學階段,為了便於學生理解,採用這種簡單的表示方法是可行的,上述的各種鍵角定義都是合理的。學習了價鍵理論後,鍵角的這種表示雖然在數值上是相同的,但涵義不一樣。根據價鍵理論,當氫氧兩個原子相化合時,氧原子以一個P軌道(例如Px沿著x軸的方向與H原子的1S軌道“頭碰頭”進行重疊,重疊的結果形成了H一O 共價鍵,重疊的電子云沿著兩個原子核的連線近似圓柱形對稱,其形狀類似於橄欖球。
共價鍵,重疊的電子云沿著兩個原子核的連線近似圓柱形對稱,其形狀類似於橄欖球。

共價雙鍵化合物
在這類化合物分子中,雙鍵的兩成鍵原子間既有 鍵,又有
鍵,又有 鍵,標示鍵角時是以
鍵,標示鍵角時是以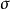 鍵為標準還是以
鍵為標準還是以 鍵為標準,應該明確。例如在乙烯分子中,碳原子採用SP2雜化形成三個SP2雜化軌道,分別與另一碳原子及兩個氫原子形成三個
鍵為標準,應該明確。例如在乙烯分子中,碳原子採用SP2雜化形成三個SP2雜化軌道,分別與另一碳原子及兩個氫原子形成三個 鍵,每個碳原子還剩有一個未參與雜化的P軌道,這兩個P軌道採用“肩並肩”的方式重疊,形成
鍵,每個碳原子還剩有一個未參與雜化的P軌道,這兩個P軌道採用“肩並肩”的方式重疊,形成 鍵。二鍵的形狀類似兩個“冬瓜”,分布在乙烯分子平面的上下方,並以這個平面為對稱面,不存在鍵的對稱軸。由於
鍵。二鍵的形狀類似兩個“冬瓜”,分布在乙烯分子平面的上下方,並以這個平面為對稱面,不存在鍵的對稱軸。由於 鍵沒有對稱軸,
鍵沒有對稱軸,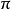 鍵與
鍵與 鍵之間無鍵角可言,顯然,碳碳雙鍵與碳氫單鍵間的鍵角,是指C-H
鍵之間無鍵角可言,顯然,碳碳雙鍵與碳氫單鍵間的鍵角,是指C-H 鍵與 C-C
鍵與 C-C  鍵之間的鍵軸的夾角。現行教材中用於表示雙鍵的兩根短線是完全相同的,哪一根短線代表
鍵之間的鍵軸的夾角。現行教材中用於表示雙鍵的兩根短線是完全相同的,哪一根短線代表 鍵從圖中看不出來,為了更直觀,可用一細短線表示
鍵從圖中看不出來,為了更直觀,可用一細短線表示 鍵,用一粗短線表示
鍵,用一粗短線表示 鍵,鍵角的標示就清楚了。
鍵,鍵角的標示就清楚了。


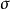




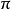







共價叄鍵化合物
含有共價叄鍵的化合物主要有炔類、月青類及疊氮化合物,其分子中單、叄鍵之間的鍵角,是指叄鍵中的。鍵與單鍵之間的角度。在鍵角的標示方法上,採用與共價雙鍵化合物的標示方法相似,用一根細短線表示叄鍵中的 鍵,用兩根粗短線表示兩個
鍵,用兩根粗短線表示兩個 鍵。含叄鍵的化合物分子中,單、叄鍵之間的鍵角的夾角,是指叄鍵中的a鍵鍵軸與單鍵鍵軸之間的夾角。
鍵。含叄鍵的化合物分子中,單、叄鍵之間的鍵角的夾角,是指叄鍵中的a鍵鍵軸與單鍵鍵軸之間的夾角。


彎曲鍵的化合物
通常所講的 鍵是成健電子云沿著原子核間的連線重疊的,具有對稱軸。另外也有某些特殊的化合物,其分子中形成一彎曲的
鍵是成健電子云沿著原子核間的連線重疊的,具有對稱軸。另外也有某些特殊的化合物,其分子中形成一彎曲的 鍵,稱為“彎曲鍵”。其鍵角的表示方法與一般的
鍵,稱為“彎曲鍵”。其鍵角的表示方法與一般的 鍵的鍵角表示方法是有區別的。
鍵的鍵角表示方法是有區別的。




