元素介紹 氧 (Oxygen)是一種化學元素,其原子序數為8,相對原子質量為16.00。在元素周期表中,氧是氧族元素的一員,它也是一個高反應性的第2周期非金屬元素,很容易與幾乎所有其它元素形成化合物(主要為氧化物)。在標準狀況下,兩個氧原子結合形成氧氣,是一種無色無臭無味的雙原子氣體,化學式為O
2 。如果按質量計算,氧在宇宙中的含量僅次於氫和氦,在地殼中,氧則是含量最豐富的元素。氧不僅占了水質量的89%,也占了空氣體積的20.9%。
構成有機體的所有主要化合物都含有氧,包括
蛋白質 、
碳水化合物 和
脂肪 。構成動物殼、牙齒及骨骼的主要無機化合物也含有氧。由藍藻、藻類和植物經過光合作用所產生的氧氣化學式為O
2 ,幾乎所有複雜生物的細胞呼吸作用都需要用到氧氣。動物中,除了極少數之外,皆無法終身脫離氧氣生存。但是對於厭氧性生物比如破傷風桿菌來說,氧氣是有毒的。這類厭氧型生物曾經是早期地球上的主要生物,直到25億年前氧氣開始在大氣層中逐漸積累。氧元素的另一個同素異形體是臭氧。在高海拔形成的臭氧層能夠隔離來自太陽的紫外線輻射。但是接近地表的臭氧則是一種污染,這些臭氧主要存在於光化學煙霧中。
發現歷史 1777年,法國化學家
拉瓦錫 提出燃燒的
氧化學說 ,指出物質只能在含氧的空氣中進行燃燒,燃燒物重量的增加與空氣中失去的氧相等,從而推翻了全部的燃素說,並正式確立
質量守恆定律 。從嚴格意義上講,發現氧元素的為
瑞典 化學家舍勒,而確定氧元素
化學性質 的為法國化學家拉瓦錫。
舍勒 在1608年,Cornelius Drebbel證明了加熱
硝石 (
硝酸鉀 ,KNO
3 )能釋放氣體。這就是氧氣,然而並沒有對它進行鑑定。
因發現氧而獲得的榮譽由3位
化學家 分享:一個英國人,一個瑞典人,還有一個法國人。
約瑟夫·普里斯特利 是第一位發布氧元素聲明的人,在1774年由聚焦陽光到
氧化汞 (HgO),然後收集釋放出的氣體實現。他注意到蠟燭在這裡燃燒的更明亮了,而且能使呼吸變得更簡單。普里斯特利不知道的是,
卡爾·威爾海姆·舍勒 (Carl Wilhelm Scheele)在1771年6月就製取了氧。他寫下了他的發現說明,但直到1777年才發布。
拉瓦錫 也聲稱發現了氧,並且他提議這種新的氣體叫做oxy-gène,意思是形成酸的,因為他認為這種元素是所有
酸性物質 的基礎。
2018年5月16日,大阪產業大學、
日本國立天文台 及
名古屋大學 等組成的團隊宣布,使用南美智利的ALMA射電望遠鏡發現距地球132.8億光年的獅子座方向銀河中存在氧。
元素分布 氧元素 占整個地殼質量的48.6%,是地殼中含量最多的元素,它在地殼中基本上是以氧化合物的形式存在的。每一千克的海水中溶解有2.8毫克的氧氣,而海水中的氧元素差不多達到了89%。就整個
地球 而言,氧的質量分數為15.2%。無論是人、動物還是植物,他們的細胞都有類似的組成,其中氧元素占到65%的質量。在空氣中,氧的體積占20.9%。
理化性質 物理性質 基本信息 液態氧 氧 (
Oxygen )是一種化學元素,其
原子序數 為8,
相對原子質量 為15.9994。由符號“O”表示。在
元素周期表 中,氧是氧族元素的一員,它也是一個高反應性的第2周期
非金屬元素 ,很容易與幾乎所有其它元素形成化合物(主要為氧化物)。在
標準狀況 下,兩個氧原子結合形成氧氣,是一種無色無臭無味的雙原子氣體,化學式為O
2 。如果按質量計算,氧在宇宙中的含量僅次於
氫 和
氦 ,在地殼中,氧則是含量最豐富的元素。氧不僅占了
水 質量的89%,也占了空氣體積的20.9%。
同位素
符號 質子 中子 質量(u) 半衰期 原子核 自旋 相對豐度 相對豐度變化量 12O
8
4
12.034405(20)
580(30)E-24 s [0.40(25) MeV]
0+
13O
8
5
13.024812(10)
8.58(5) ms
(3/2-)
14O
8
6
14.00859625(12)
70.598(18) s
0+
15O
8
7
15.0030656(5)
122.24(16) s
1/2-
16O
8
8
15.9949146 1956(16)
穩定
0+
0.99757(16)
0.99738-0.99776
17O
8
9
16.99913170(12)
穩定
5/2+
0.00038(1)
0.00037-0.00040
18O
8
10
17.9991610(7)
穩定
0+
0.00205(14)
0.00188-0.00222
19O
8
11
19.003580(3)
26.464(9) s
5/2+
20O
8
12
20.0040767(12)
13.51(5) s
0+
21O
8
13
21.008656(13)
3.42(10) s
(1/2,3/2,5/2)+
22O
8
14
22.00997(6)
2.25(15) s
0+
23O
8
15
23.01569(13)
82(37) ms
1/2+#
24O
8
16
24.02047(25)
65(5) ms
0+
25O
8
17
25.02946(28)#
<50 ns
(3/2+)#
26O
8
18
26.03834(28)#
<40 ns
0+
27O
8
19
27.04826(54)#
<260 ns
3/2+#
28O
8
20
28.05781(64)#
<100 ns
0+
備註: 畫上#號的數據代表沒有經過實驗的證明,只是理論推測而已,而用括弧括起來的代表數據不確定性。
化學性質 氧的化合價 :氧的化合價很特殊一般為-2價和0價。而氧在過氧化物中通常為-1價。在
超氧化物 中為-1/2,
臭氧化物 中氧為-1/3,這裡的化合價被稱為表觀化合價,就是表面上看出來的化合價沒有實際的含義,超氧化物中氧的化合價只能說是
超氧根 離子,不能單獨的看每個
原子 ,因為電子是
量子化 的,即不連續的,不存在1/2個電子,自然化合價也就沒有0.5的說法,臭氧化物也一樣,在過氧根中相當於是有兩個電子組成了電子對,所以這兩個電子不表現出化合價,所以過氧根離子整體呈-2價。而氧的正價很少出現,只有在和氟的化合物
二氟化氧 ,
二氟化二氧 和
氟鉑酸氧 (O
2 PtF
6 )中顯示+2價和+1價以及+0.5價,在中學化學中只要記住氧沒有最高正價。
實驗證明,除黃金外的所有金屬都能和氧發生反應生成
金屬氧化物 ,比如
鉑 在高溫下在純氧中被氧化生成
二氧化鉑 ,黃金一般認為不能和氧發生反應,但是有
三氧化二金 和
氫氧化金 等化合物,其中金為+3價;氧氣不能和
氯 ,
溴 ,
碘 發生反應,但是
臭氧 可以氧化它們。
氧氣瓶 在元素周期表中屬於
ⅥA族元素 ,化合價一般為0和-2。大多數元素在含氧的氣氛中加熱時可生成氧化物。有許多元素可形成一種以上的氧化物。
氧分子 在低溫下可形成水合晶體O
2 ·H
2 O和O
2 ·H
2 O
2 ,後者較不穩定。氧氣在水中的溶解度是4.89毫升/100毫升水(0℃),是水中生命體的基礎。氧在地殼中
豐度 占第一位。乾燥空氣中含有20.946%體積的氧;水有88.81%重量的氧組成。除了O
16 外,還有O
17 和O
18 等
同位素 。常見氧化態有-Ⅰ,-Ⅱ,0。共價半徑66pm,第一
電離勢 1314kJ/mol,
電負性 3.44。
與金屬的反應 化學方程式 現象 與鉀的反應
4K+O2 =2K2 O
鉀的表面變暗
2K+O2 =K2 O2
與鈉的反應
4Na+O2 =2Na2 O
鈉的表面變暗
2Na+O2 =Na2 O2
產生黃色火焰,放出大量的熱,生成淡黃色粉末
與鎂的反應
2Mg+O2 =點燃=2MgO
劇烈燃燒發出耀眼的強光,放出大量熱,生成白色粉末狀固體。
與鋁的反應
4Al+3O2 =點燃=2Al2 O3
發出明亮的光,放出熱量,生成白色固體。
與鐵的反應
(鐵鏽的形成)
3Fe+2O2 =點燃=Fe3 O4
紅熱的鐵絲劇烈燃燒,火星四射,放出大量熱,生成黑色固體。
與鋅的反應
2Zn+O2 =點燃=2ZnO
與銅的反應
2Cu+O2=加熱=2CuO
加熱後亮紅色的銅絲表面生成一層黑色物質。
與汞的反應
2Hg+O2 =加熱=2HgO
加熱後銀白色液體變成紅色固體
與非金屬的反應 化學方程式 現象 與氫氣的反應
2H2 +O2 =點燃=2H2 O
安靜地燃燒,產生淡藍色的火焰,生成水並放出大量的熱。[8]
與碳的反應
C+O2 =點燃=CO2
劇烈燃燒,發出白光,放出熱量,生成使
澄清石灰水 變渾濁的氣體。[9]
2C+O2 =點燃=2CO (氧氣不充足時)
與硫的反應
S+O2 =點燃=SO2
在空氣中燃燒,發出微弱的淡藍色火焰;在純氧中燃燒得更旺,發出藍紫色火焰,放出熱量,生成有刺激性氣味的氣體[10]。該氣體能使澄清石灰水變渾濁,且能使酸性
高錳酸鉀 溶液或
品紅 溶液褪色,褪色的品紅溶液加熱後顏色又恢復為紅色。
4P+5O2 =點燃=2P2 O5
發出耀眼白光,放熱,生成大量白煙。
P4 +5O2 =點燃=2P2 O5
白磷 在高於44攝氏度時會在氧氣中自燃,發光發熱,生成白煙。
與氮氣的反應
N2 +O2 =高溫或放電=2NO
製取方法 實驗室製法 1.加熱高錳酸鉀或錳酸鉀:
(製得的
氧氣 中含有少量
Cl2 、
O3 和微量
ClO2 ;部分教材已經刪掉;該反應實際上是放熱反應,而不是吸熱反應,發生上述1mol反應,放熱108kJ)。
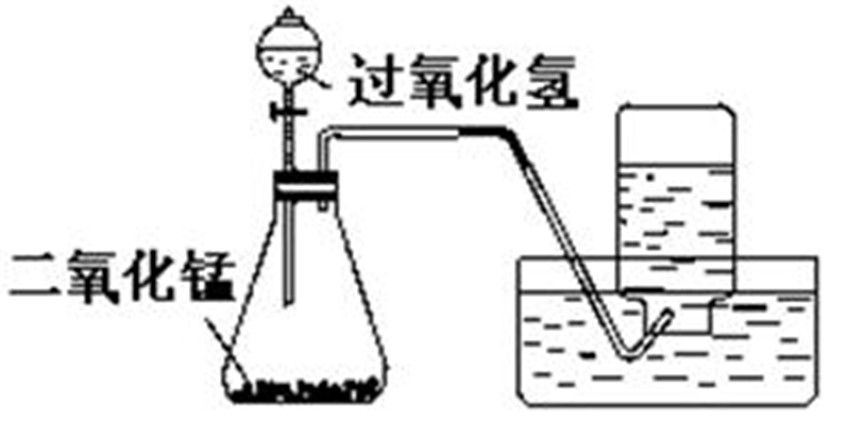
過氧化氫分解制氧氣 工業製法 1、分離液態空氣法
在低溫條件下加壓,使空氣轉變為液態,然後蒸發,由於液態氮的沸點是‐196℃,比液態氧的沸點(‐183℃)低,因此氮氣首先從液態空氣中蒸發出來,剩下的主要是液態氧。
空氣中的主要成分是氧氣和氮氣。利用氧氣和氮氣的沸點不同,從空氣中製備氧氣稱空氣分離法。首先把空氣預冷、淨化(去除空氣中的少量水分、二氧化碳、
乙炔 、
碳氫化合物 等氣體和灰塵等雜質)、然後進行壓縮、冷卻,使之成為液態空氣。然後,利用氧和氮的沸點的不同,在精餾塔中把液態空氣多次蒸發和冷凝,將氧氣和氮氣分離開來,得到純氧(可以達到99.6%的純度)和純氮(可以達到99.9%的純度)。如果增加一些附加裝置,還可以提取出
氬 、
氖 、
氦 、
氪 、
氙 等在空氣中含量極少的稀有惰性氣體。由空氣分離裝置產出的氧氣,經過壓縮機的壓縮,最後將壓縮氧氣裝入高壓鋼瓶貯存,或通過管道直接輸送到工廠、車間使用。使用這種方法生產氧氣,雖然需要大型的成套設備和嚴格的安全操作技術,但是產量高,每小時可以產出數千、萬立方米的氧氣,而且所耗用的原料僅僅是不用買、不用運、不用倉庫儲存的空氣,所以從1903年研製出第一台深冷空分制氧機以來,這種制氧方法一直得到最廣泛的套用。
2、膜分離技術
膜分離技術得到迅速發展。利用這種技術,在一定壓力下,讓空氣通過具有富集氧氣功能的薄膜,可得到含氧量較高的富氧空氣。利用這種膜進行多級分離,可以得到百分之九十以上氧氣的富氧空氣。
利用氮分子大於氧分子的特性,使用特製的分子篩把空氣中的氧分離出來。首先,用壓縮機迫使乾燥的空氣通過分子篩進入抽成真空的吸附器中,空氣中的氮分子即被分子篩所吸附,氧氣進入吸附器內,當吸附器內氧氣達到一定量(壓力達到一定程度)時,即可打開出氧閥門放出氧氣。經過一段時間,分子篩吸附的氮逐漸增多,吸附能力減弱,產出的氧氣純度下降,需要用真空泵抽出吸附在分子篩上面的氮,然後重複上述過程。這種製取氧的方法亦稱吸附法.利用吸附法制氧的小型制氧機已經開發出來,便於家庭使用。
把水放入電解槽中,加入
氫氧化鈉 或
氫氧化鉀 以提高水的電解度,然後通入直流電,水就分解為氧氣和氫氣。每製取一立方米氧氣,同時獲得兩立方米氫氣。用電解法製取一立方米氧氣要耗電12~15千瓦小時,與上述兩種方法的耗電量(0.55~0.60千瓦小時)相比,是很不經濟的。所以,電解法不適用於大量制氧。另外同時產生的氫氣如果沒有妥善的方法收集,在空氣中聚集起來,如與氧氣混合,容易發生極其劇烈的爆炸。所以,電解法也不適用於家庭制氧。
有氧氣生成的化學反應 2CuSO4 +2H2 O=通電=2Cu↓+2H2 SO4 +O2 ↑
電解水
2H2 O=通電=2H2↑ +O2 ↑
6CO2 +6H2 O—光,葉綠素→C6 H12 O6 +6O2 ↑
4AgNO3 +2H2 O =通電=4Ag↓+4HNO3 +O2 ↑
2F2 +2H2 O=O2 +4HF
2Al2 O3 =通電=4Al+3O2 ↑
4CuO=高溫=2Cu2O+O2↑
2HgO=△=2Hg+O2↑
2H2O2=2H2O+O2↑
4HNO3(濃) =光照= 4NO2↑ + O2↑ + 2H2O
2HClO=光照=2HCl+O2↑
臭氧的分解
2O3 =3O2
過氧化氫和氯氣的反應
H2O2+Cl2=2HCl+O2↑(此處首先生成的首先是
單線態氧 ,然後再聚合成鍵成氧氣)
存在形式 單質 氧氣
氧氣 ,空氣主要組分之一,比空氣重,標準狀況(0℃,101325帕)下密度為1.429克/升。無色、無味。在水中溶解度很小,273k時溶解度為49.1mol/L。壓強為101kPa時,氧氣在約-183攝氏度時變為淡藍色液體,在約-218攝氏度時變成雪花狀的淡藍色固體。氧分子具有
順磁性 。
臭氧
在常溫下,它是一種有魚腥臭味的藍色氣體。
臭氧 主要存在於距地球表面20~35公里的平流層頂部部的
臭氧層 中。在常溫常壓下,穩定性極差,在常溫下可自行分解為氧氣。臭氧具有強烈的刺激性,吸入過量對人體健康有一定危害。熔點21K,沸點160.6K,溶解度較大,273k時為494mol/L。具有反磁性。
化合物 氧化物
之前提到的幾乎所有元素都能與氧氣反應,得到的化合物中只有氧元素和另一種元素的二元化合物是氧化物,如水,CO2 。氧化物有多種多樣,主要分為:酸性氧化物,鹼性氧化物,兩性氧化物,不成鹽氧化物和假氧化物。另外還有一些只含有氧元素的基團也能形成氧化物,分為:過氧化物,超氧化物,臭氧化物等。
含氧化合物
含氧化合物泛指一切含有氧元素的化合物,比氧化物範圍大,對於組成物質的元素種類無要求。
特殊 這種氧分子可以穩定存在,預計構型為
正四面體 或者矩形,從兩種構型中性分子O
4 ,正一價分子O
4 + 和負一價分子O
4 - 的基態電子結構,並根據能量最低原則確定了各自的結構參數,從而得到了O
4 分子2種結構的基態總能量、一價電離能及電子親合勢能。與
氧原子 、普通氧分子O
2 和臭氧分子O
3 的計算結果比較,顯示O
4 分子可以以正方形結構或正四面體結構形式存在,其中正方形結構更有可能是O
4 分子的真實空間結構。
隨著室溫下
氧氣 的壓強超過10GPa,它將出人意料地相變為另一個同素異形體。它的體積驟減,顏色也從藍變成深紅。這種ε相發現於1979年,但當時它的結構並不清楚。基於它的紅外線吸收光譜,1999年,研究人員推斷此相態是O
4 分子的晶體。但在2006年,
X射線晶體學 表明這個被稱作ε氧或紅氧的穩定相態實為O
8 。此結構在理論上不曾被預測:由四個O
2 分子組成的菱形的O
8 原子簇。
氧中毒 氧雖對身體有益,但並非越多越好 ,氧氣含量過高時也會發生
氧中毒 ,氧中毒主要分以下三種類型:
肺型氧中毒 類似支氣管
肺炎 。其表現及通常的發展過程為:最初為類似
上呼吸道感染 引起的氣管刺激症狀,如胸骨後不適(刺激或燒灼感)伴輕度乾咳,並緩慢加重;然後出現胸骨後疼痛,且疼痛逐漸沿支氣管樹向整個胸部蔓延,吸氣時為甚;疼痛逐漸加劇,出現不可控制的咳嗽;休息時也伴有呼吸困難。在症狀出現的早期階段結束暴露,胸疼和咳嗽可在數小時內減輕。
腦型氧中毒 最初出現額、眼、鼻、口唇及面頰肌肉的纖維性顫動,也可累及手的小肌肉;面色蒼白、有異味感。繼而可有噁心、嘔吐、眩暈、汗、流涎、上腹部緊張;也可出現視力喪失、視野縮小、幻視、幻聽;還會有心動過緩、心悸、氣哽、指(趾)端發麻、情緒反常(憂慮、抑鬱、煩躁或欣悅)。接著出現極度疲勞、嗜睡、呼吸困難等。少數情況還可能發生虛脫。
眼型氧中毒 主要表現為
視網膜 萎縮。 早產
嬰兒 在恆溫箱內吸氧時間過長,視網膜有廣泛的血管阻塞、成纖維組織浸潤、晶體後纖維增生,可因而致盲。
早產兒因氧中毒失明 
 舍勒
舍勒 液態氧
液態氧 儲存氧氣的氧氣袋
儲存氧氣的氧氣袋 氧氣瓶
氧氣瓶



 早產兒因氧中毒失明
早產兒因氧中毒失明