定義 在化學反應前後,參加反應的各物質的質量總和等於反應後生成的各物質的質量總和。這就叫做質量守恆定律(Law of conservation of mass)。化學反應的過程,就是參加反應的各物質(反應物)的分子,破裂後重新組合為新的分子而生成其他物質的過程。在化學反應中,反應前後原子的種類沒有改變,數目沒有增減,原子的質量也沒有改變。在任何與周圍隔絕的體系中,不論發生何種變化或過程,其總質量始終保持不變。或者說,任何變化包括
化學反應 和
核反應 都不能消除物質,只是改變了物質的原有形態或結構,所以該定律又稱物質不滅定律。
解釋 在化學反應過程中,反應前後原子的種類沒有改變,
原子 的數目沒有增減,原子的質量也沒有變化。所以化學反應前後各物質的質量總和必然相等。
①化學變化中的“一定不變”:原子種類、原子數目、
原子質量 、元素種類、元素質量和反應前後各物質的總質量一定不變;
②化學變化中的“一定改變”;分子種類、物質種類一定改變;
③化學變化中的“可能改變”:分子數目可能改變,元素
化合價 。
驗證 20世紀初,德國和英國化學家分別做了精確度極高的實驗,以求能得到更精確的實驗結果,反應前後的質量變化小於一千萬分之一,這個誤差是在實驗誤差允許範圍之內的,因此質量守恆定律是建立在嚴謹的科學實驗基礎之上的。質量守恆定律就是參加化學反應的各物質的質量總和,等於反應後生成的各物質的質量總和。例如,把
鐵釘 放在
硫酸銅溶液 (藍色)里,當反應結束(會有明顯的反應現象)後,剩餘物質的質量將嚴格地等於鐵釘的質量和硫酸銅溶液的質量之和。實驗證明,物體的質量具有
不變性 。不論如何分割或溶解,質量始終不變。在任何化學反應中質量也保持不變。燃燒前碳的質量與燃燒時空氣中消耗的氧的質量之和準確地等於燃燒後所生成物質的質量。
方案一 在底部鋪有細沙的
錐形瓶 口,放入一粒火柴大的
白磷 。在錐形瓶口的
橡皮塞 上安裝一根
玻璃管 ,在其上端系牢一個小氣球,並使玻璃管下端能與白磷接觸。將錐形瓶與玻璃管放在
托盤天平 上用
砝碼 平衡。然後,取下錐形瓶。將橡皮塞上的玻璃管放到
酒精燈 火焰上灼燒至紅熱後,迅速用橡皮塞將錐形瓶塞緊,白磷引燃。待錐形瓶冷卻後,重新放到托盤天平上,觀察天平是否平衡。
磷 +氧氣點燃 =
五氧化二磷 (P+O
2 點燃P
2 O
5 )
P4 +5O2 =P4 O10 (條件:點燃)
實驗現象白磷燃燒發黃光,並且產生大量白煙,放出熱量,並且,天平平衡。這與
紅磷 燃燒相同
。 注意事項
1.白磷的取用及其注意事項:白磷是一種易自燃而又有劇毒的物質,通常把它貯存在水裡,切割白磷也在水中進行。取白磷,要用鑷子,不可用手接觸,表面的水分可用
濾紙 吸乾,接觸過的東西上往往有磷的碎粒,不能隨便亂放,白磷的碎粒和吸過白磷表面水分的濾紙,一定要燒掉以保證安全。
2.氣球的作用:系氣球的目的是為了防止由於白磷燃燒,放出大量熱量,氣體膨脹造成瓶塞被沖開。瓶內氣體膨脹時,氣球被吹大,冷卻時氣球縮進瓶內,起保護作用。
3.
誤差分析 :由於點燃白磷時需將橡皮塞上的玻璃管取出,放到酒精燈火焰上灼燒至紅熱後,再用橡皮塞將錐形瓶塞緊,這一操作會因為錐形瓶內空氣受熱膨脹和白磷燃燒產生的白煙逸出而造成實驗時托盤天平不平衡。
方案二在100mL
燒杯 中加入30mL的稀硫酸銅溶液,用
砂紙 將幾根鐵釘
打磨 乾淨,將盛有硫酸銅溶液的燒杯和鐵釘一起放在托盤天平上稱量,記錄所稱的質量m1。將鐵釘浸到硫酸銅溶液中,觀察實驗現象。待反應一段時間後溶液顏色改變時,將盛有硫酸銅溶液和鐵釘的燒杯放在托盤天平上稱量,記錄所稱的質量m2。比較反應前後的質量。質量守恆定律,即在化學反應中,參加反應的各物質的總和等於反應後生成的各物質總和。微觀解釋:在化學反應前後,原子的種類,數目,質量均不變。
範圍 ①質量守恆定律適用的範圍是所有化學變化,包括大部分的物理變化;
②質量守恆定律揭示的是質量守恆而不是其他方面的守恆。物體體積不一定守恆;
③質量守恆定律中“參加反應的”不是各物質質量的簡單相加,而是指真正參與了反應的那一部分質量,反應物中可能有一部分沒有參與反應;
④質量守恆定律的推論:化學反應中,反應前各物質的總質量等於反應後各物質的總質量
發展 1756年俄國化學家洛蒙諾索夫把
錫 放在密閉的容器里
煅燒 ,錫發生變化,生成白色的
氧化錫 ,但容器和容器里的物質的總質量,在煅燒前後並沒有發生變化。經過反覆的實驗,都得到同樣的結果,於是他認為在化學變化中物質的質量是守恆的。但這一發現當時沒有引起科學家的注意,直到1777年
法國 的
拉瓦錫 做了同樣的實驗,也得到同樣的結論,這一定律才獲得公認。但要確切證明或否定這一結論,都需要極精確的實驗結果,而拉瓦錫時代的工具和技術(小於0.2%的質量變化就覺察不出來)不能滿足嚴格的要求。因為這是一個最基本的問題,所以不斷有人改進實驗技術以求解決。1908年
德國 化學家廊道爾特(Landolt)及1912年英國化學家
曼萊 (Manley)做了精確度極高的實驗,所用的容器和反應物質量為1000g左右,反應前後質量之差小於0.0001g,質量的變化小於一千萬分之一。這個差別在實驗誤差範圍之內,因此科學家一致承認了這一定律。
化學反應因沒有原子變化,質量總是守恆的(無論是
動質量 還是
靜質量 )。根據
道爾頓 的
原子說 ,化學反應只是物質中原子的重新排列,反應前後原子種類及數目不變,又每個原子有固定質量,所以反應前後總質量不變。具體來說,化學反應裡面,物質的元素數目無論在反應前或反應後,都是一樣。化學反應中的質量守恆包括原子守恆、
電荷守恆 、
元素守恆 等幾個方面。
在任何與周圍隔絕的物質系統(
孤立系統 )中,不論發生何種變化或過程,其總質量保持不變,是自然界的基本定律之一。18世紀時法國化學家拉瓦錫從實驗上推翻了
燃素說 之後,這一定律始得公認。20世紀初以來,發現高速運動物體的質量隨其運動速度而變化,又發現實物和場可以互相轉化,因而應按
質能關係 考慮場的質量。質量概念的發展使質量守恆原理也有了新的發展,質量守恆和能量守恆兩條定律通過質能關係合併為一條守恆定律,即(在物理學中)質量和能量守恆定律(簡稱質能守恆定律)。
套用領域 物理套用 物理方面,質量守恆主要套用於解決
熱學 問題以及功能轉換,
化學套用 化學方面,質量守恆主要用於方程式的配平,以及化學元素物質的量計算,主要遵循下列規則。
六個不變:
巨觀:1.反應前後物質總質量不變; 2.元素的種類不變; 3.各元素對應原子的總質量不變;
微觀:4.原子的種類不變;5.原子的數目不變;6.原子的質量不變。
兩個一定改變:
巨觀:物質種類改變。
微觀:物質的粒子構成方式一定改變。
兩個可能改變:
巨觀:元素的化合價可能改變。
微觀:分子總數可能會改變。
綜合套用 (2)已知某反應物或生成物質量,根據化學方程式中各物質的質量比,可求出生成物或反應物的質量。
套用實例 質量守恆定律與化學方程式的綜合套用:
(1)根據質量守恆定律,參加化學反應的各物質的質量總和等於反應後生成的各物質的質量總和。利用這一定律可以解釋反應前後物質的質量變化及用質量差確定某反應物或生成物的質量。
(2)根據質量守恆定律,化學反應前後元素的種類和質量不變,由此可以推斷反應物或生成物的組成元素。
(3)根據質量守恆定律:化學反應前後元素的種類和原子的數目相等,推斷反應物或生成物的化學式。
(4)已知某反應物或生成物質量,根據化學方程式中各物質的質量比,可求出生成物或反應物的質量。
影響 自從
愛因斯坦 (Einstein)提出
狹義相對論 和質能關係公式
E=mc2 之後,說明物質可以轉變為
輻射能 ,輻射能可以轉變為物質。這個結論對質量守恆定律在化學中的套用有何影響呢?實驗結果證明1000g
硝化甘油 爆炸之後,放出的能量為8.0×10^6J。根據質能關係公式計算,產生這些能量的質量是8.9×10^-8g,與原來1000g相比,差別小到不能用實驗技術所能測定。從實用觀點來看,質量守恆定律是完全正確的。
20世紀以來,人們發現
原子核裂變 所產生的能量遠遠超過最劇烈的化學反應。1000g
鈾235 裂變的結果,放出的能量為8.23×10^16J,與產生這些輻射能相等的質量為0.914g,和原來1000g相比,質量變化已達到千分之一。於是人們對質量守恆定律就有了新的認識。在20世紀以前,科學家承認兩個獨立的基本定律:質量守恆定律和能量守恆定律。科學家則將這兩個定律合而為一,稱它為質能守恆定律。
愛因斯坦 1756年俄國M.V.羅蒙諾索夫首先測定化學反應中物質的質量關係,將錫放在密閉容器中燃燒,反應前後質量沒有變化,由此得出結論:“參加反應的全部物質的質量,常等於全部反應產物的質量。”1774年法國A.-L.拉瓦錫重複類似的實驗,並得出同樣的結論。
由於羅蒙諾索夫和拉瓦錫時代所用的天平不夠精密,所以後來又有不少科學家用更精確的方法證明這一定律。例如19世紀中葉,比利時分析化學家J.-S.
斯塔 用
銀 和
碘 製備
碘化銀 ,所得碘化銀的質量與碘和銀的總質量只相差0.002%。19世紀末,H.H.蘭多爾特用很精密的天平再一次證明這一定律的正確性。
20世紀,愛因斯坦推導出了狹義相對論,他指出,物質的質量和它的能量成正比,可用以下公式表示:E=mc
2 式中E為能量;m為質量;光速c=299792.458km/s (一般取300000km/s)。以上公式說明物質可以轉變為輻射能,輻射能也可以轉變為物質。這一現象並不意味著物質會被消滅,而是物質的靜質量轉變成另外一種運動形式。(由於當時科學的局限,這條定律只在微觀世界得到驗證,後來又在核試驗中得到驗證)所以20世紀以後,這一定律已經發展成為質量守恆定律和能量守恆定律,合稱質能守恆定律。
狹義相對論 發現者 哈伊爾·瓦西里耶維奇·羅蒙諾索夫(1711.11.19-1765.4.15),俄國百科全書式的科學家、語言學家、哲學家和詩人,被譽為俄國科學史上的
彼得大帝 。提出了“質量守恆定律”(物質不滅定律)的雛形。羅蒙諾索夫出生於
阿爾漢格爾斯克 一個漁民家庭,羅蒙諾索夫是
俄國科學院 的第一個俄國籍院士,他還是瑞典科學院院士和義大利波倫亞科學院院士。他創辦了俄國第一個化學實驗室和第一所大學莫斯科羅蒙諾索夫國立大學。

 愛因斯坦
愛因斯坦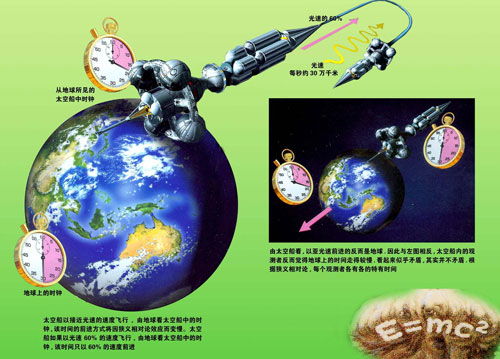 狹義相對論
狹義相對論

